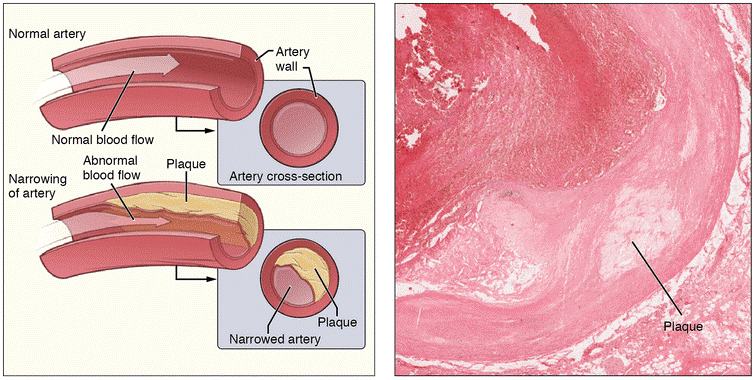
导读动脉粥样硬化(atherosclerosis,AS)是一种缓慢型临床疾病,是心血管疾病的核心,是引起心肌梗死、中风和周围血管疾病的导火索[1]。脂质代谢异常造成的脂质沉积是动脉粥样硬化最直接的致病因素,受累动脉病变从内膜开始,积聚的脂质外观呈黄色粥样,一般先有脂质和复合糖类的异常沉积,进而纤维组织增生及钙质沉着,并伴随着动脉中层逐渐蜕变和钙化,导致动脉壁增厚变硬、失去弹性以及血管腔狭窄。随着血管逐渐狭窄,病变又会累及不同器官,出现头晕、心痛、胸闷和顽固性高血压、糖尿病等症状,可以说动脉粥样硬化就像一颗“不定时炸弹”。目前我国是全球动脉粥样硬化疾病高发区,60岁以上老年人的发病率高达79.9%;并且近几年偏于年轻化趋势,严重影响人类的生命健康。动脉粥样硬化及动脉斑块简图[2]动脉粥样硬化是多因素共同作用引起的,发病机制较为复杂且尚未完全阐明。目前来看,大小鼠是动脉粥样硬化研究中最常用的物种,尽管有局限性,但其与人类的动脉粥样硬化过程的许多关键特征是相似的,仍然是动脉粥样硬化模型的首选物种。动脉粥样硬化的发展与胆固醇运输颗粒低密度脂蛋白(LDL)密切相关[3],主要为载脂蛋白E(ApoE)基因和低密度脂蛋白受体(LDLR)基因,可为动脉粥样硬化的治疗和预防提供参考依据。B-Apoe KO小鼠载脂蛋白E(Apolipoprotein E, ApoE)是一种与脂质颗粒相关的载体蛋白,主要由肝脏和外周组织中的巨噬细胞产生,是血浆脂蛋白的核心成分。ApoE将脂蛋白、脂溶性维生素和胆固醇输送到淋巴系统,然后进入血液,防止富含胆固醇的颗粒在血浆中积聚,是预防、治疗动脉粥样硬化血管疾病的主要靶点基因。研究表明,ApoE能够通过多种方式预防动脉粥样硬化[4]:促进循环系统中富含甘油三酯的脂蛋白的有效吸收;维持正常的巨噬细胞脂质稳态;调节免疫功能等。百奥动物BioMice利用基因编辑技术构建了B-Apoe KO小鼠。利用高脂饮食喂养诱导的小鼠胆固醇水平升高程度加大,硬块的形成进一步加剧,类似于人类动脉粥样硬化及动脉粥样硬化性心脏病中的饮食依赖性,可用于心血管疾病及阿尔兹海默症的研究。B-Apoe KO小鼠特殊饮食诱导动脉粥样硬化模型的建立(A-B)小鼠在12周和20周时的动脉粥样硬化斑块。(C-D)主动脉窦在第12周和第20周的油红结果。(E)12周时主动脉弓大体染色。12周时动脉粥样硬化小鼠模型的组织染色和血液生化结果(A)主动脉窦的H&E结果增加。(B-C)免疫组化显示α-SMA和F4/80的表达。(D)血清ALT、AST、TC、TG、HDL-C和LDL-C水平。数值以平均值±SEM表示。**p<0.01,***p<0.001。B-Ldlr KO大鼠低密度脂蛋白受体(Low density lipoprotein receptor, LDLR)是一种存在于网格蛋白包被的凹坑中的细胞表面受体,介导血浆中主要携带胆固醇的脂蛋白LDL的内吞作用,并且它能够结合APOE蛋白,从而清除血液中的脂蛋白颗粒,调节血浆胆固醇水平[5]。百奥动物BioMice利用基因编辑技术构建了B-Ldlr KO大鼠模型。尤其是当喂食高脂饮食时,这使Ldlr敲除大鼠成为研究动脉粥样硬化的良好模型进而具有重要的临床意义。这种大鼠可用于支持许多领域的研究,包括糖尿病、肥胖研究、过早患冠心病的风险及代谢研究等。B-Ldlr KO大鼠的模型验证及分析纯合Ldlrtm1/Bcgen大鼠在4个月大时表现出显著升高的血清胆固醇水平。PCSK与动脉粥样硬化的关系除了ApoE和LDLR基因外,还有其他与血脂调控相关的类似于PCSK9等靶点用于构建动脉粥样硬化模型,这些模型具有不同的致病机制和病理表型,助力动脉粥样硬化和高脂血症等疾病的研究及治疗药物的开发[6]。PCSK9是近年来在降脂药开发领域研究的一个新兴靶点,主要在肝脏中表达。PCSK9在LDL-C代谢中发挥重要作用。在肝细胞质膜,分泌的PCSK9的催化结构域与LDL-R结合并被内化,进入内体途径。内体的低pH值增强了PCSK9对LDL-R的亲和力,防止受体再循环到细胞表面。而PCSK9与LDL-R结合后再与LDL-C结合形成新的复合体进入溶酶体中一起被降解,最终导致LDL-R 减少,LDL-C的降解随之减少,从而使LDL-C的水平升高[7]。 PCSK9 在 LDL 受体 (LDL-R) 代谢中的作用[7]脂质代谢分析B-hPCSK9 小鼠的脂质代谢分析。分析 B-hPCSK9 小鼠和野生型 C57BL/6 小鼠(n=36,6周)TG、TC、LDL-C和 HDL-C 的血浆浓度。B-hPCSK9小鼠和野生型 C57BL/6 小鼠之间无差异。TG:甘油三酯;TC:总胆固醇;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇。药效验证抗人 PCSK9 抗体在 WD 诱导 B-hPCSK9 小鼠的体内有效性。B-hPCSK9 小鼠给予Alirocumab(内部)/Evolocumab(内部)或同型对照抗体(单次给药,s.c.)(n=8,雄鼠)。在第-5、1、3、5和8天采集血液进行分析。与同型对照相比,抗人 PCSK9 抗体给药组小鼠的血清 LDL-C(A) 和 TC(B) 水平降低,表明抗人 PCSK9 抗体可有效控制雄性 B-hPCSK9 小鼠的血脂。数值表示为平均值±SEM。TC:总胆固醇;LDL-C:低密度脂蛋白胆固醇。WD:西方饮食。抗人 PCSK9 抗体上调 B-hPCSK9 小鼠的 LDLR 水平。B-hPCSK9 小鼠给予Alirocumab(内部)/Evolocumab(内部)或同型对照抗体(单次给药,s.c.)(n=6,雄鼠)。在第8天采集肝组织用于 ELISA 分析。与同种型对照相比,抗人 PCSK9 抗体给药组小鼠中 LDLR 水平上调。数值表示为平均值±SEM。LDLR:低密度脂蛋白胆固醇受体。WD:西方饮食。表1. 动脉粥样硬化相关小鼠模型参考文献[1]Besa Emini Veseli,Paola PerrottaEuropean Journal of Pharmacology,Animal models of atherosclerosis,Volume 816, 5 December 2017.[2]Wikipedia/CC BY 3.0[3]Godfrey, S, Getz, Catherine, A, & Reardon. (2012). Animal models of atherosclerosis. Arteriosclerosis Thrombosis & Vascular Biology.[4]Jean Davignon, Jeffrey S.Cohn, et al. Apolipoprotein E and atherosclerosis: insight from animal and human studies.Clinica Chimica Acta.Clinica Chimica Acta.[5]Brown, Michael S, and Joseph L. Goldstein. A receptor-mediated pathway for cholesterol homeostasis. Science232.4746(1986): 34-47.[6]Gresham, G. A. (2017). Animal models of atherosclerosis. Biomedical Reports, 6(3), 259-266.[7]Hess, C. N., Low Wang, C. C. & Hiatt, W. R. PCSK9 Inhibitors: Mechanisms of Action, Metabolic Effects, and Clinical Outcomes. Annual review of medicine 69, 133-145
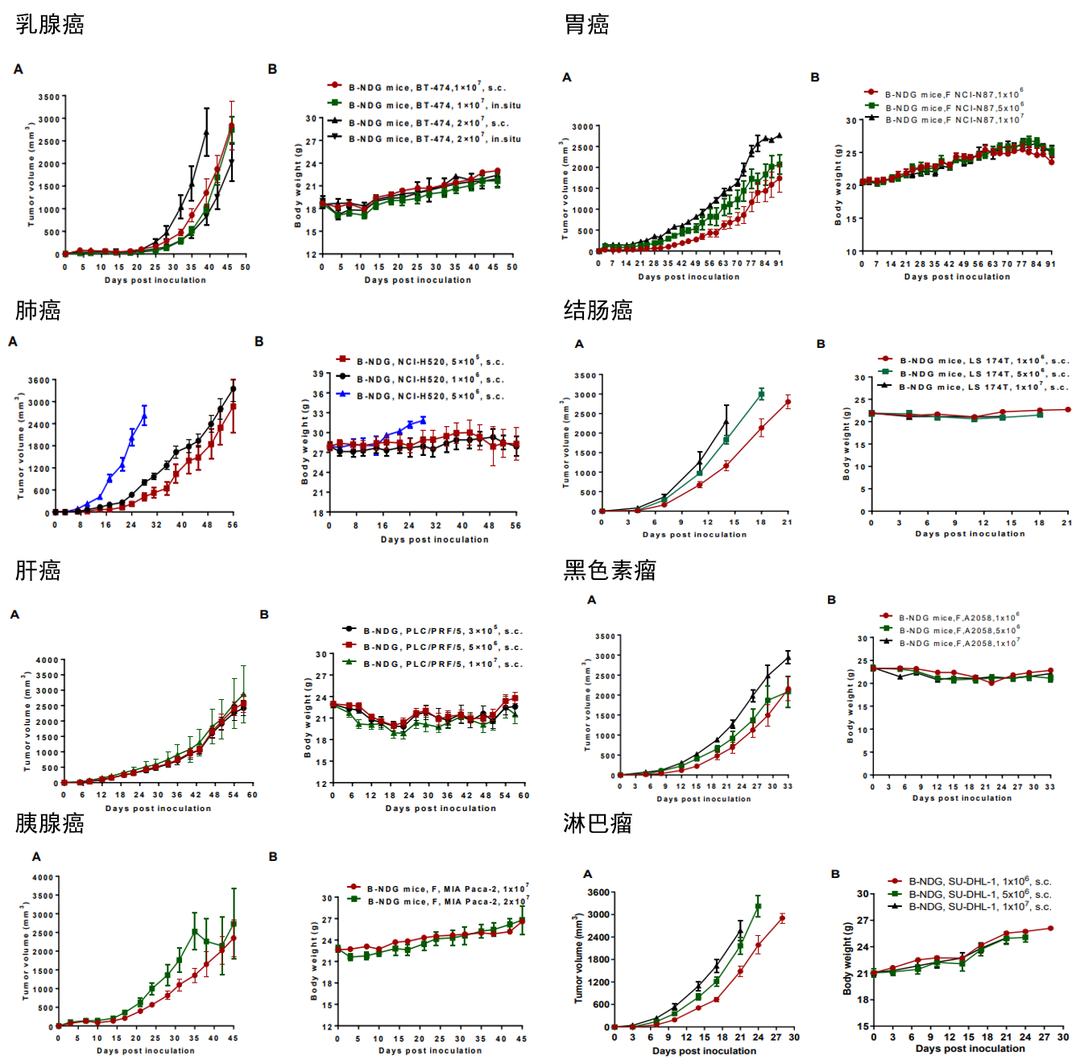
肿瘤动物模型的建立为研究肿瘤发生与转移的机制、筛选和评价抗肿瘤药物的药效提供了有力的工具。啮齿类动物小鼠,因为其具有繁育速度快,成本低,可进行基因修饰等诸多优点,基于其构建的各类肿瘤模型构成了临床前治疗性药物筛选的主要工具。小鼠肿瘤模型大致可分为自发性肿瘤小鼠模型、诱发性肿瘤小鼠模型、基因工程小鼠肿瘤模型、异种移植瘤模型(PDX或CDX)等。重建了人免疫系统的异种移植小鼠肿瘤模型(CDX或PDX)可同时具备人免疫系统和人肿瘤组织,更接近人体真实情况,实现了在动物体内模拟人类免疫系统和肿瘤之间的相互作用。细胞系异种移植模型(Cell line-derived xenograft, CDX)是将体外培养的人源的肿瘤细胞系通过皮下、静脉或者原位的方式接种至重度免疫缺陷小鼠(如B-NDG小鼠)或者是人源化免疫系统小鼠体内而构建的肿瘤模型。基于细胞系的肿瘤模型作为经典的体内实验方法,在肿瘤学研究和抗肿瘤药物研发过程中有着极大的需求。CDX模型具有实验周期短、建模成功率高、重复性高、动物个体成瘤差异较小、实验费用相对低等优点,可以用于开展药物靶点验证、药效学评价、PK/PD研究和多药协同药效评价等,是评估抗肿瘤药物免疫治疗效果的重要临床前动物模型。 图1. 异种移植小鼠肿瘤模型小鼠的CDX成瘤模型CDX皮下模型以重度免疫缺陷小鼠为例,我们已经完成了25种肿瘤细胞系的CDX模型构建,包括结肠癌、肺癌、乳腺癌、肝癌、胃癌、胰腺癌、淋巴瘤和黑色素瘤等。以下是百奥动物基于B-NDG小鼠建立的部分CDX成瘤模型展示。图2. B-NDG小鼠CDX模型成瘤数据CDX原位模型关于原位移植肿瘤模型,想要了解更多,请点击上图。CDX淋巴癌转移模型图3. Raji淋巴肿瘤细胞在B-NDG小鼠上能更有效地建立系统和转移肿瘤模型对B-NDG、NOD-scid BALB/C Nude小鼠通过尾静脉注射相同数量 (5× 105)的Raji细胞,在不同的时间点记录并分析小鼠的如下各种指标:(A) 细胞接种后记录小鼠生存情况,绘制Kaplan-Merier生存曲线。(B)细胞接种后每周小鼠体重变化(g),并计算出相对于接种当天的相对体重(C)小鼠外周血中人源细胞百分率变化。接种Raji細胞后,每周通过眼眶静脉丛采取100 以μl全血,提取DNA,通过q-PCR技术检测小鼠外周血中人源细胞比率。(D)接种Raji细胞后小鼠肝脏对比。接种后待小鼠体重下降超过30%后执行安乐死并解剖脏器,进行拍照。(E)接种Raji细胞后小鼠脏器免疫组化染色。一抗为鼠抗人线粒体膜蛋白抗体。结果表明,相对于NOD-scid小鼠B-NDG小鼠更适合建立人源肿瘤模型。利用CDX肿瘤模型进行药物体内药效评价B-NDG小鼠CDX淋巴瘤体内药效实验图4. 基于B-NDG小鼠的Raji淋巴癌转移模型及药效评价对B-NDG小鼠通过尾静脉注射相同数量(5x105)的Raji-Fluc细胞,并在第3天以及第10天尾静脉注射相同剂量的抗体X,之后在不同的时间点成像观察肿瘤生长状况。(A)不同时间点对小鼠成像观察肿瘤生长情况;(B)不同分组小鼠成像下肿瘤细胞荧光强度曲线。结果表明,早起抗体治疗(Raji细胞移植3天,10天给药)的治疗效果显著,晚期抗体治疗(Raji细胞移植10天给药)的治疗效果明显变差,基本无效。 B-NDG小鼠CDX模型抗人CD47抗体药效验证实验图5. B-NDG小鼠抗人CD47抗体的抗肿瘤活性将人淋巴B-lciferase-GFP Raji细胞(B ymphocytes)细胞通过尾静脉注射到B-NDG小鼠体内,利用小动物成像仪进行观察,待肿瘤荧光强度达到1E+06左右时将动物入组至对照组和治疗组(n=6)。(A)荧光成像仪监测小鼠肿瘤荧光,(B)治疗期间的体重变化。结果表明,3种抗体对B-NDG小鼠的肿瘤生长抑制均有效果。B-NDG小鼠是人CD47抗体有效性研究的有力模型。数值表示为平均值±SEM。B-NDG小鼠CDX模型CAR-T药效验证实验图6. CAR-T疗法在B-NDG小鼠中的抗肿瘤活性将B-luciferase-GFP Raji细胞(B lymphocytes)通过尾静脉植入B-NDG小鼠。当荧光强度达到约1E+06(n=6)时,将小鼠分组,用CAR-T细胞(1E+07)处理。(A)Raji-Luciferase细胞系经不同CAR-T细胞处理后的信号强度,(B)处理期间的体重变化。结果显示,4种CAR-T细胞在B-NDG小鼠中表现出不同地抑制肿瘤生长活性。结果表明,B-NDG小鼠可以作为CAR-T细胞治疗研究的有力模型。数值表示为平均值±SEM。 B-NDG小鼠CDX模型ADC药效验证实验 图7. ADC药物在几种CDX模型中的体内抗肿瘤疗效研究采用不同抗原表达水平的细胞系验证ADC药物的体内药效水平。如图7所示,在皮下接种了BT474和NCI-H1975的B-NDG小鼠肿瘤模型中,所有受试品ADC对肿瘤生长均表现出明显的抑制作用。在A431肿瘤模型中的抑制作用相对较弱,这与A431细胞上HER2的低表达水平相一致。CDX模型列表BioMice百奥动物一直在追求创新、不断的探索,以期为广大科研工作者提供优质的小鼠模型,助力科学研究以及药物开发!如您有关注的肿瘤相关动物模型,欢迎联系我们,获取更多百奥动物产品信息。

1978年,科学家首次发现CD24,即分化簇24(Cluster of differentiation 24),也称为热稳定抗原(heat-stable antigen,HSA),一种高度糖基化的糖基磷脂酰肌醇(GPI)锚定的膜蛋白。CD24没有胞内信号结构域,然而,几种信号转导蛋白与CD24活性相关,其中研究最充分的是Src家族激酶。CD24信号可影响细胞的增殖和生长,也可通过影响细胞间黏附作用进而促进肿瘤的侵袭和转移。纵观吞噬相关检查点抑制剂的发现历史:在过去的20年里,自第一个肿瘤吞噬相关检查点CD47-SIRPα通路被发现以来,其他肿瘤吞噬相关检查点PD1-PD-L1通路、MHC-I-LILRB1通路以及CD24-Siglec-10通路等被逐步发现,在识别吞噬相关检查点方面取得了很大的进展[1]。CD47作为第一个被发现的肿瘤吞噬相关检查点,在多种人类血液肿瘤中存在高表达。目前,CD47的一个主要难点是其在红细胞和血小板有表达,导致血液毒性。然而,研究表明,CD24不在人红细胞表达,不会产生贫血的副作用[2]。作用机制CD24可作为“别吃我”信号分子,与巨噬细胞上的分子Siglec-10相互作用,传递抑制性信号,抑制破坏性炎症反应,减少巨噬细胞吞噬作用,传递“别吃我”信号。CD24可以与现有疗法互补,是未来免疫治疗的潜在靶点。CD24-Siglec-10抑制吞噬作用的示意图[3]研究进展通过查询统计,目前针对CD24靶点进行开发的在研公司或机构有很多,适应症涉及自身免疫疾病、炎症、病毒感染和肿瘤等多个领域。随着针对CD24靶点作用机制的发现,需要更多的临床研究来检验靶点对不同类型的肿瘤的影响。百奥动物自研产品B-hCD24 mice plus,是靶向CD24抗体开发相关药物进行药效评价的优质模型。相信随着对CD24的开发,多个领域的药物研发势必会进入一个加速的时代。数据展示01基本信息02血红细胞蛋白表达分析流式细胞术分析纯合B-hCD24小鼠中的种属特异性CD24的表达。采集野生型小鼠和纯合B-hCD24小鼠的红细胞,结合种特异性抗CD24抗体通过流式细胞术进行分析。在野生型小鼠中可检测到小鼠CD24,但在B-hCD24小鼠中未检测到。在纯合B-hCD24小鼠中未检测到人CD24。03B细胞蛋白表达分析流式细胞术分析纯合B-hCD24小鼠中的种属特异性CD24的表达。采集野生型小鼠和纯合B-hCD24小鼠的血细胞和脾细胞,结合种特异性抗CD24抗体通过流式细胞术进行分析。在野生型小鼠血液(A)和脾脏(B)中均可检测到小鼠CD24。在纯合B-hCD24小鼠血液(A)和脾脏(B)中可检测到人CD24。04T细胞蛋白表达分析流式细胞术分析纯合B-hCD24小鼠中的种属特异性CD24的表达。采集野生型小鼠和纯合B-hCD24小鼠的血细胞和脾细胞,结合种特异性抗CD24抗体通过流式细胞术进行分析。在野生型小鼠血液中仅可检测到少量小鼠CD24(A),而在野生型小鼠脾脏中无法检测到小鼠CD24(B)。在纯合B-hCD24小鼠血液(A)和脾脏(B)中均未检测到人CD24。05NK细胞蛋白表达分析流式细胞术分析纯合B-hCD24小鼠中的种属特异性CD24的表达。采集野生型小鼠和纯合B-hCD24小鼠的血细胞和脾细胞,结合种特异性抗CD24抗体通过流式细胞术进行分析。在野生型小鼠血液(A)和脾脏(B)中未检测到小鼠CD24。在纯合B-hCD24小鼠血液(A)和脾脏(B) 中未检测到人CD24。06粒细胞蛋白表达分析流式细胞术分析纯合子B-hCD24小鼠中的种属特异性CD24的表达。采集野生型小鼠和纯合B-hCD24小鼠的血细胞和脾细胞,结合种特异性抗CD24抗体通过流式细胞术进行分析。在野生型小鼠血液(A)和脾脏(B)中可检测到小鼠CD24。在纯合B-hCD24小鼠血液(A)和脾脏 (B)中可检测到人CD24。07巨噬细胞蛋白表达分析流式细胞术分析纯合B-hCD24小鼠中的种属特异性CD24的表达。采集野生型小鼠和纯合B-hCD24小鼠的血细胞和脾细胞,结合种特异性抗CD24抗体通过流式细胞术进行分析。在野生型小鼠血液(A)和脾脏(B)中可检测到小鼠CD24。在纯合B-hCD24小鼠血液(A)和脾脏(B)中可检测到人CD24。08树突状细胞蛋白表达分析流式细胞术分析纯合B-hCD24小鼠中的种属特异性CD24的表达。采集野生型小鼠和纯合B-hCD24小鼠的血细胞和脾细胞,结合种特异性抗CD24抗体通过流式细胞术进行分析。在野生型小鼠血液(A)和脾脏(B)中可检测到小鼠CD24。在纯合B-hCD24小鼠血液(A)和脾脏(B)中可检测到人CD24。09CD24表达总结野生型小鼠与人的CD24表达谱不同,主要差别在于人红细胞不表达CD24但小鼠的红细胞表达。或可导致药物在野生型小鼠体内筛选时,可能会遇到在人中不会出现的血液毒性,干扰药物安全性、有效性的临床前评估。B-hCD24 mice plus人源化小鼠CD24表达谱与人一致,可有效避免相应风险。髓系细胞检查点相关产品列表参考资料1.Song Y, et al. Targeting macrophages in hematological malignancies: recent advances and future directions. J Hematol Oncol. 2022 Aug 17;15(1):110. doi: 10.1186/s13045-022-01328-x. 2.British Journal of Cancer (2013) 108, 1449–1459 | doi: 10.1038/bjc.2013.1023.Amira A Barkal, Irving L Weissman. CD24 signalling through macrophage Siglec-10 is a target for cancer immunotherapy. Nature. 2019 Aug;572(7769):392-396.
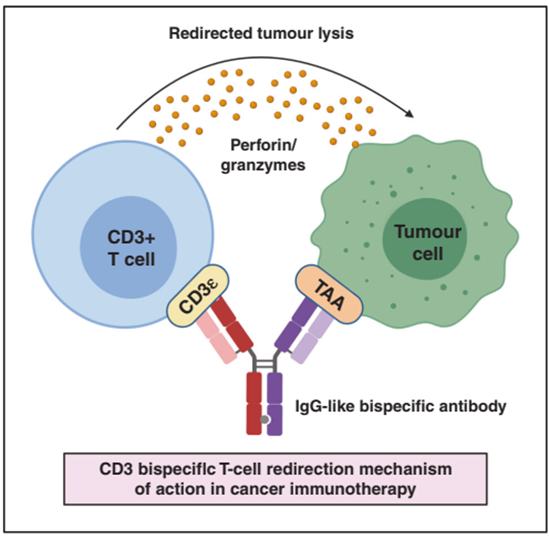
全球双抗市场规模目前快速上升,有多款双抗进入临床中后期。根据目前管线中项目数和适应症情况,Frost &Sullivan预测:“2030年全球双抗市场规模将达到800亿美元,2030年我国双抗市场规模将超过100亿美元。”我国双抗药物开发起步相对较晚,但随着未来双抗技术平台日益成熟,获批药物种类增多,预计我国双抗市场规模也将高速扩张,2030年我国双抗市场规模预计将达108亿美元,2022至2030年复合增长率高达81.7%。 CD3 双抗介绍由于CD3与T细胞的激活密切相关,因此利用人CD3和肿瘤相关抗原(TAA)的双特异性抗体进行抗肿瘤治疗的手段被广泛研究。CD3×TAA 双抗又称为 T 细胞连接器(Bispecific T-cell engager, BiTE)。CD3双特异性抗体作用机制如下图所示,CD3×TAA双抗两个臂分别靶向T细胞表面抗原CD3和肿瘤细胞表面相关抗原TAA,从而拉近了肿瘤细胞与效应T细胞的距离,绕过了T细胞必须经过MHC-抗原肽与TCR形成复合物,以及共刺激分子的结合才能被激活的经典激活之路。激活的T细胞释放颗粒酶,穿孔素,从而有效杀伤肿瘤细胞。CD3×TAA双抗的作用机制[1]CD3双抗最新研究进展据统计,目前正在开发中的双特异性抗体有 50% 为 CD3 双抗。国内方面对于CD3靶点也热度不减。目前企业自主研发的CD3双抗约30多个,如针对市场表现良好的CD3×CD19靶点(Blincyto),绿竹生物、健能隆、爱思迈等制药企业在此靶点均有布局,以及CD3×CD20为目前竞争最为激烈的双抗靶点组合之一,在国内,目前已经有5款申报临床包括再鼎医药(再生元),嘉和生物,爱思迈生物,康诺亚/诺诚健华和Genmab和艾伯维。数据来源于科睿唯安及公开信息整理BioMice百奥动物自主研发了多个CD3×TAA小鼠模型,为双抗或三抗或多抗药物体内药效和安全性评价提供了有力工具。部分数据展示如下。B-hCD3E mice基本信息功能分析:体外刺激T细胞分泌细胞因子及双抗体外杀伤人源化小鼠的T细胞,在体外经CD3+ CD28刺激后,IL-2分泌增加,表明人源化改造后Th1细胞功能正常。人源化小鼠脾细胞+过表达MC38 细胞系+双抗孵育48h后,检测细胞裂解产生的LDH,结果显示CD8+ T细胞功能正常。双抗药效验证B-hCD3E mice+MC38-hCD19接种MC38-hEpCAM至B-hCD3E纯合小鼠皮下,肿瘤组织接近150±50mm3时分组进行体内药效评价实验(n=6)。 结果显示高剂量hCD3E抗体(Blinatumomab)可显著抑制肿瘤生长,证明B-hCD3E小鼠模型是体内评价抗hCD3E双特异性抗体疗效的有力工具。单抗药效验证人源化小鼠中mPD-1抗体显著抑制肿瘤生长(A),这表明CD3E人源化没有影响T细胞功能。抗hCD3抗体处理后肿瘤生长较快(A),B细胞占比没有明显差异(B),T细胞占比明显下降(C),这表明hCD3抗体处理的肿瘤快速生长是由于T细胞过度激活耗竭(AICD)导致的。肿瘤标记物Ab(X)药效验证人源化小鼠中高剂量CD3双抗X抑制了肿瘤生长(A),治疗期间小鼠体重没有变化(B),B-hCD3E小鼠血液中B细胞(C)和T细胞(D)的比例没有明显变化。CD3双抗X在保持抑瘤效果的同时,没有产生过度激活T细胞的毒性,表明,B-hCD3E小鼠可作为CD3双抗临床前药效和毒性评价有力的研究模型。 三特异性抗体介绍三特异性抗体拥有三种特异性抗原结合位点,可以同时与靶细胞、功能细胞(一般为T细胞)相互作用,进而增强对靶细胞的杀伤。与单克隆抗体相比,三抗增加了两个特异性抗原结合位点,有利于将药物重定向至肿瘤局部,增加结合特异性,提升药物靶向肿瘤细胞的准确性,降低脱靶毒性。三特异性抗体作用机制[2]三特异性抗体最新研究进展全球已有多家生物医药企业布局三特异性抗体,赛诺菲作为三抗研发赛道的“领跑者”,目前已有3个三特异性抗体产品进入临床试验I期阶段,其中SAR442257是一款靶向CD3×CD28×CD38的三特异性抗体,它在体外试验中表现出比CD38单克隆抗体高1000~10000倍的骨髓瘤细胞杀伤活性。拟开发的适应症包括多发性骨髓瘤和非霍奇金淋巴瘤。除赛诺菲外还有诺华、罗氏是这一赛道的先行者。国内基石药业、嘉和生物等也都在布局三抗管线。数据来源于科睿唯安及公开信息整理B-hCD3E/hCD28 mice基本信息蛋白表达分析取野生型小鼠和纯合B-hCD3E/hCD28小鼠脾细胞,用种属特异性抗CD3E抗体进行流式细胞术分析。如图所示,小鼠CD3E在野生型小鼠中检测到。人CD3E仅在纯合B-hCD3E/hCD28小鼠中检测到,而在野生型小鼠中检测不到(A)。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD3E/hCD28小鼠中检测到,而在野生型小鼠中检测不到(B)。B-hCD3E/h4-1BB mice基本信息蛋白表达分析取野生型小鼠和纯合B-hCD3E/h4-1BB小鼠脾细胞,用种属特异性抗CD3E抗体进行流式细胞术分析。小鼠CD3E在野生型小鼠中检测到。人CD3E仅在纯合B-hCD3E/h4-1BB小鼠中检测到,而在野生型小鼠中检测不到(A)。用种属特异性抗4-1BB抗体进行流式细胞术分析。小鼠4-1BB在野生型小鼠中检测到。人4-1BB仅在纯合B-hCD3E/h4-1BB小鼠中检测到,而在野生型小鼠中检测不到(B)。参考文献1. Singh A, Dees S, Grewal IS. Overcoming the challenges associated with CD3+ T-cell redirection in cancer. Br J Cancer. 2021 Mar;124(6):1037-1048. doi: 10.1038/s41416-020-01225-5. Epub 2021 Jan 19. PMID: 33469153; PMCID: PMC7960983;2. R&D Investor Event,Adapted from Garfall et al, Trispecific antibodies offer a third way forward for anticancer immunotherapy, Nature 575, 2019 ©2019, Springer Nature (under permission requested). Article screenshot from Wu et al, Trispecific antibodies enhance the therapeutic efficacy of tumor-directed T cells through T cell receptor co-stimulation, Nat Cancer 2020 ©2020, Springer Nature (under permission requested).

乙型(HBV)、丙型(HCV)肝炎病毒和非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD),是引起肝硬化(cirrhosis)和肝癌(hepatocellular carcinoma, HCC)的主要驱动因素。近些年,广泛的HBV疫苗接种和针对HBC、HCV的高效抗病毒治疗手段的开发使得乙肝和丙肝有所好转。但世界范围内,肥胖症和2型糖尿病越来越流行,使得NAFLD及其进展性疾病非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)的患病率成比例上升,并逐步取代病毒性肝炎,成为全球肝硬化和肝癌的发病率和死亡率上升的主要驱动因素。流行病学显示,NAFLD在一般人群中的患病率约为25%,全球NASH患病率则在1.5%-6.5%之间[1]。NASH好发于中年男性,特别是超重肥胖或患有2型糖尿病的个体。同时NASH患者常常并发肥胖、糖尿病和心血管疾病等。因为这种疾病症状雷同于酒精性脂肪肝炎,但患者无酗酒史,故将其命名为非酒精性脂肪性肝炎(NASH)。从病理角度,NASH最早起源于肝细胞中增加的脂肪合成,机体摄入的葡萄糖和游离脂肪酸是脂肪合成的原料。脂肪过载的肝细胞容易出现应激反应(stress),包括内质网应激、线粒体受损、氧化应激(活性氧ROS的产生)和脂毒性等,出现肝细胞损伤和炎症反应,进一步有可能恶化成肝硬化甚至是肝癌(图1)。图1. NAFLD演变成NASH的过程以及NASH的病理特征[2]对应的,治疗NASH的方法主要是抗脂肪化(减脂减重),抗炎和抗纤维化[3]。可以联合应用作用机制不同的药物进行治疗。目前用于NASH治疗的药物主要包括[4]:❶ 法尼酯X受体(FXR)激动剂,如奥贝胆酸(Obeticholic acid , OCA)(Intercept公司), Tropifexor和 Cilofexor;❷ 成纤维细胞生长因子(FGF)变体:Efruxifermin, Aalafermin;❸过氧化物酶体增殖物激活受体(PPAR)激动剂:Elafibranor, Lanifibranor;成纤维细胞生长因子(FGF)变体:Efruxifermin, Aalafermin;❹ 胰高血糖素样肽-1(GLP-1)激动剂:Semaglutide;❺ C-C基序趋化因子受体(CCR2/5)抑制剂:Cenicriviroc(CVC)等。尽管关于NASH发病机制的研究已取得了大量进展,但在关键3期临床研究中,奥贝胆酸是唯一一种具有显著疗效的药物。至今仍没有欧美药监局获批的NASH治疗药物。通过改变饮食、增强锻炼甚至是手术来减肥仍然是改善NASH的主要方式。未来十年,NAFLD治疗领域仍需深耕。对疾病机制的深入研究、评估新药药效等都离不开疾病动物模型。目前NASH疾病动物模型主要可以分为3类:饮食诱导、化学诱导和基因编辑动物模型。在这三种方法的基础上,也可以进行组合应用。今天,我们就来着重介绍百奥动物已经建立的3种NASH疾病模型。NASH小鼠模型西方饮食(western diet, WD)诱导的NASH小鼠模型用西方饮食饲料,也就是高糖、高脂,高胆固醇配方的饲料诱导小鼠造模,可以看到明显的体重增加,血糖的升高,糖耐受能力的受损,以及肝脏转氨酶的升高,和血脂的升高。图2. 西方饮食诱导的NASH小鼠模型。(A) NASH模型建立:喂养标准饮食(standard diet, STD)或WD(含有21%的脂肪,50%的碳水化合物和1.5%的胆固醇)给8周龄C57BL/6雄性小鼠共22周;与STD相比,WD组小鼠(B)体重升高;(C)饥饿血糖升高;(D, E)葡萄糖耐受受损;(F)肝重上升;(G)肝重体重比;(H)血清谷丙转氨酶(ALT)水平升高;(I)血胆固醇升高;(J)肝脂肪变H&E染色示例;(K)NAS(NAFLD acticity score)评分升高。Data are means ±SEM; n=8-9 mice/group. *P <0.05, **P <0.01, ***P <0.001.高脂肪蛋氨酸胆碱缺乏饮食(high fat methionine-choline deficient diet, HFMCD)诱导的NASH小鼠模型HFMCD成分中含有60 kcal%脂肪,蛋氨酸、胆碱缺乏,该饮食诱导的NASH模型显示出肝损伤、肝脂肪变性和纤维化增加,伴随NAS评分增加。图3. HFMCD诱导的NASH模型。(A) NASH模型建立:喂养标准饮食(standard diet, STD)或HFMCD给8周龄C57BL/6雄性小鼠共4-6周;与STD相比,HFMCD组小鼠(B)体重无显著差异;(C, D)肝重和肝重体重比上升;(E, F)谷丙转氨酶(ALT)和谷草转氨酶(AST)水平升高;(G)肝脂肪变和炎症H&E染色示例及(H)NAS(NAFLD acticity score)评分升高;(I)肝纤维化天狼星红染色示例及(J)统计分析。*P <0.05, ***P <0.001, ****P <0.0001.药效学研究表明,雷公藤红素(celastrol)可以减轻HFMCD引发的NASH。图4. 雷公藤红素(celastrol)可以减轻MCD引发的NASH。(A)H&E染色示例雷公藤红素处理后肝脂肪变和炎症减少;(B)ALT,AST,NAS评分在雷公藤红素治疗后均有好转。四氯化碳(CCl4)诱导的NASH小鼠模型四氯化碳(CCl4)注射诱导模型,引起明显的肝脏炎症和纤维化。图5. CCl4诱导的NASH小鼠模型。(A) NASH模型建立:8周龄的雄性C57BL/6小鼠腹腔注射CCl4,浓度分别为:0.25、0.5和0.75 mL/kg,每周2次。分别诱导4周、6周和8周后进行血生化及组织学染色分析。(B)体重;(C, D)肝重和肝重体重比。图6. 对CCl4诱导的NASH小鼠模型的肝损伤相关表型分析。图7. H&E染色示例CCl4诱导后肝炎症增加。Scale bar: 50 um.图8. 天狼星红染色及其统计分析表明CCl4诱导后肝纤维化加重。图9. 天狼星红染色及其统计分析表明奥贝胆酸(Obeticholic acid , OCA)治疗后肝纤维化减轻。综上所述,三种NASH小鼠模型的特征总结如下NASH疾病模型的检测指标百奥动物能够提供的关于NASH疾病模型的检测指标包括更多信息,请访问百奥动物官网或扫描下方二维码。参考资料:[1] 诺和诺德医学资讯:https://mp.weixin.qq.com/s/bj9u_NSQOUWNgCYEi2qTsg[2] Huby, T., Gautier, E.L. Immune cell-mediated features of non-alcoholic steatohepatitis. Nat Rev Immunol (2021). https://doi.org/10.1038/s41577-021-00639-3[3] Dufour J, Caussy C, Loomba R. Combination therapy for non-alcoholic steatohepatitis: rationale, opportunities and challenges. Gut 2020; 69:1877-1884.[4] 药明康德:首款NASH疗法再度延后,患者何时才能迎来第一缕曙光?http://www.ii77.com/yangsheng/292978.html百奥动物立足全球生物医药行业,从技术创新出发,百奥赛图建立“BioMice百奥动物”子品牌。百奥动物集创新动物模型研发制备、生产供应和实验服务为一体,拥有2500余个独特基因编辑动物/细胞系模型,覆盖肿瘤,自免,代谢等多个疾病领域,包括重度免疫缺陷B-NDG及系列小鼠、靶点人源化小鼠和全人抗体RenMice三大系列产品,结合优质的药理药效评价服务,以高标准的3大动物中心为支撑,极大的满足了全球科学研究和药物开发需求。创新的动物模型、高标准的质量管理、多元化的服务平台,助推生物医药创新产业的快速发展。

随着生活水平的提高以及医疗技术的不断发展,人类预期寿命在逐步延长,这导致全球老年人口的空前增长,与此同时,与年龄相关的疾病负担也呈指数级增长[1]。有研究指出,在健康状况没有得到改善的情况下单纯延长寿命,是没有意义的[2]。基于此,世界卫生组织在2015年提出了《老龄化与健康全球战略和行动计划》,旨在实现健康老龄化的目标[3]。为了实现这一目标,需要对生物体、器官和细胞水平的衰老及疾病过程有透彻的了解,并针对衰老相关的分子途径开发预防和治疗衰老相关疾病的策略[4]。我国65岁以上人口占总人口比重及预测[5]大多数自发肿瘤、代谢性疾病以及神经退行性疾病的发病率和流行率随年龄增长而增加,其主要原因可以归咎于老年人免疫系统失调。免疫系统可以抵御病原体和杀伤癌细胞。老年人的免疫系统老化,使得免疫反应性急剧下降并且功能失调,这一现象被称为免疫衰老。研究表明,免疫治疗干预在幼小动物身上可能是有效的,但同样的治疗方法在老年动物身上却并不一定有效。考虑到大多数的癌症患者是老年人,癌症的发病率随着老龄化而增加,因此理解免疫系统失调对于免疫治疗的影响,可以更好的干预老年人的癌症治疗进程。为了最优地激发老年人的抗肿瘤免疫反应,需要识别和了解老年人免疫系统的内在缺陷,并使用自身耐受和衰老同时存在的相关模型。[6]小鼠凭借其易于饲养和处理并且寿命较短(~2.5年)的特性,成为衰老及其相关疾病研究中有吸引力的哺乳动物模式生物。[7]百奥动物提供优质老龄鼠(目前最大可提供15月龄,即60周龄的小鼠,陆续可提供最大20-22月龄小鼠),可用于衰老及其相关疾病的研究。可提供品系如下:老龄鼠百奥动物老龄鼠优势① 不同周龄小鼠现货提供;② 高标准的饲养环境;③ 非生产退役种鼠;④ 严格的遗传稳定性监测。C57BL/6J老龄鼠C57BL/6J是使用最为广泛的近交品系之一,也是第一个完成基因组测序,特征分析最全面的小鼠品系。有研究人员对C57BL/6J的生存曲线进行分析,并提供了可比较的对应的人类年龄。衰老是个连续的动态过程,大多数研究将生命阶段简单的分为成年、中年和老年。小鼠月龄和人类年龄对照关系及特点① 小鼠的3-6月龄对应成年人(20-30岁);发育完成尚未受到衰老影响。② 小鼠的10-15月龄对应中年人(38-47岁);可以检测到部分衰老生物标志物(非全部)的衰老变化。③ 小鼠的18-24月龄对应老年人(56-69岁);可以检测到几乎全部衰老标志物的衰老变化[8]。老龄鼠常见表型及病理随着小鼠生长发育,外观会逐渐改变。一些常见的衰老表型有:眼周脱毛、嘴鼻部被理毛、背侧产生脱毛区及灰毛区等。C57BL/6J老龄鼠的部分正常衰老表型[9]同时随着年龄增长,与年龄相关的各项疾病也随之而来,产生一些和疾病相关的表型。例如:自发肿瘤、眼周病变、皮炎脱毛等。非近亲繁殖小鼠长期研究(2年或更长时间)的常见疾病[10]a、Findings from multiple studies are summarized for each line or group. and original terminology.b、4-way crossc、(Af _ C57BL/6)F1d、UM HET3 from (BALB/cByJ _ C57BL/6J)F1 _ (C3H/HeJ _ DBA/2J)F1 老龄鼠应用研究① 健康生命周期的基础生物学研究② 骨质、肌肉、身体组成相关研究③ 饮食、运动、认知与行为研究④ 心血管、内分泌、代谢等疾病研究⑤ 免疫学、肿瘤学、神经退行性疾病研究⑥ 年龄相关的视力、听力障碍研究百奥动物自主研发人源化小鼠模型、疾病模型、老龄鼠等上千种小鼠模型,欢迎来电咨询~参考文献:[1] Olshansky, S.J. From Lifespan to Healthspan. Jama 320, 1323-1324 (2018).[2] Rivera-Tavarez, C.E. Can We Increase Our Health Span? Physical medicine and rehabilitation clinics of North America 28, 681-692 (2017).[3] Beard, J.R. et al. The World report on ageing and health: a policy framework for healthy ageing. Lancet (London, England) 387, 2145-2154 (2016). [4] Barzilai, N., Cuervo, A.M. & Austad, S. Aging as a Biological Target for Prevention and Therapy. Jama 320, 1321-1322 (2018).[5]http://news.youth.cn/jsxw/202103/t20210310_12758403.htm[6] J. Lustgarten.Cancer, aging and immunotherapy: lessons learned from animal models.Cancer Immunol Immunother 58:1979–1989(2009) .[7] Mitchell, S.J., Scheibye-Knudsen, M., Longo, D.L. & de Cabo, R. Animal models of aging research: implications for human aging and age-related diseases. Annual review of animal biosciences 3, 283-303 (2015). [8] Flurkey, K., M. Currer, J. & Harrison, D.E. Chapter 20 - Mouse Models in Aging Research. In: Fox, J.G. et al. (eds). The Mouse in Biomedical Research (Second Edition). Academic Press: Burlington pp 637-672(2007).[9] https:// e. dxy. cn/ broadcast/ live/ id/ 22788/ ? source= wechat& sim= 1& sim_ token= jo3ALEk4m RZ9tfoghOHA rih1tV 6kp0IQvMAdhr7vws7ey9YqHi8uJxdmTk9vElaf[10] C. F. Brayton, P. M. Treuting, and J. M. Ward.Pathobiology of Aging Mice and GEM: Background Strains and Experimental Design.Veterinary Pathology 49(1) 85-105(2012).
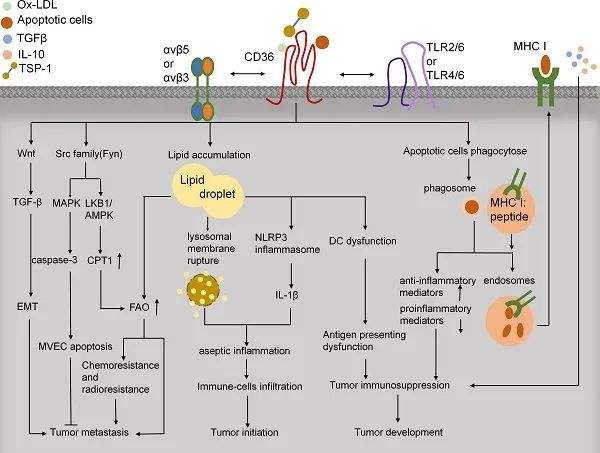
1973年,Kobylka和Carraway在乳腺上皮细胞中发现了一种在乳脂球中无法水解的膜蛋白,1978年,该分子被鉴定为血小板GPIV,一种介导血小板中血小板反应蛋白-1(TSP-1)结合的蛋白。随后,Tandon发现GPIV与白细胞分化抗原CD36具有重叠结构。随后,其他研究人员确定了CD36在血小板活化和细胞粘附中的作用。1993年,Abumrad及其同事证明了CD36的脂肪活性,之后将该蛋白在小鼠体内克隆并鉴定为人CD36的小鼠直系同源物,表明其在脂肪酸摄取中的作用。CD36现在被广泛认为是一种清道夫受体,可以吸收长链脂肪酸(LCFAs)和氧化低密度脂蛋白(ox-LDL)。CD36是一种清道夫受体,在多种细胞类型中表达。在脂质代谢中发挥重要作用,介导脂质摄取、免疫识别、炎症、分子粘附和凋亡。与血管生成、炎症反应、动脉粥样硬化性血栓性疾病以及代谢紊乱性糖尿病和肥胖症等有关。在免疫系统中,CD36介导树突状细胞抗原的获取和呈递,并支持调节性T细胞功能。研究表明靶向CD36可能是提高CD8+T细胞免疫疗法的抗肿瘤药效的有效策略,为临床治疗提供了新的思路和可能。[1]CD36与PPAR-β激活[2]CD36靶向作用破坏肿瘤内Treg细胞,并启动PD-1阻断肿瘤。具有抗CD36抗体的MOA: ①耗尽CD36+ Treg细胞。②阻断PPAR-和PPAR-依赖的代谢途径,降低线粒体活性和CD36表达水平,促进Treg细胞凋亡。③阻断TSP-1/CD36通路,促进TME血管生成。CD36调节肿瘤免疫[3]CD36在肿瘤微环境中发挥作用。CD36调节下游Src家族激酶促进抗血管生成、FAO以及化疗耐药和放疗耐药,从而导致肿瘤转移。CD36还通过EMT激活Wnt/TGF-β信号传导促进肿瘤转移。CD36摄取多种脂质,如ox-LDL、LCFAs和胆固醇。免疫细胞中的脂质沉积导致树突状细胞的无菌性炎症和抗原呈递功能障碍,从而诱导肿瘤免疫抑制。此外,CD36可以与凋亡细胞结合并激活交叉引物,这可能导致免疫抑制和肿瘤发展。BioMice百奥动物自主研发了人源化小鼠B-hCD36 mice和人源化细胞系B-hCD36 MC38助力科研。B-hCD36 miceB-hCD36小鼠血常规检测全血细胞计数(CBC)。采集雌性C57BL/6和B-hCD36小鼠(n=8,6-8周龄)的血液并进行全血细胞计数分析。B-hCD36小鼠的测量结果与C57BL/6小鼠相似,表明人源化不会改变血细胞组成和形态。数值表示为平均值±SEM。B-hCD36小鼠血生化检测B-hCD36小鼠的血生化试验。收集C57BL/6和B-hCD36小鼠(n=8,6-8周龄)的血清,并分析其指标水平。B-hCD36小鼠的测量结果与C57BL/6小鼠相似,表明人源化不会改变肝脏等相关组织的健康。数值表示为平均值±SEM。使用抗CD36抗体测试B-hCD36模型的抗体结合试验通过流式细胞术对纯合B-hCD36小鼠进行种属特异性CD36表达分析。收集野生型小鼠 (+/+)和纯合B-hCD36小鼠(H/H)的腹腔渗出巨噬细胞,并通过抗CD36抗体的流式细胞术进行分析。人CD36仅在纯合B-hCD36小鼠中可检测到,但在野生型小鼠中未检测到。CD36-1G04-hIgG1-LALA抗体在小鼠和人中交叉识别。B-hCD36 MC38蛋白表达分析通过流式细胞术对B-hCD36 MC38细胞中的CD36表达进行分析。用种属特异性抗 CD36抗体对B-hCD36 MC38培养物的单细胞混悬液进行染色。在B-hCD36 MC38细胞表面检测到人CD36,但在野生型MC38细胞表面未检测到。使用B-hCD36 MC38细胞的10-G12克隆进行体内实验。肿瘤生长曲线和体重变化B-hCD36 MC38细胞的皮下同种移植肿瘤生长。将B-hCD36 MC38细胞(5x105)和野生型MC38细胞(5x105)皮下植入B-hCD36小鼠(雌性,7周龄,n=5)。每周测量两次肿瘤体积和体重。(A)平均肿瘤体积±SEM。(B)体重(平均值±SEM)。体积以mm3表示,使用公式:V=0.5X长径X短径2。如图A所示,B-hCD36 MC38细胞能够在体内建立肿瘤,可用于有效性研究。肿瘤细胞蛋白表达分析将B-hCD36 MC38细胞皮下移植到B-hCD36小鼠(n=5)中,接种后35天,收获肿瘤细胞并通过流式细胞术评估人CD36表达。如图所示,人CD36在肿瘤细胞表面高度表达。因此,B-hCD36 MC38细胞可用于新型CD36疗法的体内药效研究。更多验证数据信息,正在研究进行中,敬请关注。想要获取更多百奥动物自主研发的人源化小鼠信息,请访问百奥动物官网或扫描下方二维码。参考文献1.CD36-mediated ferroptosis dampens intratumoral CD8+T cell effector function and impairs their antitumor ability2.Wang, H., Franco, F., Tsui, Y. et al. CD36-mediated metabolic adaptation supports regulatory T cell survival and function in tumors. Nat Immunol 21, 298–308 (2020). doi:10.1038/s41590-019-0589-53.Wang, Jingchun; Li, Yongsheng (2019). CD36 tango in cancer: signaling pathways and functions. Theranostics, 9(17), 4893–4908. doi:10.7150/thno.36037

自然杀伤(NK)细胞源于骨髓造血干细胞,主要分布于骨髓、外周血、肝、脾、肺和淋巴结。属于先天免疫系统的核心细胞,它们在免疫监视中扮演着非常重要的角色,随着对NK细胞的分子特征和功能的进一步探索,开发以NK细胞为基础的靶向免疫治疗可能引发肿瘤免疫治疗的新突破。图1. NK细胞在癌症中的作用机制[1]虽然近年来基于T细胞免疫检查点,如PD-1/PD-L1和CTLA-4在临床抗肿瘤取得了较大的进展,但免疫治疗并不能对所有患者起到良好效果,目前的很多研究也表明T细胞免疫疗法具有一定的局限性。NK细胞作为重要的天然免疫细胞之一,表达多种激活受体,包括CD16、NKG2D、SLAM家族成员和自然细胞毒性受体NKp30、NKp44和NKp46。NK细胞不需预先致敏就可以杀伤靶细胞,在抗肿瘤、抗病毒感染和免疫调节等方面具有重要作用,是抗癌效果良好的一种免疫细胞。因此目前基于NK细胞的肿瘤免疫疗法逐渐受到关注,如通过单克隆抗体靶向NK细胞免疫检查点治疗。针对NK细胞免疫检查点机制研究和新药开发的需求,BioMice 百奥动物自主研发了相关的实验动物模型。NK细胞免疫检查点01、NKp46NKp46自然细胞毒性激动型受体(NCR)家族中的一员,NCR受体家族的另外两个成员是NKp30和NKp44,与其他两个成员只表达在人NK细胞上不同,NKp46同时表达在人和小鼠的NK细胞上。NKp46主要表达在NK细胞上,也表达在一些亚型T细胞和ILCs上。NKp46配体和信号机制目前还不清楚,目前在研疗法有10项,有抗体药物和细胞疗法,抗体药物有单抗,双抗及多抗,开发机构有大学和Innate Pharma等企业。据文献报道,NK细胞衔接器可同时靶向肿瘤抗原,NKp46和CD16的多功能抗体。目前的药物都处于早期生物测试研发阶段和临床前阶段。图2. 多功能NK细胞衔接器[2]B-hNKP46 mice基本信息:蛋白表达分析:图3. 流式细胞术分析 B-hNKp46纯合小鼠NKp46的表达通过流式细胞术分析野生型C57BL/6和B-hNKp46纯合小鼠中NKP46的特异性表达。收集野生型C57BL/6和纯合B-hNKP46小鼠的脾细胞,结果显示:用属种特异性NKP46抗体进行流式细胞术分析。在野生型C57BL/6小鼠细胞表面检测到mNKP46,在B-hNKP46纯合小鼠的NK细胞表面检测到hNKP46。02、NKG2ANKG2家族是NK细胞上的一类重要受体,包括NKG2A,NKG2B,NKG2C,NKG2D,NKG2E,NKG2F,NKG2H等成员。NKG2A是NKG2家族中的抑制性成员,NKG2A主要表达在NK细胞表面和部分T细胞(CD8+T细胞、Th2细胞以及NKT细胞)。NKG2A可与CD94形成异源二聚体,与其配体结合后,激活细胞内的抑制性信号通路,抑制NK细胞活性,从而使肿瘤避免被NK细胞杀伤。因此NKG2A抗体可以阻断这一抑制信号,释放NK细胞,起到抗肿瘤的作用。HLA-E是NKG2A的天然配体。HLA-E广泛在所有组织细胞中表达,但表达水平较低,而其在癌细胞中被上调。研究发现, 多种肿瘤细胞高表达HLA-E, 且肿瘤浸润处的NK和CD8+T细胞高表达NKG2A[3], 使肿瘤细胞逃避NK和CD8+T细胞的免疫识别。图4. 肿瘤细胞表面高表达HLA-E进行免疫逃逸[4]B-hNKG2A mice基本信息:NK细胞蛋白表达分析:图5. 流式细胞术分析B-hNKG2A杂合小鼠NKG2A的表达通过流式细胞术分析野生型C57BL/6和B-hNKG2A杂合小鼠中NKG2A蛋白的表达。收集野生型C57BL/6和B-hNKG2A杂合小鼠的脾细胞,用种属特异性抗NKG2A抗体进行流式细胞术分析。结果显示:在C57BL/6小鼠和B-hNKG2A杂合鼠的NK细胞表面检测到mNKG2A,在B-hNKG2A杂合鼠的NK细胞表面检测到hNKG2A。(其中,用来检测human NKG2A的抗体是内部制备的monalizumab)除了NKG2A单人源化小鼠,我们还开发了CD94/NKG2A双人源化小鼠,成为验证CD94/NKG2A靶点药物的有力工具。B-hCD94/hNKG2A mice基本信息:体内药效: 图6.B-hCD94/hNKG2A小鼠药效验证抗人NKG2A抗体Monalizumab(来源合作方)联合PD-L1抗体Tecentriq(来源合作方)在B-hCD94/hNKG2A小鼠中的抗肿瘤药效。(A)纯合B-hCD94/hNKG2A小鼠 (雌性,6-7周龄,n=6) 皮下接种小鼠结肠癌MC38细胞系。当肿瘤体积达到约100 mm3时,将小鼠分组,分组后给与抗人NKG2A和PD-L1抗体进行治疗,结果显示抗人NKG2A和PD-L1抗体能够显著抑制MC38肿瘤细胞的生长。(B) 治疗期间体重变化。如A图所示,抗人NKG2A抗体和PD-L1抗体在B-hCD94/hNKG2A小鼠体内能够有效控制肿瘤生长,表明B-hCD94/hNKG2A小鼠为PD-L1和NKG2A抗体联合治疗的体内评价提供了一个强大的临床前模型。03NKG2DNKG2D为活化性受体,在NK细胞活化过程中起着非常重要的作用。人NKG2D主要表达于NK细胞、CD8+T细胞、γδT细胞以及一些自体反应的CD4+T细胞,发挥着清除损伤、病原体感染等细胞的生理功能,在抗肿瘤免疫应答过程中也发挥着重要作用。NKG2D不与CD94结合,其配体在人类是MICA、MICB和ULBP1,鼠中为Rae-1、H60和MULT1。正常情况下,这些配体表达在细胞表面,与NKG2D结合后可促进其下游的激活通路。这些配体在正常细胞中受到严格调节,而在肿瘤细胞等受损细胞上高表达,与NKG2D结合后直接活化或作为共刺激分子激活效应细胞,发挥免疫监视作用。图7. NKG2D受体及其配体[5]B-hNKG2D mice基本信息:NK细胞蛋白表达分析:图8. 流式细胞术分析B-hNKG2D纯合小鼠NKG2D的表达通过流式细胞术分析野生型C57BL/6和B-hNKG2D纯合小鼠中NKG2D蛋白的表达。收集野生型C57BL/6和纯合B-hNKG2D小鼠的脾细胞,用种属特异性抗NKG2D抗体进行流式细胞术分析。结果显示,在C57BL/6小鼠NK细胞表面检测到mNKG2D。在B-hNKG2D纯合小鼠的NK细胞表面检测到hNKG2D。04、CD16ACD16A主要表达在NK细胞、巨噬细胞和单核细胞表面,胞内有两条免疫受体酪氨酸激活基序(ITAM),和抗原抗体复合物结合后,激活下游信号,从而促进抗体介导的细胞毒性(ADCC)。NK细胞不需要特异性的抗原刺激就可以发挥ADCC作用。在没有共刺激信号的情况下,未致敏的人NK细胞只能通过CD16A触发细胞毒活性[6]。CD16A的在研药物主要是针对肿瘤抗原的抗体药物,通过Fc改造提高对CD16A的亲和力或针对CD16A的双特异性抗体。B-hCD16A mice基本信息:NK细胞蛋白表达分析:图9. 流式细胞术分析B-hCD16A纯合小鼠CD16A的表达用流式细胞术分析野生型C57BL/6小鼠和纯合B-hCD16A小鼠中CD16A的表达。收集野生型C57BL/6小鼠和纯合B-hCD16A小鼠的脾细胞。结果显示,人的CD16A只能在纯合B-hCD16A小鼠的NK细胞中只能检测到,野生型C57BL/6小鼠中未检测到。图10. 流式细胞术分析B-hCD16A纯合小鼠PBMC水平用流式细胞术分析结果显示,人源化小鼠NK细胞hCD16A表达水平与人PBMC相似。以及我们还开发了CB-17 SCID背景的人源化小鼠。B-hCD16A(CB-17SCID) mice基本信息:NK细胞蛋白表达分析:图11. 流式细胞术分析B-hFCGR3A(CB-17 SCID)纯合小鼠FCGR3A的表达用流式细胞术分析野生型CB-17 SCID小鼠和纯合B-hFCGR3A(CB-17 SCID)小鼠中FCGR3A的表达。收集野生型CB-17 SCID小鼠和纯合B-hFCGR3A(CB-17 SCID)小鼠的脾细胞。结果显示,人的FCGR3A只能在纯合B-hFCGR3A小鼠的NK细胞中只能检测到,野生型CB-17 SCID小鼠中未检测到。展望NK细胞因为有着不受MHC限制的细胞毒性、可以产生细胞因子和免疫记忆等功能,从而具有独特的抗肿瘤效应,使其成为先天性和适应性免疫反应系统中的关键角色。T细胞免疫检查点疗法已经在临床肿瘤治疗上,显示出巨大临床转化潜力,相信随着NK细胞免疫检查点这支“潜力股”疗法的加入,未来肿瘤免疫疗法的适用范围可以得到更好的拓展。参考文献[1]Feixue Wang, Jennie Ka Ching Lau & Jun Yu. The role of natural killer cell in gastrointestinal cancer: killer or helper.Cell. 2021;40:717–730.[2]Laurent Gauthier, Ariane Morel, Nadia Anceriz. Multifunctional Natural Killer Cell Engagers Targeting NKp46 Trigger Protective Tumor Immunity. Cell. 2019;177(7):1701-1713.[3] Algarra I , A García-Lora, Cabrera T , et al. The selection of tumor variants with altered expression of classical and nonclassical MHC class I molecules: implications for tumor immune escape.[J]. Cancer Immunology Immunotherapy, 2004, 53(10):904-910.[4]Montfoort N V , Borst L , Korrer M J , et al. NKG2A Blockade Potentiates CD8T Cell Immunity Induced by Cancer Vaccines - ScienceDirect[J]. Cell, 2018.[5]Mercedes, B . F., Carolina, I . D., Norberto, W . Z. Leveraging NKG2D Ligands in Immuno-Oncology.Immunol., 29 July 2021[6] Bryceson, Y . T.,March, M . E.,Ljunggren, H . G. & Long, E. O. Synergy among receptors on resting NK cells for the activation of natural cytotoxicity and cytokine secretion. Blood 107, 159-166, doi:10.1182/blood-2005-0401351(2006).
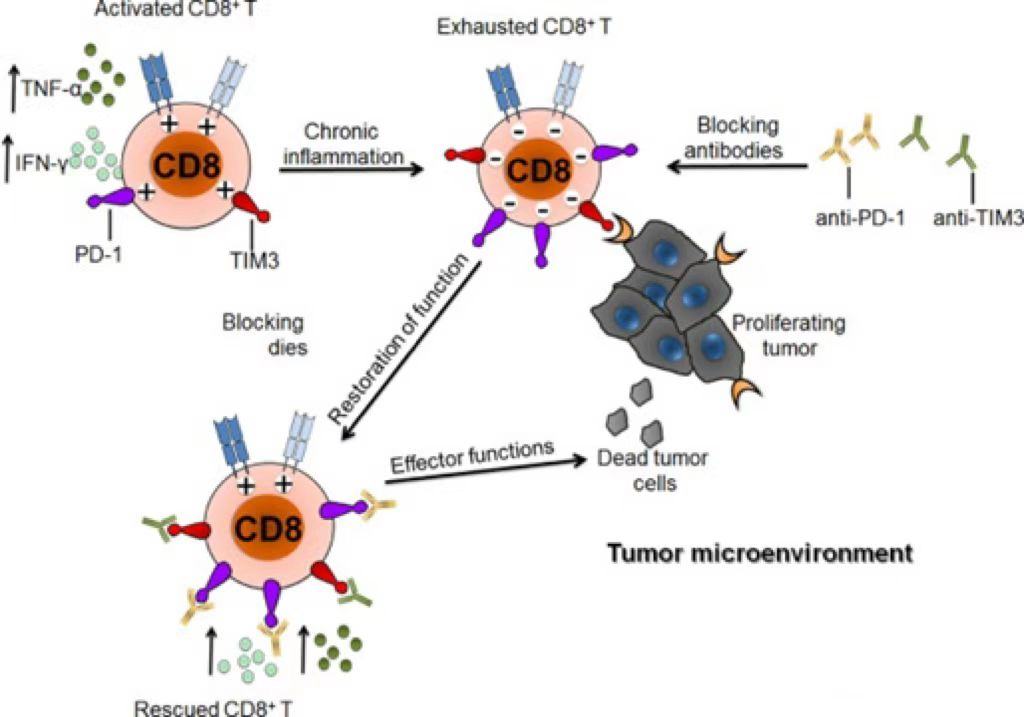
TIM3(T细胞免疫球蛋白及粘蛋白结构域分子3)又称HAVCR2,属于免疫调节蛋白TIM家族的一员,在人类,TIM家族包括TIM1、TIM3和TIM4,位于染色体5q33.2上。在小鼠中,TIM家族包括TIM1到TIM8,位于染色体11B1.1上。大量证据表明,TIM家族在自身免疫性疾病、感染性疾病、肿瘤免疫监视和免疫逃逸等免疫反应的调节中发挥着不同的作用。TIM3是一类T细胞表面抑制性分子,能够引起癌症与慢性病毒感染过程中T细胞的耗竭。与CTLA4,PD1类似,它也是目前研究最多的免疫治疗的靶点之一。TIM3作为一种负调控的免疫检查点,于2002年首次被发现,由281个氨基酸组成,并且由一个胞外区、一个单跨膜结构域和一个C-末端细胞质尾部组成。TIM3选择性地表达在分泌IFN-γ的辅助性T细胞(Th1和Th17) 、调节性T细胞(Treg) 、树突状细胞(DCs) 、单核细胞、肥大细胞、NK细胞、肿瘤浸润淋巴细胞(TILs) 上,在肿瘤细胞上亦有表达,如黑色素瘤、胃癌、B细胞淋巴瘤。TIM3作为重要的免疫检查点的机制主要在于TIM3标志着肿瘤浸润CD8+ PD1+ T细胞功能最失调的亚群。同时阻断TIM3和PD1通路的抗体对抑制肿瘤生长、改善肿瘤抗原特异性CD8+T细胞的响应具有协同作用。[1]。 图1:TIM3可以诱导T细胞耗竭[1]TIM3有多种不同的配体,包括半乳糖凝集素9(Galectin 9)、磷脂酰丝氨酸(PtdSer)、癌胚抗原相关细胞粘附分子1(CEACAM1)以及HMGB1,它们分别与TIM3胞外区IgV结构域的不同位点结合。当TIM3未与其配体结合时,它被招募到T细胞激活的免疫突触中,与 HLA-B相关转录产物3(BAT3)相互作用,并通过酪氨酸激酶LCK募集维持T细胞活化。可溶性凝集素半乳糖凝集素9(Galectin 9)和粘附分子癌生物抗原相关细胞粘附分子1(CEACAM1),通过酪氨酸激酶ITK触发Tyr256和Tyr263的磷酸化。磷酸化后,BAT3从TIM3中释放出来,从而使TIM3发挥其抑制功能。BAT3敲除的T细胞其共抑制受体的表达升高,并且在自身免疫的背景下表现出降低的致病性,说明BAT3通过负反馈来调节T细胞的功能。FYN与BAT3结合TIM3的同一区域。多数促进抗肿瘤免疫的TIM3靶向抗体干扰CEACAM1或PtdSer与TIM3的结合,从而维持TIM3-BAT3的相互作用[2]。 图2:TIM3的作用机制[2]TIM3靶点药物研发进展 随着技术进步和研究创新,TIM3是目前研究最多的免疫治疗的靶点之一,靶向TIM3的治疗正处于临床试验/研发阶段,国内外尚无已上市药物,但很多制药企业都有布局,临床III期两个(诺华、GSK各有一个)、临床II期5个(罗氏、百济神州、阿斯利康等)、临床I期8个(礼来、恒瑞等),主要适应症急性髓系白血病(AML)和骨髓增生异常综合症(MDS)、非小细胞肺癌等实体瘤;全球研发TIM3/PD1双特异性抗体的公司不多,研究进入临床试验的只有阿斯利康、罗氏和礼来,其余皆处于临床前。 表1. 部分在研药物临床进展数据来源于科睿唯安针对TIM3靶点机制研究和新药开发的需求,BioMice百奥动物自主研发了B-hTIM3 mice,同时也扩繁了B-hPD-1/hTIM3 mice,B-hPD-L1/hTIM3 mice,B-hCTLA4/hTIM3 mice双人源化小鼠及B-hPD-1/hPD-L1/hTIM3 mice等三人源化小鼠,相关模型列表见文末,助力靶向TIM3药物开发,为临床前药效评估提供了优质模型。B-hTIM3 mice基本信息蛋白表达分析通过流式细胞术对纯合B-hTIM3 小鼠进行种属特异性B-hTIM3 小鼠表达分析。收集野生型C57BL/6和纯合 B-hTIM3 小鼠的腹腔冲洗液细胞,结果显示:小鼠 TIM3 仅在野生型小鼠的非 T 和非 B 细胞中检测到,人 TIM3 仅在纯合 B-hTIM3 小鼠的非 T 和非 B 细胞可检测到。通过流式细胞术对纯合B-hTIM3 小鼠进行种属特异性 TIM3 表达分析。收集野生型C57BL/6和纯合 B-hTIM3 小鼠的脾细胞,结果显示:小鼠 TIM3 仅在野生型小鼠中检测到。人 TIM3 仅在纯合 B-hTIM3 小鼠中检测到。药效验证抗人 TIM3 抗体在B-hTIM3 小鼠中的抗肿瘤活性。(A)抗人 TIM3 抗体可抑制B-hTIM3 小鼠中的MC38肿瘤生长。将小鼠结肠癌MC38细胞皮下植入纯合B-hTIM3 小鼠(雄性,7周龄,n=5)。当肿瘤体积达到约100 mm3时,将小鼠分组,此时用抗人 TIM3 抗体处理。(B)给药期间体重变化。如图A所示,抗人 TIM3 抗体可有效抑制B-hTIM3 小鼠的肿瘤生长,表明B-hTIM3 小鼠为抗人 TIM3 抗体的体内评价提供了有力的临床前模型。数值表示为平均值±SEM。抗人 TIM3 抗体在B-hTIM3 小鼠中的抗肿瘤活性。(A)抗人 TIM3 抗体可抑制B-hTIM3 小鼠中的MC38肿瘤生长。将小鼠结肠癌MC38细胞皮下植入纯合B-hTIM3 小鼠(雌性,4周龄,n=5)。当肿瘤体积达到约100 mm3时,将小鼠分组,此时用抗人 TIM3 抗体处理。(B)给药期间体重变化。如图A所示,抗人 TIM3 抗体可有效抑制B-hTIM3 小鼠的肿瘤生长,表明B-hTIM3 小鼠为抗人 TIM3 抗体的体内评价提供了有力的临床前模型。B-hCTLA-4/hTIM3 mice蛋白表达分析通过流式细胞术对纯合B-hCTLA4/hTIM3 小鼠进行种属特异性 TIM3 表达分析。收集野生型C57BL/6和纯合 B-hCTLA4/hTIM3(H/H) 小鼠的脾细胞,结果显示:小鼠 TIM3 在野生型小鼠中可检测到。人 TIM3 仅在纯合 B-hCTLA4/hTIM3 小鼠中可检测到,但在 WT 小鼠中未检测到。通过流式细胞术对纯合B-hCTLA4/hTIM3 小鼠进行种属特异性CTLA4 表达分析。收集野生型C57BL/6和纯合 B-hCTLA4/hTIM3(H/H) 小鼠的脾细胞,结果显示:小鼠 CTLA4 在野生型小鼠中可检测到。人CTLA4仅在纯合 B-hCTLA4/hTIM3 小鼠中可检测到,但在 WT 小鼠中未检测到。B-hPD-1/hTIM3 mice药效验证抗人TIM3抗体联合抗人PD-1抗体在B-hPD-1/hTIM3 小鼠中的抗肿瘤药效。(A)抗人TIM3 抗体联合抗人PD-1抗体抑制B-hPD-1/hTIM3 小鼠MC38肿瘤生长。小鼠结肠癌MC38细胞(5×105)皮下植入纯合B-hPD-1/hTIM3小鼠中(雌性,6-8周龄,n=6)。当肿瘤体积达到大约150±50 mm3时,小鼠被分组,然后用抗人 TIM3 抗体联合抗人PD -1抗体Keytruda给药。(B)治疗期间体重变化。如图A所示,抗人TIM3抗体与抗人PD-1抗体联合使用比单独使用组对肿瘤生长具有更强的抑制作用,说明B-hPD-1/hTIM3小鼠为评价人TIM3抗体与人PD-1抗体联合治疗的体内评估提供了一个强有力的临床前模型。B-hPD-1/hPD-L1/hTIM3 mice药效验证抗人PD-L1抗体(内部合成)联合抗人TIM3抗体在B-hPD-1/hPD-L1/hTIM3 小鼠中的抗肿瘤药效。(A) 纯合B-hPD-1/hPD-L1/hTIM3 小鼠(雌性,7-8周龄,n=6)皮下接种小鼠结肠癌MC38细胞。当肿瘤体积达到约100 mm3时对小鼠进行分组,分组后给抗人PD-L1抗体和抗人 TIM3 抗体进行治疗,剂量和时间表如图 A 所示。(B) 给药期间的体重变化。如图 A 所示,抗人 PD-L1 抗体和抗人 TIM3 抗体联合给药组的抑制作用强于单药组,抗人 PD-L1 抗体联合抗人 TIM3 抗体可抑制 B-hPD-1/hPD-L1/hTIM3 小鼠中的肿瘤细胞生长。结果证明 B-hPD-1/hPD-L1/hTIM3 小鼠可为体内评价抗人PD-L1 和抗人TIM3抗体药效提供有力的临床前研究模型。抗人PD-1抗体(内部合成)联合抗人TIM3抗体在B-hPD-1/hPD-L1/hTIM3 小鼠中的抗肿瘤药效。(A) 纯合B-hPD-1/hPD-L1/hTIM3 小鼠(雌性,7-8周龄,n=6)皮下接种小鼠结肠癌MC38细胞。当肿瘤体积达到约100 mm3时对小鼠进行分组,分组后给抗人PD-1抗体和抗人 TIM3 抗体进行治疗,剂量和时间表如图 A 所示。(B) 给药期间的体重变化。如图 A 所示,抗人 PD-1 抗体和抗人 TIM3 抗体联合给药组的抑制作用强于单药组,抗人 PD-1 抗体联合抗人 TIM3 抗体可抑制 B-hPD-1/hPD-L1/hTIM3 小鼠中的肿瘤细胞生长。结果证明 B-hPD-1/hPD-L1/hTIM3 小鼠可为体内评价抗人PD-1 和抗人TIM3抗体药效提供有力的临床前研究模型。参考资料[1] Solinas, C., et al., Significance of TIM3 expression in cancer: From biology to the clinic. Semin Oncol, 2019. 46(4-5): p. 372-379.[2] Wolf, Y., A.C. Anderson, and V.K. Kuchroo, TIM3 comes of age as an inhibitory receptor. Nat Rev Immunol, 2020. 20(3): p. 173-185.TIM3靶点相关模型列表

骨质疏松症被定义为一种全身性骨骼疾病,其特征是骨量低,骨组织微结构恶化,从而导致骨脆性增加,易发生骨折[1]。骨质疏松症的基本发病机制是骨形成和骨吸收的失调。据统计,目前全世界大约2亿人患骨质疏松症,跃居各种常见病的第7位。据悉,2015~2019年全球骨质疏松症药物市场相对稳定,伴有小幅增长,2019年全球销售额为97.09亿美元。从TOP20的产品看,以RANKL抑制剂、甲状旁腺激素类似物、双膦酸盐类药物、钙剂与维生素D、选择性雌激素受体调节剂这五大类药物为主[2]。骨质疏松症新药研究进展进军骨质疏松症市场的两个新秀为地舒单抗和罗莫单抗,其中地舒单抗是首个且唯一获批的靶向RANKL单克隆抗体,通过阻断RANK和RANKL的结合来抑制破骨细胞的活性,在抑制成熟破骨细胞功能的同时,还可以抑制破骨前体细胞成熟,减少骨质吸收、促进骨重建,从而延迟和减少骨相关事件发生。值得一提的是,地舒单抗虽然获批较晚,但却是目前骨质疏松症药物市场的佼佼者。而罗莫单抗是一种人源化单克隆抗体(IgG2),可以抑制骨硬化蛋白(SOST)的活性,在加速骨形成的同时减少骨吸收,增加骨密度。除此之外,骨质疏松症治疗新靶点也在不断被挖掘,目前全球还有多款在研治疗骨质疏松症的药物,部分在研新药详情见下表:百奥动物骨质疏松症模型卵巢切除(OVX)小鼠是一种公认的人类绝经后骨质疏松症(PMOP)的体内模型。采用骨矿物质密度(BMD)测量、Micro-CT分析和组织形态学分析对卵巢切除小鼠进行评价[3,4]。百奥动物建立了稳定的卵巢切除术诱导的C57BL/6小鼠骨质疏松症模型,可用于骨质疏松症的临床前研究和药理药效学评价。骨质疏松症模型构建及验证骨质疏松症小鼠模型的构建卵巢切除诱导小鼠体重增加,子宫重量减轻卵巢切除诱导小鼠骨质流失(Micro-CT)C57BL/6小鼠在第0天切除卵巢。手术后6周,取出骨头(C)和子宫(B)进行检测。每周记录体重(A),实验终点记录子宫重量 (B)。实验结果表明,卵巢切除术导致小鼠体重增加,子宫重量减轻且骨质流失。数值以平均值±标准误表示。卵巢切除诱导骨质疏松症的病理分析卵巢切除6周后进行病理分析。实验结果表明,接受卵巢切除手术的小鼠骨小梁面积减少。数值以平均值±标准误表示。骨质疏松症模型可提供的检测项目骨质疏松症靶点人源化小鼠模型百奥动物针对骨质疏松症相关靶点开发了系列人源化小鼠模型,助力相关药物研发进程。参考资料:[1]. Eastell R, O‘Neill TW , Hofbauer LC et al. Postmenopausal osteoporosis. Nat Rev Dis Primers. 2016, 2:16069.[2]. https://mp.weixin.qq.com/s/E7M_lJc4gjaY3cHjoMG7xA[3]. Wang HC, Zhou KF, Xiao FZ et al. Identification of circRNA-associated ceRNA network in BMSCs of OVX models for postmenopausal osteoporosis. Sci Rep. 2020, 10(1):10896.[4]. Chen K, Qiu PC, Yuan Y et al. Pseurotin A Inhibits Osteoclastogenesis and Prevents Ovariectomized-Induced Bone Loss by Suppressing Reactive Oxygen Species. Theranostics. 2019, 9(6):1634-1650.