
随着人口老龄化的加深,中枢神经系统退行性疾病已变成现代社会严重的医学问题。目前,大量研究表明多种中枢神经系统(CNS)疾病,例如帕金森病、阿尔兹海默症、脑肿瘤和多发性硬化等疾病的发生、发展与治疗,都与血脑屏障(blood brain barrier, BBB)关系密切。 如今,虽然抗体类药物凭借其靶向的高度特异性已经在多种疾病的治疗中获得成功,但在CNS相关疾病的治疗中却遇到了瓶颈,实现跨血脑屏障进行药物递送成为一重大挑战。如何在维持血脑屏障结构功能完整性的前提下提高药物递送效率,改善相关疾病的治疗,是今后研究CNS相关疾病的重要方向。血脑屏障的结构与功能1913年,Goldman 直接将染料注射进了动物的蛛网膜下腔,得到了脑组织着色,其他部分不着色的结果,此结果在1900年 Lewandowsky 正式提出了血脑屏障这一概念的基础上进一步证实了其存在。血脑屏障(BBB)是一种大脑血管、细胞以及其它组成大脑组织之间的保护性屏障,主要由周细胞、脑毛细管内皮细胞、基膜、星形胶质细胞足突和脑血管内皮细胞间的紧密连接组成,能为大脑提供一种防御机制来抵御血液中的外来病原体和毒素等(图1)。BBB通过严格控制特定营养物质,以及限制有害异生物质分子的通过,来维持CNS 稳态;但另一方面在开发CNS生物药时,由于BBB的存在,导致生物药在大脑中的含量仅相当于血浆的 0.01-0.1%,为实现跨血脑屏障进行药物递送带来了巨大的难度。图1. 血脑屏障示意图[1]脑部药物递送手段--受体介导的胞吞作用(RMT)大脑中生物药物递送技术包括侵入式和非侵入式技术,利用非侵入式技术跨BBB主要是利用内源性胞吞的过程,例如吸附介导的胞吞作用, 载体介导的胞吞作用(CMT)和受体介导的胞吞作用(RMT)(图2)。在这些过程中,RMT 已成为BBB递送研究最广泛的过程。图2. 穿越BBB的生物转运机制[1]为了通过RMT过程达到最优的治疗药物递送效率,靶受体蛋白应在脑血管的内皮细胞中高表达,同时在外周血管中最低限度表达。遵循这一思路,过去几十年大多数研究都集中于已知在血脑屏障细胞上高表达的靶点,例如转铁蛋白受体(TFR),胰岛素受体(IGF1R),CD98重链(CD98HC)等,针对这些靶点正在进行的药物临床试验(图3)将表明基于RMT的技术是否可安全有效地将治疗相关药物剂量递送至CNS,同时将外周和/或脱靶毒性作用降至最低。 图3. 部分基于RMT进行的临床研究[1]转铁蛋白受体(TFR1)转铁蛋白(TF)结合铁是通过与其受体,即 Transferrin Receptor 1(TFR1)相互作用而实现的。TF 与 Fe3+相互作用形成全铁 -TF,并与 TFR1 受体结合,在细胞内吞作用下进入核内体。在偏酸性核内体的环境中,Fe3+ 与Tf分离,同时STEAP3将 Fe3+ 还原为 Fe2+ ,并被二价金属离子转运蛋白1(DMT1)转运到细胞质中,然后释放了Fe3+ 的TF与TFR1组成 TF/TFR1 复合物,通过胞吐作用回游到细胞表面。在细胞表面,转铁蛋白(TF)与受体TFR1分离,成为脱铁 -TF,然后再与Fe3+重新结合参与铁循环。整个过程完成后TF和TFR1被循环利用,进入细胞摄取铁的下一个周期中。图4. 转铁蛋白循环机制[2]转铁蛋白受体(TFR1)是用于基于RMT的大脑递送方法中研究最广泛的靶蛋白,TFR1在血脑屏障上高表达,识别携带铁的转铁蛋白将其转运到细胞内,从而介导铁的脑内转运。多项研究证明能够使用转铁蛋白或者 TFR1为靶点来转运药物到脑内,并在动物模型中得到验证。针对TFR1靶点机制研究和新药开发的需求,BioMice 百奥动物自主研发的 B-hTFR1 mice 是评估蛋白治疗药物对CNS的有效递送的优质临床前实验动物模型。B-hTFR1 mice 验证数据红细胞蛋白表达分析流式细胞术分析纯合B-hTFR1小鼠中TFR1表达采集野生型小鼠和纯合 B-hTFR1小鼠的骨髓,采用种特异性抗TFR1抗体进行流式分析。小鼠TFR1在野生型小鼠中检测到。人TFR1仅在纯合B-hTFR1小鼠中检测到,而在野生型小鼠中检测不到。TFR1抗体的体内PK评价抗人TFR1双特异性抗体(BsAbs)的体内药代动力学(PK)评价如图所示,抗人TFR1 BsAbs在剂量后表现出更高的血清清除率和增强的脑暴露。研究结果证实,B-hTFR1小鼠的大脑能够摄取静脉注射的抗人TFR1 BsAbs。平均值±SEM。 溶质载体转运蛋白 -CD98 重链(CD98HC)溶质载体转运蛋白:CD98HC在小鼠大脑毛细血管和微血管中高度富集,并且位于脑内皮细胞的管腔和离腔表面。最近使用能够识别CD98HC和 β‑分泌酶 1(BACE1)的双特异性抗体进行的一项研究表明,将这些抗体静脉注射到小鼠体内可实现药物的大脑递送,并伴随着Aβ产生显着减少。CD98HC/BACE1双特异性抗体在大脑递送中的效率比TfR/BACE1双特异性抗体高 80‑90%,表明靶向CD98HC可能更有效[3]。针对CD98HC靶点,BioMice 百奥动物自主研发的B-hCD98HC mice助力CNS相关疾病的临床前药物评价。B-hCD98HC mice 验证数据蛋白表达分析流式细胞术分析 B-hCD98HC 纯合小鼠 CD98 的表达取野生型小鼠和纯合 B-hCD98HC小鼠脾细胞,用种特异性抗CD98抗体进行流式细胞术分析。野生型小鼠中检测到小鼠CD98。人CD98在 B-hCD98HC纯合小鼠中检测到,而在野生型小鼠中未检出。胰岛素样生长因子 1 受体(IGF1R)胰岛素样生长因子 1 受体(IGF1R)在大脑和脑血管中表达。因此,不干扰IGF1结合的抗体与IGF1R的结合可能是在BBB中提供生物治疗剂的一种有前景的策略。在最近的一项研究中,产生了针对IGF1R且远离IGF1结合位点的结构域的新型骆驼单域抗体(VhHs),体外模型中显示与非靶向VhH相比,大鼠的脑和脑脊液暴露量更高。BioMice 百奥动物针对IGF1R靶点机制研究自主研发的B-hIGF1R mice,是评估蛋白治疗药物对CNS的有效递送的优质临床前实验动物模型。除以上部分受体介导的胞吞作用外,越来越多的技术已经开始被用于探索增强生物类药物递送到脑部,如外泌体技术,基于腺相关病毒(AAV)的基因递送技术等。随着研究的深入,打破血脑屏障,攻克脑部药物递送的难题指日可待!参考资料:[1]Terstappen, G.C., Meyer, A.H., Bell, R.D. et al. Strategies for delivering therapeutics across the blood–brain barrier. Nat Rev Drug Discov 20, 362–383 (2021). https://doi.org/10.1038/s41573-021-00139-y[2] Li H , Sun H , Qian Z . The role of the transferrin-transferrin-receptor system in drug delivery and targeting.[J]. Trends in Pharmacological ences, 2002, 23(5):206-209.[3] https://mp.weixin.qq.com/s/5AW3VfVa_xQzHeAVDVPU7A百奥动物立足全球生物医药行业,从技术创新出发,百奥赛图建立“BioMice百奥动物”子品牌。百奥动物集创新动物模型研发制备、生产供应和实验服务为一体,拥有2500余个独特基因编辑动物/细胞系模型,覆盖肿瘤,自免,代谢等多个疾病领域,包括重度免疫缺陷B-NDG及系列小鼠、靶点人源化小鼠和全人抗体RenMice三大系列产品,结合优质的药理药效评价服务,以高标准的3大动物中心为支撑,极大的满足了全球科学研究和药物开发需求。创新的动物模型、高标准的质量管理、多元化的服务平台,助推生物医药创新产业的快速发展。
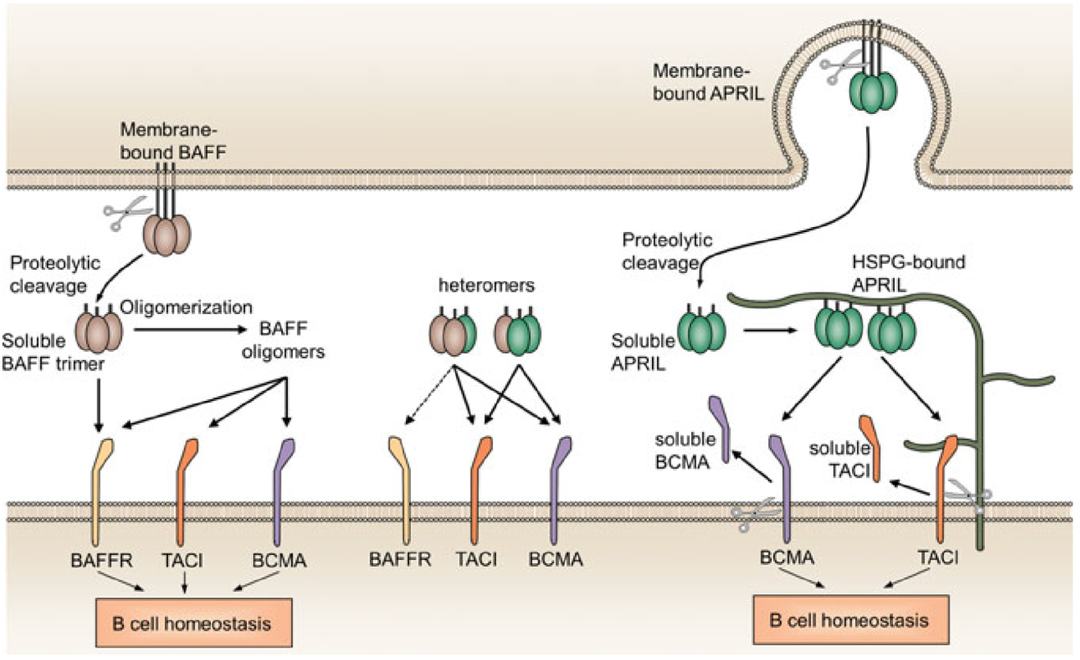
自身免疫性疾病,是机体免疫系统出现异常,自身抗体或自身效应淋巴细胞攻击正常细胞导致的自身组织器官损伤性疾病。自身免疫性疾病有100多种,位于心血管疾病和肿瘤之后的第三类主要疾病。B细胞作为自身免疫性疾病最重要的效应细胞之一,靶向B细胞相关靶点药物的开发是各大药企热衷的治疗领域之一。BAFF靶点介绍B细胞激活因子BAFF(也称为TNFSF13B、CD257)作为一种关键的B细胞生存因子,属于肿瘤坏死因子(TNF)配体家族成员,有可溶型和膜结合型两种形式。BAFF在包括单核细胞、树突细胞和骨髓基质细胞在内的各种细胞类型上均有表达,其受体有3种:TNFRSF13B/TACI(跨膜激活因子和钙调节因子、亲环蛋白配体作用因子), TNFRSF17/BCMA(B细胞成熟抗原),TNFRSF13C/BAFFR(B细胞激活因子受体)。BAFF通过与其受体的结合在支持B细胞的存活和增殖、调节类别转换重组以及自身免疫性B细胞的选择等方面发挥关键作用;此外,有研究发现BAFF也能促进T细胞的活化、增殖和分化。图1. BAFF与其受体的互作[1]BAFF参与了人类许多自身免疫性疾病的发病机制,在系统性红斑狼疮(SLE)、多发性硬化症(MS)、IgA肾病、Sjögren’s综合征和类风湿关节炎等患者的血清中检测到BAFF的浓度水平升高。其中,系统性红斑狼疮(SLE)是一种临床表现为多系统损害症状的慢性系统性自身免疫疾病,它的发病机制复杂,包括自身反应性T细胞与B细胞的增殖活化,多种自身致病性抗体的产生,细胞因子分泌及其受体表达异常等。目前,用于治疗SLE的上市药物只有两种,分别是贝利尤单抗(Belimumab)和泰它西普(Telitacicept)。图2. 系统性红斑狼疮的免疫发病机制(注:BAFF又称为BLyS)[2]贝利尤单抗贝利尤单抗(Belimumab,商品名:倍力腾)是一种特异性识别和抑制BAFF生物活性的人源性单克隆抗体,能显著降低循环B细胞水平。B细胞耐受性的丧失在SLE的发生和维持中起着关键的病理作用,靶向B细胞的产生、相互作用和功能性治疗被认为是一种有前途的新策略。贝利尤单抗是当前唯一同时获得FDA和CDE批准的新药。12000年10月,HGS和Cambridge Antibody Technology(CAT)达成合作,共同开发针对BLyS的单克隆抗体。最终在2003年得到了以高亲和力结合BLyS的人源单抗“LymphoStat B”,即后来的Belimumab。22006年8月,HGS和GlaxoSmithKline(GSK)达成了一项共同开发和商业化Belimumab的协议。根据协议,GSK协助HGS进行Belimumab的临床试验,两家公司平分临床试验的成本及之后产品销售获得的利润。32019年7月,贝利尤单抗在中国获批上市,全球首个且目前唯一治疗SLE的生物制剂Belimumab在华获批,开启了SLE临床治疗的新篇章。 42020年12月,贝利尤单抗正式获得国家药品监督管理局批准,通过谈判纳入了2020版国家医保目录,用于治疗儿童SLE,意味着贝利尤单抗成为中国覆盖5岁及以上儿童及成人SLE治疗的生物制剂。图3. 贝利尤单抗产品图(来源于百度图片搜索)泰它西普泰它西普(Telitacicept,商品名:泰爱)是一种TACI-Fc融合蛋白,由人跨膜激活剂及钙调亲环素配体相互作用因子(TACI)受体的胞外域以及人免疫球蛋白G(IgG)的可结晶片段(Fc)域构成。泰它西普靶向两类对B淋巴细胞发育至关重要的细胞信号分子:B淋巴细胞刺激因子(BLyS)和增殖诱导配体(APRIL),能够有效降低B细胞介导的自身免疫应答,达到治疗自身免疫疾病的目的。泰它西普目前仅被CDE批准用于治疗8分以上的SLE患者。12010年荣昌生物向国家药监局申报临床试验,并于2011年获得I期临床试验批件。22012年在北京协和医院完成I期临床试验,2013年获国家食品药品监督管理总局Ⅱ、Ⅲ期临床试验批件。32019年11月,泰它西普的新药上市申请正式获得CDE承办受理,并于12月以具有明显治疗优势创新药纳入优先审评审批。42021年3月,泰它西普正式获得国家药品监督管理局(NMPA)批准上市,用于治疗SLE,标志着荣昌生物迎来了首个正式进入商业化阶段的产品。图4. 泰它西普产品及结构图(来源于荣昌生物官网)根据科睿唯安数据库检索发现,除了以上两种上市药物以外,还有多款相关药物处在临床研究阶段。表1.药物研究进展(部分)BioMice百奥动物自主开发了人源化B-hBAFF mice、B-hBAFFR mice 助力药物研发。B-hBAFF mice基本信息蛋白表达分析用ELISA方法对野生型(WT)小鼠和B-hBAFF小鼠进行BAFF种特异性表达分析。采集WT小鼠(+/+)和杂合子B-hBAFF小鼠(H/+)的血清,用种特异性BAFF ELISA试剂盒进行ELISA分析。小鼠BAFF在WT小鼠和杂合B-hBAFF小鼠中均可检测到,人BAFF在杂合B-hBAFF小鼠中可检测到。B-hBAFFR mice基本信息蛋白表达分析流式细胞术分析B-hBAFFR纯合小鼠中种特异性BAFFR的表达情况。分别取WT小鼠(+/+)和纯合B-hBAFFR小鼠 (H/H)的脾细胞,用种特异性抗BAFFR抗体进行流式细胞术分析。小鼠BAFFR在WT小鼠中检测到,人BAFFR只在纯合B-hBAFFR中能检测到,WT小鼠中无法检测到。更多验证数据信息,正在开展中,敬请关注。参考资料[1]. Samy E , Wax S , Huard B , et al. Targeting BAFF and APRIL in systemic lupus erythematosus and other antibody-associated diseases[J]. International Reviews of Immunology, 2017.[2]. Espinosa G , Cervera R . Belimumab: a BLyS-specific inhibitor for the treatment of systemic lupus erythematosus.[J]. Clinical Pharmacology & Therapeutics, 2012, 91(12):143.[3]. https://www.gsk.com/en-gb/search/?q=belimumab&p=5.[4]. http://www.remegen.cn/index.php?v=show&cid=68&id=113.

骨质疏松症被定义为一种全身性骨骼疾病,其特征是骨量低,骨组织微结构恶化,从而导致骨脆性增加,易发生骨折[1]。骨质疏松症的基本发病机制是骨形成和骨吸收的失调。据统计,目前全世界大约2亿人患骨质疏松症,跃居各种常见病的第7位。据悉,2015~2019年全球骨质疏松症药物市场相对稳定,伴有小幅增长,2019年全球销售额为97.09亿美元。从TOP20的产品看,以RANKL抑制剂、甲状旁腺激素类似物、双膦酸盐类药物、钙剂与维生素D、选择性雌激素受体调节剂这五大类药物为主[2]。骨质疏松症新药研究进展进军骨质疏松症市场的两个新秀为地舒单抗和罗莫单抗,其中地舒单抗是首个且唯一获批的靶向RANKL单克隆抗体,通过阻断RANK和RANKL的结合来抑制破骨细胞的活性,在抑制成熟破骨细胞功能的同时,还可以抑制破骨前体细胞成熟,减少骨质吸收、促进骨重建,从而延迟和减少骨相关事件发生。值得一提的是,地舒单抗虽然获批较晚,但却是目前骨质疏松症药物市场的佼佼者。而罗莫单抗是一种人源化单克隆抗体(IgG2),可以抑制骨硬化蛋白(SOST)的活性,在加速骨形成的同时减少骨吸收,增加骨密度。除此之外,骨质疏松症治疗新靶点也在不断被挖掘,目前全球还有多款在研治疗骨质疏松症的药物,部分在研新药详情见下表:百奥动物骨质疏松症模型卵巢切除(OVX)小鼠是一种公认的人类绝经后骨质疏松症(PMOP)的体内模型。采用骨矿物质密度(BMD)测量、Micro-CT分析和组织形态学分析对卵巢切除小鼠进行评价[3,4]。百奥动物建立了稳定的卵巢切除术诱导的C57BL/6小鼠骨质疏松症模型,可用于骨质疏松症的临床前研究和药理药效学评价。骨质疏松症模型构建及验证骨质疏松症小鼠模型的构建卵巢切除诱导小鼠体重增加,子宫重量减轻卵巢切除诱导小鼠骨质流失(Micro-CT)C57BL/6小鼠在第0天切除卵巢。手术后6周,取出骨头(C)和子宫(B)进行检测。每周记录体重(A),实验终点记录子宫重量 (B)。实验结果表明,卵巢切除术导致小鼠体重增加,子宫重量减轻且骨质流失。数值以平均值±标准误表示。卵巢切除诱导骨质疏松症的病理分析卵巢切除6周后进行病理分析。实验结果表明,接受卵巢切除手术的小鼠骨小梁面积减少。数值以平均值±标准误表示。骨质疏松症模型可提供的检测项目骨质疏松症靶点人源化小鼠模型百奥动物针对骨质疏松症相关靶点开发了系列人源化小鼠模型,助力相关药物研发进程。参考资料:[1]. Eastell R, O‘Neill TW , Hofbauer LC et al. Postmenopausal osteoporosis. Nat Rev Dis Primers. 2016, 2:16069.[2]. https://mp.weixin.qq.com/s/E7M_lJc4gjaY3cHjoMG7xA[3]. Wang HC, Zhou KF, Xiao FZ et al. Identification of circRNA-associated ceRNA network in BMSCs of OVX models for postmenopausal osteoporosis. Sci Rep. 2020, 10(1):10896.[4]. Chen K, Qiu PC, Yuan Y et al. Pseurotin A Inhibits Osteoclastogenesis and Prevents Ovariectomized-Induced Bone Loss by Suppressing Reactive Oxygen Species. Theranostics. 2019, 9(6):1634-1650.

2006年3月,TeGenero公司的CD28超级激动剂单抗TGN1412治疗风湿性关节炎/白血病的1期临床试验中,6名志愿者遭受细胞因子释放综合征并伴有多器官功能衰竭,全身极度肿胀成为“大象人”,万幸的是最终脱离生命危险,该事件直接导致TeGenero破产。16年前的黑天鹅事件也给CD28药物开发蒙上了一层阴影。后续TGN1412并未被就此放弃,莫斯科抗体公司TheraMab顺利接盘并更名为TAB08,有报道称1期临床NCT03006029、NCT01990157不良事件保持在一个可接受的水平(短暂的发热与IL-6有关),然而试验如今已经因“行政原因”终止,这款CD28单抗最终也没能迎来涅槃重生[1]。如此看来,再次沉沦的CD28的未来当真就是砂砾宿命了吗?2017年,Science上发表了一篇题为Rescue of exhausted CD8 Tcells by PD-1 targeted therapies is CD28-dependent的文章,证明了CD28/B7共刺激途径对有效的PD-1疗法至关重要。至此,CD28再次回到研究者的视线中。2019年11月,赛诺菲在Nature Cancer发表了一款CD28/CD3/CD38三抗的研究进展。该三抗在CD3分子亲和力的选择上,采用了中等亲和力的抗体(KD~20nM)平衡了杀伤有效性以及细胞因子大量释放的安全性问题[2]。2020年1月,再生元在Science Translational Medicine发表论文,指出CD28双抗可以增强CD3的抗肿瘤疗效。在动物实验中,共刺激型CD28双抗明显增强了CD3双抗的疗效,且没有细胞因子风暴的风险。2020年6月24日,再生元再次在ScienceTranslational Medicine杂志上发表论文,证实了肿瘤特异性抗原(TSA) x CD28双特异性抗体可以与更广泛的抗PD-1抗体协同作用,增强癌症治疗效果,诱导长效抗肿瘤免疫力,且不会诱发细胞因子风暴,具有很好的耐受性。今年2月,赛诺菲的研发团队在Nature发表了一篇HER2×CD3×CD28三抗的研究进展。研究表明,在原代人CD3+T细胞重组的免疫缺陷NSG小鼠体内,该三抗使CD8 T细胞中颗粒酶的表达增加了6.8倍。相关肿瘤药效实验结果表明,剂量低至10μg/kg时,HER2×CD3×CD28三抗依然能够诱导肿瘤消退。近期,惠和生物靶向CD3×CD28×CD19三特异性抗体CC312的IND申请获得美国FDA默示许可,进入临床研发阶段,CC312是国内首个,也是全球第三个基于CD28共刺激信号的三特异性抗体。随着赛诺菲、再生元等牵头的研究推进,CD28被强势拉回公众视野,更多的潜力有待开发!CD28相关信号通路CD28是T细胞激活最重要的参与者之一,是增强MHC-TCR的主激活信号的主要辅助信号。CD28和CTLA-4具有高度的同源性,具有相同的配体CD80和CD86(B7-1和B7-2),CD28负责传递激活信号,活化T细胞,而CTLA-4负责传递抑制信号给T细胞,让T细胞不会杀伤其它细胞,包括肿瘤细胞。CTLA-4与配体的亲和力要高于CD28,因此会竞争阻断CD28的T细胞激活作用。在T细胞辅助激活的过程中,CD86优先表达,在与CD28结合上,CD86表现出优于CD80的结合能力,有利于T细胞激活。在T细胞激活的过程中,CD28扮演着“加油”角色,CTLA-4扮演着“前刹车”角色,PD-1则扮演着“后刹车”角色[3]。CD28、CTLA-4、PD-1/PD-L1信号通路[4]CD28靶点部分开发进展CD28作为一个老靶点,不仅机制清晰,而且针对不同临床适应症,既可开发拮抗剂也可开发激动剂,理应前景无限,但由于其研发历程的跌宕起伏,目前只有少量抗体药物开发管线。其临床药物开发上主要集中在3个方面:CD28关联靶点融合蛋白药物;单抗药物;多特异性抗体药物。(数据来源科睿唯安及公开信息整理)CD28系列人源化动物模型对于CD28相关药物的研究,再生元和赛诺菲已经做出了很好的表率,进一步的数据也许会让CD28再次火热起来。相关动物模型对于CD28靶向调节剂开发可谓至关重要,BioMice 百奥动物自主研发的CD28系列人源化鼠是评估CD28相关抗体药物的优质临床前实验动物模型。B-hCD28 小鼠验证数据蛋白表达分析流式细胞术分析B-hCD28纯合小鼠CD28的表达取抗CD3ε抗体刺激野生型小鼠和纯合B-hCD28小鼠的脾细胞,用种属特异性抗CD28抗体进行流式分析。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD28小鼠中检测到,而在野生型小鼠中检测不到。抗人CD28抗体的体内药效抗人CD28抗体在B-hCD28小鼠体内的抗肿瘤活性实验结果表明,两种抗人CD28抗体在B-hCD28小鼠体内均能有效控制肿瘤生长,表明B-hCD28小鼠为抗人CD28抗体的体内评价提供了一个优质的临床前模型。抗人PD-L1xCD28双特异性抗体的体内药效抗PD-L1和抗CD28 (PD-L1xCD28)双特异性抗体(BsAb)在B-hCD28小鼠中的抗肿瘤活性结果表明,抗人PD-L1xCD28 BsAbs能够有效控制B-hCD28小鼠的肿瘤生长,表明B-hCD28小鼠为抗人PD-L1xCD28 BsAbs的体内评价提供了一个优质的临床前模型。B-hCD3E/hCD28小鼠验证数据蛋白表达分析流式细胞术分析B-hCD3E/hCD28纯合小鼠CD3E的表达取野生型小鼠和纯合B-hCD3E/hCD28小鼠脾细胞,用种属特异性抗CD3E抗体进行流式细胞术分析。小鼠CD3E在野生型小鼠中检测到。人CD3E仅在纯合B-hCD3E/hCD28小鼠中检测到,而在野生型小鼠中检测不到。流式细胞术分析B-hCD3E/hCD28纯合小鼠CD28的表达取野生型小鼠和纯合B-hCD3E/hCD28小鼠脾细胞,用种属特异性抗CD28抗体进行流式细胞术分析。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD3E/hCD28小鼠中检测到,而在野生型小鼠中检测不到。B-hCD3EDG/hCD28 小鼠验证数据蛋白表达分析流式细胞术分析B-hCD3EDG/hCD28纯合小鼠CD3E的表达取野生型小鼠和纯合B-hCD3EDG/hCD28小鼠脾细胞,用种属特异性抗CD3E抗体进行流式分析。小鼠CD3E在野生型小鼠中检测到。人CD3E仅在纯合B-hCD3EDG/hCD28小鼠中检测到,而在野生型小鼠中检测不到。流式细胞术分析B-hCD3EDG/hCD28纯合小鼠CD28的表达取野生型小鼠和纯合B-hCD3EDG/hCD28小鼠脾细胞,用种属特异性抗CD28抗体进行流式细胞术分析。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD3EDG/hCD28小鼠中检测到,而在野生型小鼠中检测不到。B-hCD28/hTROP2小鼠验证数据蛋白表达分析流式细胞术分析B-hCD28/hTROP2纯合小鼠CD28的表达取野生型小鼠和纯合B-hCD28/hTROP2小鼠脾细胞,用种属特异性抗CD28抗体进行流式细胞术分析。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD28/hTROP2小鼠中检测到,而在野生型小鼠中检测不到。Western blot分析TROP2在B-hCD28/hTROP2纯合小鼠中的表达取野生型小鼠和纯合B-hCD28/hTROP2小鼠的皮肤组织,用抗TROP2抗体进行western blot分析。小鼠TROP2在野生型小鼠中检测到。人TROP2仅在纯合B-hCD28/hTROP2小鼠中检测到,而在野生型小鼠中检测不到。B-hCD28/hB7-H3小鼠验证数据蛋白表达分析流式细胞术分析B-hCD28/hB7-H3纯合小鼠CD28的表达取野生型小鼠和纯合B-hCD28/hB7-H3小鼠脾细胞,用种属特异性抗CD28抗体进行流式细胞术分析。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD28/hB7-H3小鼠中检测到,而在野生型小鼠中检测不到。Western blot分析B-hCD28/hB7-H3纯合小鼠B7-H3的表达采集野生型小鼠和纯合B-hCD28/hB7-H3小鼠附睾,用抗B7-H3抗体进行western blot分析。由于抗体的交叉反应,野生型小鼠和纯合B-hCD28/hB7-H3小鼠均可检测到B7-H3。B-hCD28/hCD20小鼠验证数据蛋白表达分析流式细胞术分析B-hCD28/hCD20纯合小鼠CD28的表达取野生型小鼠和纯合B-hCD28/hCD20小鼠脾细胞,用种属特异性抗CD28抗体进行流式细胞术分析。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD28/hCD20小鼠中检测到,而在野生型小鼠中检测不到。流式细胞术检测B-hCD28/hCD20纯合小鼠CD20的表达取野生型小鼠和纯合B-hCD28/hCD20 小鼠脾细胞,用种属特异性抗CD20抗体进行流式细胞术分析。小鼠CD20在野生型小鼠中检测到。人CD20仅在纯合B-hCD28/hCD20小鼠中检测到,而在野生型小鼠中检测不到。B-hSIRPA/hCD47/hCD3E/hCD28小鼠验证数据蛋白表达分析流式细胞术分析B-hSIRPA/hCD47/hCD3E/hCD28纯合小鼠CD3E、CD28、SIRPA、CD47的表达取野生型小鼠和纯合B-hSIRPA/hCD47/hCD3E/hCD28小鼠脾细胞,分别用种特异性抗CD3E、CD28、SIRPA、CD47抗体进行流式细胞术分析。由于抗体的交叉反应,野生型小鼠和B-hSIRPA/hCD47/hCD3E/hCD28小鼠均可检测到小鼠SIRPA,人SIRPA仅在纯合B-hSIRPA/hCD47/hCD3E/hCD28小鼠中检测到,而在野生型小鼠中未检测到;小鼠CD3E、CD28、CD47在野生型小鼠中检测到,人CD3E、CD28、CD47仅在纯合B-hSIRPA/hCD47/hCD3E/hCD28小鼠中检测到,而在野生型小鼠中检测不到。CD28靶点相关模型列表 想要了解更多人源化小鼠,欢迎扫描下方二维码查看或者来电咨询。 参考资料:[1] https://mp.weixin.qq.com/s/6tuPYtTIr_gNQrb0N7o7_w[2] Sanofi R&D Investor Event[3] Dimitris Skokos et al. A class of costimulatoryCD28-bispecific antibodies that enhance the antitumor activity ofCD3-bispecific antibodies. Sci. Transl. Med. 2020[4]https://oncologypro.esmo.org/education-library/esmo-handbooks/immuno-oncology/immune-synapse
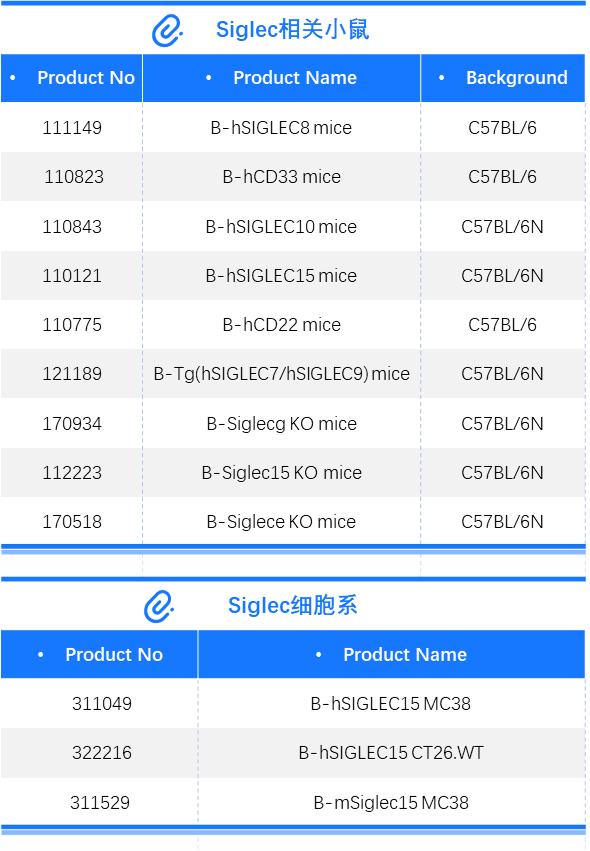
嗜酸性胃炎(EG)、嗜酸性十二指肠炎(EoD)和嗜酸性食管炎是一类严重的炎症性疾病,表现为胃、十二指肠和食管外嗜酸性粒细胞水平升高。目前没有针对此种疾病的有效疗法,采用全身性的类固醇激素疗法能够改善疾病症状,但长期使用会带来严重副作用。SIGLEC8因为具有强大的嗜酸性粒细胞促凋亡和肥大细胞抑制活性,并选择性表达在这些关键的炎症效应细胞的作用,被认为是很有前途的抗炎靶点。靶点概述Siglecs(结合唾液酸的免疫球蛋白型凝集素)是主要在造血系统细胞上发现的一类免疫调节受体。迄今为止,已在人类中鉴定出14种SIGLEC,主要在各种白细胞群上表达。[1]根据进化上的保守程度分为进化保守型和非保守型两类SIGLEC。保守型SIGLEC由SIGLEC1、SIGLEC2、SIGLEC4和SIGLEC15组成,它们在哺乳动物中存在直系同源基因;非保守型SIGLEC则由其他成员组成,在哺乳动物物种中并不存在真正的同源基因,被称为CD33相关基因 SIGLEC,其中就包括SIGIEC8。图1. SIGLEC8促进嗜酸性粒细胞凋亡并减少肥大细胞炎症反应&SIGLEC8的潜在聚糖配体[2]SIGLEC8是属于SIGLEC 家族 CD33样亚家族成员,全称为“sialic acid binding Ig like lectin 8”。它仅在人类嗜酸性粒细胞和肥大细胞上高度表达,在嗜碱性粒细胞上表达较弱。在体外,SIGLEC8在嗜酸性粒细胞上与抗体或合成聚糖配体包被的聚合物交联可诱导其快速凋亡,而在肥大细胞上,SIGLEC8 连接可抑制 IgE/FceRI介导的炎症介质释放,而不影响他们的生存[3]。用促进存活的促炎性细胞因子预激活嗜酸性粒细胞(过敏性炎症的一个关键过程)不仅不能抵消 SIGLEC8 触发的细胞死亡,反而会有效增强其对 SIGLEC8连接反应中细胞凋亡的敏感性,这表明SIGLEC8介导的免疫抑制在炎症条件下发挥着特殊作用,被认为是很有前途的抗炎靶点,因此在治疗过敏反应、哮喘等由这些细胞引发的炎症性疾病方面具有重要作用[4]。新药研究进展目前以SIGLEC8为靶点的在研药物共5项,开发机构均是Allakos。其中Antolimab(AK-002)处于临床II期,其余四项处于临床前阶段。Antolimab,是一款靶向SIGLEC8的人源重组非岩藻糖基化单克隆IgG1抗体的药物;能够通过SIGLEC8移植肥大细胞和消耗嗜酸性粒细胞,从而抑制有这两类细胞的错误激活导致的一系列疾病,如嗜酸性胃炎(EG)、嗜酸性十二指肠炎(EoD)和嗜酸性食管炎等慢性炎症疾病。2020年5月Allakos公布Antolimab在治疗EG、EoD和嗜酸性食管炎上已经获得了 FDA的孤儿药认定资格。数据来源于科睿唯安为助力靶向SIGLEC8的新药研发,百奥赛图成功开发了相应靶点人源化小鼠。B-hSIGLEC8 miceB-hSIGLEC8 小鼠中的嗜酸性粒细胞和肥大细胞与抗人 SIGLEC8 抗体结合通过流式细胞术分析 B-hSIGLEC8 小鼠的嗜酸性粒细胞和肥大细胞。从野生型 C57BL/6 小鼠和B-hSIGLEC8小鼠中分离出嗜酸性粒细胞和腹膜灌洗肥大细胞。使用基准抗体 Lirentelimab(内部合成)进行流式细胞术分析以评估人 SIGLEC8 表达。Lirentelimab 在纯合 B-hSIGLEC8 小鼠中仅与 SIGLEC8结合,在野生型小鼠中不与 SIGLEC8结合。小鼠哮喘模型BALF免疫细胞数量从B-hSIGLEC8小鼠(n=6)中分离出BALF免疫细胞。在PBS或lirentelimab(内部合成)处理下,通过流式细胞术分析嗜酸性粒细胞的数量。lirentelimab 治疗后,纯合 B-hSIGLEC8 小鼠中炎症细胞的表达水平低于阳性对照。抗人SIGLEC8抗体的药效B-hSIGLEC8 小鼠哮喘样模型中的 H&E 染色。(A) 在研究结束时收集肺组织。H&E染色结果显示,暴露于PBS气雾剂的B-hSIGLEC8小鼠的肺组织没有表现出任何炎症。暴露于OVA导致 B-hSIGLEC8 小鼠的支气管周围和血管周围炎症显着增加。(B) 在用 lirentelimab(内部合成)治疗的小鼠中观察到嗜酸性粒细胞浸润显着减少。注:治疗模型组中lirentelimab单抗通过气管内雾化给药。本期分享到此结束,如果您对相关小鼠模型有需求,欢迎随时与我们联系。参考文献[1] Ravetch JV, Lanier LL (2000) Immune inhibitory receptors.Science290(5489):84–89.[2] Angata T, Varki A. Discovery, classification, evolution and diversity of Siglecs. Mol Aspects Med. 2023 Apr;90:101117. doi: 10.1016/j.mam.2022.101117.Epub 2022 Aug 18. PMID: 35989204; PMCID: PMC9905256.[3] Hudson SA, Bovin NV, Schnaar RL, Crocker PR, Bochner BS (2009) Eosinophil-selectivebinding and proapoptotic effect in vitro of a synthetic Siglec-8 ligand, polymeric6′-sulfated sialyl Lewis x.J Pharmacol Exp Ther330(2):608–612.[4] Na HJ, Hudson SA, Bochner BS (2012) IL-33 enhances Siglec-8 mediated apoptosis ofhuman eosinophils.Cytokine57(1):169–174.

MSLN基因编码一种前体蛋白,经蛋白水解处理生成两种蛋白产物,主要位于正常间皮细胞表面,两种蛋白产物为巨核细胞增强因子(megakaryocyte potentiating,MPF)和间皮素(Mesothelin,MSLN)。巨核细胞增强因子作为细胞因子可刺激骨髓巨核细胞集落形成。间皮素在正常组织中,仅表达在间皮细胞,但在间皮瘤(mesothelioma)、卵巢癌(ovarian cancer)、胰腺癌(pancreatic cancer)、胆管癌(cholangiocarcinoma)等肿瘤中均有高表达。因此间皮素是很有前途的肿瘤特异性治疗候选药物靶点。图1.间皮素的结构和功能[1]MSLN通过ERK和PI3K/Akt通路促进肿瘤细胞存活和增殖;通过MMP-7的活性促进侵袭性和转移过程。通过与表达MUC16的细胞相互作用,也可以促进转移。然而,MSLN与EMT和血管生成相关的基本机制在PDAC中仍然有待阐明。MSLN在80%到90%的PDAC中过度表达,使该靶点成为PDAC患者治疗的一个有吸引力的候选。图2.MSLN在胰腺导管腺癌(PDAC)进展中的作用[2]MSLN与胰腺癌细胞表面的MUC16结合,激活了p38 MAPK依赖性途径,进而上调了MMP-7的合成,导致侵袭和迁移潜力增加。在胰腺癌细胞不表达MUC16的情况下,MSLN能够通过激活ERK依赖性途径上调MMP-7的表达。图3. MSLN-MUC16结合诱导胰腺癌细胞MMP-7的分子通路[3]目前靶向MSLN治疗实体瘤的药物主要有:单克隆抗体药物,携带蛋白毒素的单克隆抗体药物,携带低分子量细胞毒性药物的单克隆抗体药物,靶向MSLN的CAR-T细胞药物,以及可以诱导T细胞针对MSLN产生免疫应答的疫苗。图4. 临床试验中靶向MSLN的方法[4]最新研究进展据不完全统计,目前MSLN靶点处于在研阶段的相关药物有56个,目前进行相关药物研发的企业包括拜耳,Atara Biotherapeutics,诺华在研,亘喜生物,荣昌生物等。目前已有诸多国内外企业在该领域进行了布局。部分处于临床及以上阶段的药物情况统计见下表:数据来源于科睿唯安及公开信息整理针对MSLN靶点机制研究和新药开发的需求,BioMice百奥动物自主研发了B-hMSLN mice和B-hMSLN ID8、B-hMSLN MC38细胞系,助力靶向MSLN药物开发,为临床前药效评估提供了优质模型。B-hMSLN mice基本信息蛋白表达分析利用western blot检测野生型小鼠和B-hMSLN小鼠中种属特异性MSLN的表达。取野生型小鼠(+/+)和杂合B-hMSLN小鼠(H/+)的肺部裂解液,用抗MSLN抗体进行western blot分析。结果显示,小鼠MSLN在杂合B-hMSLN小鼠(H/+)和野生型小鼠(+/+)中均可检测到。人MSLN只在B-hMSLN小鼠(H/+)中可检测到。免疫组化(IHC)方法检测MSLN表达IHC显示在B-hMSLN小鼠肺部组织中有代表性间皮素表达。用人MSLN特异性抗体(A,B)和抗兔IgG抗体(C)特异的抗体对组织进行染色。结果显示,在纯合B-hMSLN小鼠中,细胞膜上显示人MSLN阳性(数据来源于合作方)。B-hMSLN ID8基本信息蛋白表达分析通过流式细胞术对纯合B-hMSLN ID8小鼠细胞中MSLN的表达进行分析。用物种特异性抗MSLN抗体对B-hMSLN ID8培养物的单细胞悬浮液进行染色。在B-hMSLN ID8小鼠细胞的表面检测到人MSLN。B-hMSLN ID8细胞的2-A11克隆被用于体内实验。肿瘤生长曲线&体重变化B-hMSLN ID8小鼠细胞的皮下同种移植肿瘤生长。将B-hMSLN ID8细胞(5x106)和野生型ID8细胞(1x106)皮下植入C57BL/6N小鼠(雌性,6周龄,n=8)。(A)平均肿瘤体积±SEM, (B)体重(平均值±SEM),每周测量两次肿瘤体积和体重,体积以mm3表示,使用公式,V=0.5×长径×短径2。如图A所示,B-hMSLN ID8细胞能够在小鼠体内建立肿瘤,可用于药效研究。肿瘤体积&重量测量肿瘤细胞的蛋白表达分析将B-hMSLN ID8细胞皮下移植到C57BL/6小鼠体内(n=8),在接种后21天,收集肿瘤细胞并通过流式细胞术检测人MSLN的表达。如图所示,人MSLN在肿瘤细胞表面高表达。因此,B-hMSLN ID8小鼠细胞可用于新型MSLN疗法的体内药效研究。B-hMSLN MC38基本信息蛋白表达分析通过流式细胞术对B-hMSLN MC38小鼠进行种属特异性MSLN 表达分析。对 B-hMSLN MC38 培养物的单细胞悬液用种属特异性抗 MSLN 抗体进行染色。结果显示:在B-hMSLN MC38小鼠细胞表面检测到人MSLN,小鼠MSLN不表达。因此 B-hMSLN MC38细胞的1-A03克隆可用于体内实验。肿瘤生长曲线&体重变化B-hMSLN MC38小鼠细胞的皮下同种移植肿瘤生长。B-hMSLN MC38 细胞 (1x106) 和野生型 MC38 细胞 (5x105) 被皮下植入 C57BL/6 小鼠 (雌性, 6 周龄, n=8)。每周两次测量肿瘤体积和体重。(A) 平均肿瘤体积 ± SEM, (B) 体重 (平均值±SEM)。体积以 mm3 表示,使用公式:V=0.5 × 长径 × 短径2。如图 A 所示,B-hMSLN MC38 小鼠细胞能够在体内建立肿瘤,并可用于药效研究。参考文献[1] Mesothelin:An Immunotherapeutic Targetbeyond Solid Tumors. Cancers (Basel). 2022 Mar;14(6):1550.[2] Montemagno C, et al. Int J Mol Sci. 2020 Jun 6;21(11):4067.[3] Chen SH, et al. Sci Rep. 2013;3:1870.[4] Montemagno C, et al. Int J Mol Sci. 2020 Jun 6;21(11):4067.
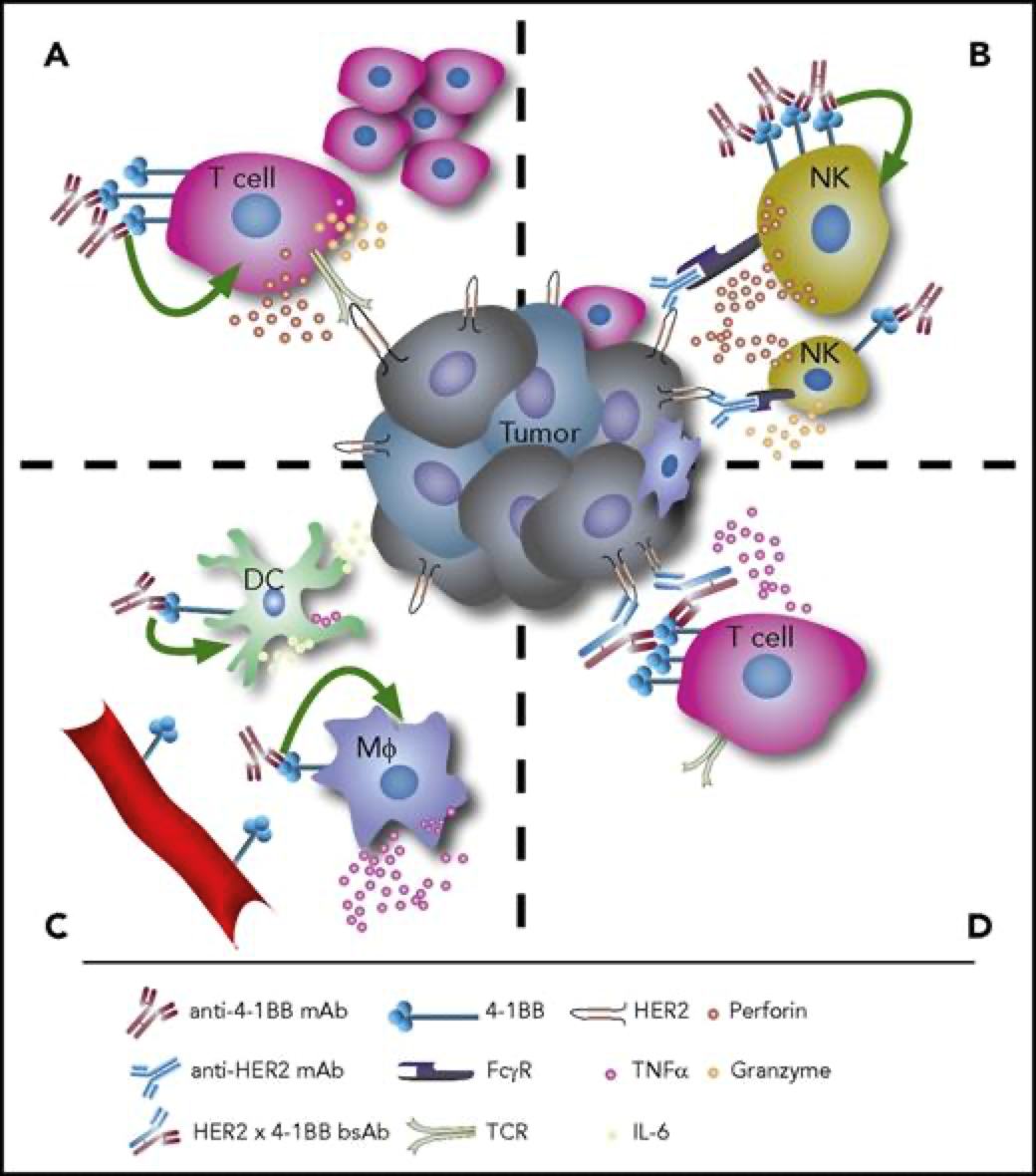
4-1BB靶点介绍4-1BB,即CD137,TNFRSF9(TNF receptor superfamily member 9),它于1989年首次被发现,属于TNF受体超家族。它在抗原启动的T细胞上表达,在静止的T细胞上不表达,除此以外,4-1BB还在树突状细胞(DC)、自然杀伤细胞(NKs)、活化的CD4+和CD8+T淋巴细胞、嗜酸性粒细胞、自然杀伤T细胞(NKT)和肥大细胞中表达。当4-1BB与其配体4-1BBL结合后,可以产生共刺激信号诱导CD4+和CD8+T细胞的活性,促进T细胞增殖,刺激巨噬细胞产生如如IL-6、TNF-α等多种炎症细胞因子。从而激活机体免疫系统,达到抑制肿瘤发生发展、促进肿瘤细胞清除的功效。有研究报道,当在进行4-1BB抗体药物研发时,还要需要考虑抗体结合位点在人和小鼠之间存在的差异性。其结合作用仅限于富含半胱氨酸结构域(CRD),小鼠4-1BBL主要与CRDII结合,人4-1BBL主要与CRDIII结合。小鼠4-1BB/4-1BBL是二聚体,人4-1BB/4-1BBL为三聚体,且人4-1BB不与小鼠的4-1BBL相互作用。[1]图1. 抗4-1BB疗法的免疫调节作用[2]4-1BB药物开发的现状4-1BB作为癌症免疫疗法中十分有潜力的靶点,针对其进行的药物研发非常火热,全球目前已有至少40款4-1BB激动型抗体进入临床研究阶段。4-1BB单抗药物由 BMS研发的Urelumab(全人源IgG4 mAb)是一个4-1BB强激动性的单抗,在I/II期试验中表现出良好的抗肿瘤活性,但在后续治疗过程中发生了两起由肝毒性引起的致命性不良事件。由Pfizer研发的Utomilumab(人源化IgG2 mAb)是一个4-1BB弱激动性的单抗,虽然有较好的肝脏安全性表现,但作为单药治疗抗肿瘤活性十分有限。因此,此前未能很好的在激动作用和肝毒性之间达到良好的平衡,导致4-1BB单抗产品临床应用空间有限;目前新一代单抗设计通过对Fc功能改造试图保留激动性的同时克服安全性问题,Alligator、Agenus以及国内的礼进生物和天演药业的4-1BB单抗产品表现出良好的初步临床数据。4-1BB重点单抗产品临床进度数据来源:Cortellis4-1BB双抗药物平衡抗体激动作用强弱和其肝毒性,是4-1BB单抗药物开发的难点,因此为了克服疗效和毒性的问题,研究者们开始探索新的开发策略。其中以4-1BB为靶点的双抗、三抗以及四抗成为研发的一个热点领域,国内外多家药企均有布局。4-1BB双特异性抗体通过对肿瘤细胞表面靶点和4-1BB亲和力不同精准定位肿瘤微环境,减少肝毒性等副作用。因此双抗疗效相比单抗可以实现更精准的靶向,从而使得临床前的抗肿瘤活性和安全性都得到了提升。如PD-1/PD-L1就是4-1BB双抗常用的另一候选靶点。去年,BioNTech与Genmab联合研发的PD-L1×4-BB双抗药物GEN1046,是一种全长IgG1亚型的PD-L1×4-1BB双抗,其以临床Ⅰ/Ⅱa期结果发表在著名学术期刊《CANCER DISCOVERY》上的文章中,所使用的PD-L1/4-1BB双靶点人源化鼠由百奥动物提供。文中研究结果表明:GEN1046对于CPI耐药的实体瘤治疗效果良好,安全性高,为免疫联合治疗提供了新的方案。4-1BB重点双抗产品临床进度数据来源:Cortellis通过众多临床试验及以往多年研究积累,4-1BB 靶点被证实是肿瘤免疫治疗十分有潜力的靶点,目前如何最大化激动作用并最小化毒性是未来4-1BB激动剂研发亟需解决的问题。百奥动物自主研发的4-1BB系列人源化小鼠(详情见下表),是靶向4-1BB抗体开发相关药物进行药效评价的优质模型。B-h4-1BB/h4-1BBL mice高剂量Urelumab对B-h4-1BB小鼠和B-h4-1BB/h4-1BBL小鼠均产生肝毒性用PBS或Urelumab(内部合成)对纯合子B-h4-1BB小鼠和B-h4-1BB/h4-1BBL小鼠进行治疗 (n=5,雌性,7周龄)。第21天采集血清,检测谷丙转氨酶(ALT)、谷草转氨酶(AST)。与PBS对照相比,使用20mg /kg Urelumab治疗B-h4-1BB小鼠的ALT显著升高,而同样的治疗对B-h4-1BB/h4-1BBL小鼠没有影响。与PBS对照相比,B-h4-1BB小鼠AST无明显升高,但20ug/mL urelumab治疗可使B-h4-1BB/h4-1BBL小鼠AST明显升高。在1mg/kg剂量组,B-h4-1BB小鼠和B-h4-1BB/h4-1BBL小鼠的ALT和AST均无明显变化。表明高剂量urelumab对B-h4-1BB和B-h4-1BB/h4-1BBL小鼠有肝毒性作用。数值以平均值±SEM表示。高剂量Urelumab 治疗可导致B-h4-1BB小鼠和B-h4-1BB/h4-1BBL小鼠肝脏淋巴细胞浸润增加肝毒性的病理分析。在B-h4-1BB小鼠(G1-G3)中,当urelumab剂量为1mg/kg时,肝脏未见明显异常变化(G2)。当剂量为20 mg/kg (G3)时,观察到血管周围细胞浸润或肝脏慢性炎症,并伴有轻度病变。在B-h4-1BB/h4-1BBL小鼠(G4-G6)中,1 mg/kg组(G5) 3/5的小鼠出现病理变化(轻度2/5,轻度1/5),而在20 mg/kg剂量(G6)时,所有实验动物肝脏均出现中度变化。总体而言,20 mg/kg组(G6)肝脏病变程度和发生率显著高于1 mg/kg组(G5)。以上结果提示,高剂量(20mg /kg)的urelumab比低剂量(1mg /kg)的urelumab更容易发生血管周围细胞浸润或肝脏慢性炎症。B-h4-1BB/h4-1BBL小鼠对urelumab毒性作用比B-h4-1BB小鼠更敏感。因此B-h4-1BB/h4-1BBL小鼠是较好的临床前毒性评价模型。B-h4-1BB/h4-1BBL药效验证抗人4-1BB抗体在B-h4-1BB/h4-1BBL小鼠中的抗肿瘤药效。(A) 纯合子B-h4-1BB/h4-1BBL小鼠 (雌性,6-8周龄,n=5) 皮下接种小鼠结肠癌MC38细胞系。结果显示抗人4-1BB抗体能够显著抑制MC38肿瘤细胞的生长。(B)治疗期间体重变化。如图A所示,抗人4-1BB抗体在B-h4-1BB/h4-1BBL小鼠中有效地控制肿瘤生长,这表明B-h4-1BB/h4-1BBL小鼠可为体内评价抗人4-1BB抗体药效提供有力的临床前研究模型。值表示为平均值±SEM。参考文献[1].https://mp.weixin.qq.com/s/kvwfybpx63XQn26xdijIZwhttps://mp.weixin.qq.com/s/999cX0RaXHLyXxZ8MhIaBw[2]. Chester C, Sanmamed MF, Wang J, Melero I. Immunotherapy targeting 4-1BB:mechanistic rationale, clinical results, and future strategies. Blood. 2018 Jan4;131(1):49-57. doi: 10.1182/blood-2017-06-741041. Epub 2017 Nov 8. PMID:29118009.

GARP(LRRC32)是I型跨膜蛋白,其中胞外区有两组10 LRRs (leucine-rich repeats) 区,通过富含脯氨酸的结构域(proline domain)连接。非活性状态(Latent)TGF-β 通过其LAP上的半胱氨酸与GARP形成二硫键的连接(图1A)。图1. GARP的结构(A)和功能(B)[1]GARP对TGF-β的成熟和活化起作用(图1B)。TGF-β最开始以同源二聚体的方式合成,被蛋白酶切割后形成非活性状态的TGF-β。GARP可以增强酶切及latent TGF-β的形成。在细胞膜表面,GARP/latent TGF-β复合物与整合素互作,进而释放成熟的TGF-β。成熟的TGF-β可与细胞表面的TGF-β受体互作引发下游信号通路。 GARP在活化的Treg细胞上选择性表达,调控TGF-β的分泌。TGF-β具有广泛的细胞活性。在肿瘤内部,TGF-βs,尤其是TGF-β1,会刺激基质细胞增生、新血管形成、癌细胞转移及抑制免疫细胞浸润。新研究发现,TGF-β是免疫检查点抑制剂在肿瘤微环境中耐药的主要原因。基于此,GARP/TGF-β是Treg细胞具有免疫抑制功能的核心机理之一。抑制Treg细胞表面的GARP功能,或靶向清除GARP+ Treg细胞,是此靶点的主要的成药机制。目前,针对GARP没有上市药物。处于临床阶段的GARP药物有以下三款。药物成药形式靶点研发公司开发阶段1DS-1055a单抗GARP第一三共Phase I2ABBV-151单抗GARP/TGF-β1AbbviePhase I3HLX-60单抗GARP复宏汉霖Phase IDS-1055a是一款去岩藻糖的IgG1抗体,具有增强的ADCC效应,主要通过去除GARP+调节性T细胞(Treg)来发挥抗肿瘤作用[2]。目前正在实体瘤患者中开展I期临床试验(NCT04419532)。 ABBV-151是一款GARP/TGF-β1 IgG4抗体抑制剂,阻止TGF-β1的释放,从而减小TGF-β1的免疫抑制作用[3]。2018年,argenx将ARGX-115独家授权给AbbVie(ABBV-151)。目前ABBV-151正在进行单药及与PD-1单抗(ABBV-181)联用于实体瘤患者的I期临床试验(NCT03821935)。 HLX-60是一款GARP单抗,可阻断TGF-β1的释放,从而减小TGF-β1的免疫抑制作用;同时,还可以引发ADCC效应,清除GARP+ Treg。2022年8月26日,HLX-60与PD-1单抗联用于实体瘤患者的I期临床试验于澳大利亚获批[4]。百奥赛图自主研发了GARP人源化小鼠B-hGARP,用于靶向GARP的药物药效研究,助力新药研发。B-hGARP mice人GARP的种属特异性表达图2. RT-PCR分析纯合B-hGARP小鼠的种属特异性GARP mRNA的表达。鼠GARP mRNA只在野生型小鼠中检测到,人GARP mRNA只在纯合B-hGARP小鼠中检测到。图3. 利用流式细胞仪分析纯合B-hGARP小鼠的种属特异性GARP蛋白的表达。取野生C57BL/6小鼠(+/+)和纯合B-hGARP小鼠(H/H)的脾组织,用种属特异的抗GARP抗体进行流式分析。鼠GARP只在野生型小鼠中检测到,人GARP只在纯合B-hGARP小鼠中检测到。GARP人源化不影响白细胞各亚群比例图4. 脾脏白细胞亚群的流式分析。分离野生C57BL/6小鼠(+/+)和纯合B-hGARP小鼠(H/H) (n=3, 6周龄)的脾细胞并进行白细胞亚群流式分析。(A)代表性单活CD45+细胞的流式分析;(B)图A的统计分析。B-hGARP小鼠的T, B, NK, DC和单核/巨噬细胞的比例与野生型小鼠相似,证明人源化GARP不影响脾脏中这些细胞集群总体的发育、分化和分布。数值:平均值 ± SEM。图5. 脾脏T细胞亚群的流式分析。分离野生C57BL/6小鼠(+/+)和纯合B-hGARP小鼠(H/H)(n=3, 6周龄)的脾细胞并进行T细胞亚群流式分析。(A)代表性CD3+ T细胞的流式图分析;(B)图A的统计分析。B-hGARP小鼠的CD4+, CD8+ 和Treg细胞的比例与野生型小鼠相似,证明人源化GARP不影响脾脏中这些T细胞集群总体的发育、分化和分布。数值:平均值 ± SEM。人源化GARP同样也不影响血液中白细胞亚群和T细胞亚群总体的发育、分化和分布。(数据未展示)GARP人源化不影响小鼠血常规图6. B-hGARP小鼠血常规检测。采集野生C57BL/6小鼠(+/+)和纯合B-hGARP小鼠(H/H)(n=6, 6周龄)的血液进行血常规分析(CBC, complete blood cell count),所有检测项目均没有发现区别,说明GARP人源化并没有改变血细胞组成。数值:平均值 ± SEM。GARP人源化不影响小鼠血生化图7. B-hGARP小鼠血生化检测。采集野生C57BL/6小鼠(+/+)和纯合B-hGARP小鼠(H/H)(n=6,6周龄)的血清进行血生化分析,所有检测项目均没有发现区别。说明GARP人源化并没有改变血生化。数值:平均值 ± SEM。B-hGARP小鼠模型用于药效分析图8. mPD-1单抗和hGARP/latent-TGFβ1单抗联用在B-hGARP鼠中的抗肿瘤活性。(A)mPD-1单抗和自制hGARP/latent-TGFβ1单抗(ABBV-151)联用可抑制B-hGARP鼠中MC38肿瘤的生长。鼠结肠癌细胞系MC38(5E5)皮下植入纯合B-hGARP鼠(n=6,7周龄)中。当肿瘤长到50~70 mm3的时候对鼠进行分组,同时用mPD-1单抗和hGARP/latent-TGFβ1单抗联用治疗,治疗的剂量和时间如图所示。(B)治疗期间的体重变化。数值:平均值 ± SEM。图8A显示,mPD-1单抗和hGARP/latent-TGF-β1单抗联用可有效控制B-hGARP中肿瘤的生长,证明B-hGARP是一个强大的临床前模型,可用于抗人GARP抗体的体内药效评估。除B-hGARP小鼠外,在研品系还有B-hGARP/hTGF-β1双靶点人源化小鼠,敬请期待。参考资料[1] Metelli, Alessandra et al. “Immunoregulatory functions and the therapeutic implications of GARP-TGF-β in inflammation and cancer.” Journal of hematology & oncology vol. 11,1 24. 20 Feb. 2018, doi:10.1186/s13045-018-0570-z[2] Satoh, Kazuki et al. “Novel anti-GARP antibody DS-1055a augments anti-tumor immunity by depleting highly suppressive GARP+ regulatory T cells.” International immunology vol. 33,8 (2021): 435-446. doi:10.1093/intimm/dxab027[3] Cuende, Julia, et al. "Monoclonal antibodies against GARP/TGF-β1 complexes inhibit the immunosuppressive activity of human regulatory T cells in vivo." Science translational medicine 7.284 (2015): 284ra56-284ra56.[4] 复宏汉霖官网:https://www.henlius.com/en/NewsDetails-3737-26.html

不死的癌症类风湿性关节炎(Rheumatoid Arthritis,RA)是人类最常见的自身免疫性疾病之一,其临床症状主要表现有全身关节肿胀、疼痛和运动失调等,病情极其严重的甚至可能会导致残疾。而病理主要表现出增生性滑膜炎,软骨损伤以及骨结构的破坏。为了更好的研究人类的类风湿性关节炎,研究者在小鼠上开发出多种能模拟人类类风湿性关节炎的动物模型,而这之中胶原诱导型关节炎,能最大程度反映出人类类风湿性关节炎的临床和病理特征。Rheumatoid Arthritis百奥动物在不同品系的小鼠(C57BL/6、DBA)上都建立了稳定的胶原诱导型关节炎疾病模型(Collagen-Induced Arthritis,CIA),可用于相关药物的药效评价。类风湿性关节炎 (RA) 的病理及软骨和骨破坏的机制RA 的特征是增生性滑膜(血管翳)和 T 细胞的过度免疫反应。血管翳包括 T 细胞、滑膜成纤维细胞和巨噬细胞,可产生炎性细胞因子,如肿瘤坏死因子 (TNF)-α、白细胞介素-1(IL-1)、IL-6和IL-17。相关数据展示01RA/CIA 模型介绍 临床评分利用胶原(CII)在C57BL/6小鼠中诱导关节炎模型。(A)小鼠体重变化;(B)临床评分;(C)小鼠发病率。结果显示:在造模组(G2)中,小鼠的临床评分显著增加,提示关节炎模型建立成功。 病理分析C57BL/6小鼠关节炎模型建立后的病理分析。(A)病理评分;(B)病理切片H&E染色。造模组动物全部或部分关节可见皮下混合炎细胞浸润(a),关节周围狭窄(b),踝关节和/或趾骨关节软骨和骨组织破坏(c)等关节炎病变,进一步提示关节炎模型建立成功。02C57BL/6小鼠关节炎模型用于评价甲氨蝶呤(MTX)药效 临床评分甲氨蝶呤在小鼠关节炎模型中的药效作用。(A)小鼠体重变化;(B)临床评分;(C)小鼠发病率。结果显示:在造模组(G2)中,小鼠的临床评分显著增加,表明CIA模型建立成功,同时相比于未造模组(G1),体重波动更加明显。在给于甲氨喋呤(MTX)后,治疗组(G3)的平均临床评分显著低于造模组,证明小鼠的病情得到了有效控制。另外,在发病率方面,治疗组的发病率最大值为40%,也明显低于造模组近80%的发病率,提示小分子药甲氨喋呤对该疾病具有治疗作用。 病理分析甲氨喋呤在小鼠关节炎模型中药效作用的病理分析。(A)病理评分;(B)病理切片H&E染色。病理结果显示:未造模组(G1)动物镜下未见明显异常改变,踝关节软骨表面光滑,关节腔明显(a)。造模组(G2)动物踝关节周围组织,可见皮下混合炎细胞浸润,关节滑膜炎和/或血管翳形成(c),关节软骨破坏,关节腔消失,部分骨组织融合(b)。与G2造模组相比,治疗组虽然有部分踝关节周围皮下组织水肿和炎细胞浸润(d),但其病理评分均值明显低于G2组,甲氨喋呤对动物关节炎病变具有治疗作用。03B-hIL6/hIL6R小鼠关节炎模型用于评价抗人IL6抗体sirukumab药效 临床评分抗人IL-6抗体sirukumab(内部合成)在小鼠关节炎模型中药效作用。(A)小鼠体重变化;(B)临床评分。结果显示:在模型成功建立后,治疗组(G3,G4)小鼠用sirukumab抗体进行治疗,显示出治疗作用,且表现出剂量依赖性。 病理分析抗人IL-6抗体sirukumab(内部合成)在小鼠关节炎模型中药效作用的病理分析。(A)病理切片H&E染色;(B)病理评分。结果显示:未造模组(G1)动物未见明显异常改变,踝关节软骨表面光滑,关节腔明显。造模组(G2)动物踝关节骨组织损伤(d),关节腔或关节周围腔隙消失(e),并出现血管翳(a)。与造模组相比,抗体药治疗低剂量组(G3)有部分炎细胞浸润(b)和血管翳(a)生成,并表现出滑膜增生(c)。但在抗体药治疗高剂量组(G4),仅有部分血管翳,关节炎病变基本消失,关节腔明显,提示sirukumab对小鼠关节炎具有治疗作用。04服务项目更多药效相关服务,CAIA引起的关节炎模型,骨关节炎模型,骨质疏松模型,正在研究进行中,感兴趣的欢迎联系我们获取资料。想要获取更多百奥动物自主研发的自身免疫性疾病模型信息,请访问百奥动物官网。参考文献:1. Tateiwa, D., Yoshikawa, H. & Kaito, T. Cartilage and Bone Destruction in Arthritis: Pathogenesis and Treatment Strategy: A Literature Review. Cells 8, doi:10.3390/cells8080818 (2019).2. McInnes IB, et al. Cytokines in the pathogenesis of rheumatoid arthritis. Nat Rev Immunol 7, 429-42 (2007).

经历新冠近四年,疫情仍然以星星之火的态势影响着国内外。近两年来,全球研发企业与投资机构的目标几乎都投向了承担着“事前预防”角色的疫苗企业,但此刻亦有许多医药巨头正在悄然行动,在“事后补救”的抗纤维化赛道上积极布局。其中不乏 Boehringer Ingelheim、Genentech、BMS、Roche(Promedior)这些国际大厂,也有 FibroGen、Pliant Therapeutics、Galecto、Blade Therapeutics 等生物技术公司[1]。医药巨头的关注无疑是对领域未来机会的认可。目前,全球仅上市吡非尼酮(抑制TGF-β1的生成和减少血管因子的合成)和尼达尼布(血管生成因子抑制剂)两款药物,但两款药物因其安全性不佳,并且药效有限,仅仅可以延缓病人的纤维化进展,靶点和机理等药理学内容模糊。因此,以 Pfizer 和 Gilead 为代表的跨国制药巨头,已逐渐将新药开发战略重心转移至抗纤维化药物领域中,以满足巨大的市场需求。不是癌症的癌症--纤维化纤维化(Fibrosis)其实是多种类型组织损伤尤其是在慢性炎症性疾病过程中,组织修复反应失调的结局。纤维化几乎发生在所有器官和组织中,例如心、肝、肺、肾、皮肤等,长期以来,人们一直认为纤维化不可逆,但临床前模型和临床试验均表明,它是一个高度动态变化的过程。当组织受到损伤时,多种来源的肌成纤维细胞可通过重塑细胞外环境来启动伤口愈合反应,以恢复组织完整性并促进实质细胞的替换。通常,当组织愈合时,这个促纤维化程序被关闭。然而,持续的损伤和损害会导致这一过程的失调,导致细胞外基质(ECM )蛋白在病理上的过度沉积,并伴随着肌成纤维细胞活性的上调,造成巨噬细胞和免疫细胞浸润的慢性炎症环境。在这种细胞环境中,细胞因子和生长因子被大量释放,包括转化生长因子-β(TGF-β)家族成员和 Wingless/Int-1(Wnt1),它们是纤维化过程的主要效应子。TGF-β 和 Wnt1 结合其干细胞表面受体,并发起下游信号转导,最终分别导致 Smad2/3 和 CBP/β-Catenin 转录调节物的核易位。这导致靶基因表达上调,其功能进一步增强肌成纤维细胞分化和 ECM 蛋白(包括胶原、层粘连蛋白和纤维连接蛋白)的产生和分泌。随着过多 ECM 沉积的进行,基体的结构发生变化并变硬。细胞通过细胞表面整合素受体(激活 Hippo 信号转导通路及其主要下游效应子 YAP 和 TAZ)的机械传导感受 ECM 张力。在另一个前向循环中,激活的 YAP 和 TAZ 转位到胞核,促进包括 CTGF 和 PDGF 在内的促生长基因的上调,这些基因通过 PI3K/AKT/mTOR 通路促进肌成纤维细胞的增殖和活化。纤维化损伤过程[2]常见的与纤维化有关的疾病有:特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)、肝硬化、慢性肾病、心肌梗死、心力衰竭以及非酒精性脂肪肝炎(NASH)等。纤维化还影响肿瘤侵袭和转移、慢性移植物排斥和许多进行性肌病的发病机制。除器官损伤外,纤维化还与癌症进展有关,因为纤维化 ECM 可刺激细胞增殖并改变细胞极性,从而促进肿瘤发育和生长。抗纤维化的应用领域广泛且机制具有一定的共性,因此专注于抗纤维化药企的平台技术具有通用性,目前各家企业的重心一般集中于抗肺纤维化、肝纤维化、肾纤维化、心血管纤维化以及皮肤、视网膜纤维化等领域,其中,领先企业往往先从IPF以及肝纤维化开始,然后进行延展。由于体外药效无法模拟真实体内纤维化环境,抗纤维化药物筛选只能使用漫长的体内试验来进行,几乎所有的新药筛选捷径,包括人工智能,都无法加快抗纤维化药物的研发进程。因此,临床前动物模型在药物研发过程中显得尤为重要,百奥动物自主研发了相应的肝纤维化和肺纤维化模型,为该领域临床前药效评价提供了稳定有效的工具,助力抗纤维化药物研究。肝纤维化模型四氯化碳(CCl4)诱导的肝纤维化四氯化碳(CCl4)诱导的小鼠肝纤维化是被广泛接受的研究肝纤维化实验模型。它在许多方面反映了与毒性损伤相关的人类疾病模式,如α-SMA表达、星状细胞活化和关键基质成分(包括胶原蛋白-1、基质金属蛋白酶及其抑制剂TIMPs)已在该模型的发病机制中得到证实。CCl4诱导肝纤维化模型的建立及组织学评价四氯化碳 (CCl4) 诱导的肝纤维化模型。8周龄雄性 C57BL/6 小鼠腹腔注射浓度为0.25、0.5和0.75 mL/kg的CCl4,每周2次。4、6和8周后小鼠的体重、肝重/体重和血液生化数据如上图。使用CCl4 诱导6周的肝纤维化模型。(A) H&E染色的代表性图片显示 CCl4 诱导后肝脏炎症增加。比例尺:50 μm。(B) 免疫组化的代表性图片,显示肝巨噬细胞(kupffer cells)标记物F480。(C-D) 天狼星红染色的代表性图片,显示肝纤维化增加。比例尺:200 μm。(E-F) 免疫组织化学的代表性图片显示肝脏中的成纤维细胞标志物α-SMA水平。比例尺:300 μm。 奥贝胆酸(OCA)在小鼠肝纤维化模型中的药效验证奥贝胆酸(OCA)治疗后肝纤维化减轻。(A) 图为经CCl4 诱导和 OCA 处理3周后,天狼星红染色显示肝纤维化的代表性图片。(B) 图表示天狼星红染色统计数据。数值为平均值±SEM。*p < 0.05。胆管结扎诱导的肝纤维化胆管结扎引起肝外胆道梗阻,从而导致胆管扩张和胆汁淤积。当胆管内压力进一步升高时,肝内胆管扩张破裂,肝内血管被扩张的胆管和外渗的胆汁同时压迫,肝细胞缺血坏死,纤维组织增生,围绕肝小叶向肝细胞周围扩散,最终可导致肝纤维化。胆管结扎诱导肝纤维化模型的建立胆管结扎肝纤维化模型。(A) 图表示血清中ALT、AST、ALP、GGT和TBIL水平。 (B) 图表示BDL后4周肝脏代表性外观。数值为平均值±SEM。*p<0.05, ***p<0.001, ****p<0.0001。胆管结扎所致肝纤维化模型的组织学评价胆管结扎4周后H&E和天狼星红染色。(A) 图表示H&E染色代表性病理改变。(B) 图天狼星红染色代表性图片显示肝纤维化增加。(C) 图表示胶原纤维阳性信号区比例。数值为平均值±SEM。* p < 0.05。胆管结扎4周后免疫组化染色。 (A-B) 免疫组化染色的代表性图像显示 F4/80 和阳性信号区比例。(C-D) 免疫组化染色代表性图像显示α-SMA水平和阳性信号区比例。硫代乙酰胺(TAA)诱导的肝纤维化模型硫代乙酰胺 (TAA) 是一种广泛用于模拟肝纤维化发病机制中产生损伤的化合物。TAA 通过其代谢产物硫代乙酰胺二氧化硫 (TASO2) 增加活性氧 (ROS) 的形成,引起严重的氧化应激以及脂质过氧化和蛋白质羰基和 DNA 加合物的生成。产生的ROS,引起肝星状细胞 (HSC) 活化,同时诱导造血干细胞转分化为肌纤维母细胞样细胞,导致 EMC 合成和降解失衡及持续纤维化过程。TAA诱导肝纤维化模型的建立及组织学评价TAA 诱导肝纤维化模型4周。(A-B) 血清中 ALT 和 AST 水平。(C) H&E染色的代表性图片。(D-E) 免疫组化染色的代表性图像显示α-SMA水平和阳性信号区比例。(G-F) 天狼星红染色的代表性图像显示肝纤维化增加。TAA 诱导肝纤维化模型6周。(A-B) 血清中 ALT 和 AST 水平。(C) H&E染色的代表性图片。(D-E) 免疫组化染色代表性图像显示α-SMA水平和阳性信号区比例。(F-G) 天狼星红染色的代表性图片,显示肝纤维化增加。肺纤维化模型博来霉素(BLM)诱导的肺纤维化小鼠模型博来霉素 (BLM) 能够引起与接受化疗患者相似的组织学肺模式,是目前诱导动物肺纤维化应用最广泛的药物之一。BLM 通过裂解DNA、诱导炎症反应和增加上皮凋亡剂量发挥其细胞毒性作用,从而刺激肺损伤并导致纤维化。 肺纤维化小鼠模型的建立及组织学评价博来霉素诱导的肺纤维化。C57BL/6J 小鼠在第0天给予博来霉素,每天记录体重,实验结束时收集肺组织,测定肺内羟脯氨酸 (HYP)。 (A) 博来霉素导致体重减轻。 (B)存活率缩短。 (C) HYP 含量增加。 (D) 病理学检查显示显著肺纤维化。 Pamrevlumab 在肺纤维化模型(B-hCCN2小鼠)中的药效验证Pamrevlumab 对博来霉素诱导的体重减轻的影响。B-hCCN2 小鼠在第0天给予博来霉素,然后每两天注射一次 Pamrevlumab 或溶剂,共7次,每天记录体重。实验结果表明,Pamrevlumab治疗能够改善博来霉素诱导的 B-hCCN2 小鼠体重减轻,并可有效降低博来霉素诱导的死亡率。Pamrevlumab 对博来霉素诱导的肺纤维化的影响。 (A) 博来霉素诱导 HYP 含量增加,Pamrevlumab 治疗降低了肺中 HYP 含量。(B) Masson 染色和H&E染色的代表性图像。(C) 条形图显示了纤维化严重程度的定量平均评分。数值为平均值±SEM,n = 4-8,单因素 ANOVA 和 Dunnett 检验,***P < 0.001,**P < 0.01。Micro-CT在肺部疾病模型的研究应用博来霉素诱导肺纤维化模型—直方图、体积根据不同HU区间进行正常、低通气、不通气区域体积的分割。在第4周,结果显示低通气和不通气区域的比例都很高,然后在第10周和第16周之间明显减少,而在正常通气的区域,则呈现相反的趋势[3]。通过使用Micro-CT对小鼠肺部区域进行扫描重建成像,利用肺部分析算法(Hounsfield单位阈值范围分别为-434至-121HU和-120至121HU)实现对通气不良和非通气不良区域的影像区分,从而实现对肺部区域动态检测,并进行功能和结构的评价。量化的影像数据也能提供纵向研究的信息以减少动物之间的变异性,可以更进一步验证体外数据。百奥动物可以提供的模型及检测指标令人期待的未来突破勃林格殷格翰作为肺纤维化治疗领域的全球市场领导者,在这个存在高度未满足医疗需求的领域成功而大胆迈出的第一步是前文所说的尼达尼布(BI BF1120),而今年2月BI 1015550也已经被美国食品药品监督管理局(FDA)授予突破性治疗认定。勃林格殷格翰未来将启动一项III期临床试验,以进一步研究BI 1015550治疗IPF和进行性肺纤维化(PPF)患者的疗效,并希望能尽快让该药物惠及全球患者[4]。Pliant Therapeutics,Inc.是一家临床阶段的生物制药公司,致力于发现和开发用于治疗纤维化的新型疗法。今年7月,Pliant Therapeutics 也公布了其INTEGRIS-IPF IIa期试验积极结果,其药品PLN-74809在患有特发性肺纤维化(IPF)患者身上达到主要与次要终点,呈现剂量相关疗效,并具有良好的耐受性。2021年2月,北京泰德制药与美国Graviton Bioscience Corporation 签订治疗纤维化创新药TDI01海外授权合作协议,首付款及研发、销售里程碑付款最高可达 5.175亿美元。近年来,随着企业临床及各方面的不断推进、纤维化的细胞和分子机制不断被阐明,且新冠疫情后人们对于抗纤维化重视加深,叠加肿瘤赛道的逐渐拥挤,抗纤维化治疗领域被开发的价值不断体现。我们也期待早日拥有更多创新药物用于改善病患生活质量。参考来源:[1] https://mp.weixin.qq.com/s/L8QVMXsh_8-Kk1-iKbeQVA[2] Nie X , Qian L , Sun R , et al. Multi-organ proteomic landscape of COVID-19 autopsies - ScienceDirect[J]. Cell, 2021.[3] Song Shengren,Fu Zhenli,Guan Ruijuan et al. Intracellular hydroxyproline imprinting following resolution of bleomycin-induced pulmonary fibrosis.[J] .Eur Respir J, 2022.[4] https://mp.weixin.qq.com/s/EwbXZN77rPwapjFYdRexVQ