
山东博创医药技术有限公司地址:济南高新综合保税区港兴一路592号东楼济南市春兰路银丰国际生物城B13商务合作:李女士15554135505、18375417530(微信同号) 山东博创医药技术有限公司成立于2020年9月,公司专业的技术团队采用现代医药学理论和高新技术开展多学科综合性研究,专业从事新药研发、仿制研发、天然药物开发、原料备案、药品一致性评价及新药临床监督等技术服务,致力于成为集研发、生产、销售为一体的多元化高新技术企业。 现有研发人员近50人,部门负责人全部具有12年+从业经验,3年以上研发人员,占80%以上,团队稳定。公司目前已经建立了完善的研发管理体系;现行文件为02版,研发管理合计228个文件;目前正在准备B证申请文件,体系将进一步提升,达到GMP要求。可开发剂型:原料、片剂、与二甲双胍复方片剂。工艺研发进度:原料药有成熟生产工艺(批量50kg),无特殊反应条件,三废易于处理,生产成本及产品质量均有明显优势。单方及复方片剂均经过中试规模以上生产(批量10万),制剂工艺稳定、可放大。自研制剂体外溶出(片剂)、杂质谱均能与原研制剂保持一致,质量与原研制剂等同。原料和制剂分别有登记及按4类申报的经验,复方片剂国内首家通过BE。服务内容:保证工艺成熟稳定,包过BE。

可开发剂型: 原料、片剂。申报类型:4类工艺研发进度: 原料和制剂已有多次中试经验,可包过BE。服务内容: 原料和制药药学研究及临床试验。 一、品种概况(片剂说明书)【化学成份】 1-(4-甲氧基苯基)-7-氧代-6[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1H-吡唑[3,4-c]吡啶-3-甲酰胺【化学结构式】: 【分子式】:C25H25N5O4【分子量】:459.50 [2] 【性状】本品为黄色薄膜衣片,除去包衣后,显白色至类白色 [2] 【适应症】用于髋关节或膝关节择期置换术的成年患者,预防静脉血栓栓塞事件(VTE) 【用法用量】本品推荐剂量为每次2.5mg,每日两次口服,以水送服,不受进餐影响。首次服药时间应在手术后12~24小时之间。在这个时间窗里决定服药具体时间时,医生需同时考虑早期抗凝预防VTE的潜在益处和手术后出血的风险。对于接受髋关节置换术的患者:推荐疗程为32到38天对于接受膝关节置换术的患者:推荐疗程为10到14天如果发生一次漏服,患者应立即服用本品,随后继续每日服药两次。由注射用抗凝药转换为本品治疗时,可从下次给药时间点开始。【不良反应】在一项II期临床试验和三项III期临床试验中评价了阿哌沙班的安全性,这些试验中共有5924例接受下肢骨科大手术(择期髋关节置换术或膝关节置换术)的患者,服用阿哌沙班2.5mg,每日三次,最长接受38天的治疗。接受每日两次阿哌沙班2.5mg治疗的患者中,共计有11%发生了不良反应。与其他抗凝药物一样,当存在相关的危险因素,如易导致出血的器官损伤时,阿哌沙班治疗过程中可能才出现出血。常见的不良反应包括贫血,出血,挫伤及恶心。应结合手术背景对不良反应作出解释。与其他抗凝药物药物一样,阿哌沙班可能会引起一些组织或器官隐性或显性出血风险升高,从而可能导致出血后贫血。由于出血部位、程度或范围不同,出血的体征、症状和严重程度将有所差异。择期髋关节或膝关节置换术患者治疗过程中出现的不良反应 【禁忌】 对活性成份或片剂中任何辅料过敏;有临床明显活动性出血;伴有凝血异常和临床相关出血风险的肝病(参考【药代动力学】) [2] 【注意事项】出血风险 与其他的抗凝药物一样,对服用阿哌沙班的患者,要严密监测出血征象。阿哌沙班应慎用于伴有以下出血风险的患者:先天性或获得性出血疾病;活动性胃肠道溃疡疾病;细菌性心内膜炎;血小板减少症;血小板功能异常;有出血性卒中病史;未控制的重度高血压;近期接受脑、脊柱或眼科手术。如果发生严重出血,应停用阿哌沙班。肾损害 轻度或中度肾损害患者无需调整剂量。在重度肾损害(肌酐清除率为15-29ml/min)患者中的有限临床数据表明,该患者人群的阿哌沙班血浆浓度升高,由于可能增加出血风险,阿哌沙班单独或联合乙酰水杨酸用于这些患者时应谨慎。由于尚无肌酐清除率<15ml/min的患者或透析患者的临床资料,因此不推荐这些患者服用阿哌沙班。老年患者 阿哌沙班与乙酰水杨酸联合用于老年患者的临床经验有限。因可能增加出血风险,老年患者联合服用这两种药应谨慎。肝损害 阿哌沙班禁用于伴有凝血异常和临床相关出血风险的肝病患者。不推荐重度肝损害的患者服用阿哌沙班。对于轻度及中度肝损害的患者(Child Pugh A或B级),应当谨慎服用阿哌沙班。由于肝酶升高ALT/AST>2*ULN或总胆红素升高≥1.5*ULN的患者未入选临床试验,因此,阿哌沙班用于这些人群时应谨慎,术前应常规检测ALT。髋骨骨折手术 目前尚无临床试验评价接受髋骨骨折手术患者服用阿哌沙班的有效性及安全性,因此,不推荐这些患者服用阿哌沙班。【辅料信息】本品中含有乳糖。有罕见的遗传性半乳糖不耐受、Lapp乳糖酶缺乏症或葡萄糖-半乳糖吸收不良的患者,不应服用本品。对驾驶及机械操作能力的影响阿哌沙班对驾驶及机械操作能力无影响或该影响可以忽略。 【药理毒理】是一种口服的选择性活化Ⅹ因子抑制剂,能预防血栓,但出血的不良反应低于老药华法林,用于接受过臀部或膝部置换手术患者的血栓预防。 [2] 【孕妇及哺乳期妇女用药】妊娠 动物研究未发现本品有直接或间接的生殖毒性。目前尚无妊娠期妇女应用阿哌沙班的资料,妊娠期间不推荐应用阿哌沙班。哺乳期妇女 尚不清楚阿哌沙班或其代谢产物是否进入人乳。现有的动物实验数据显示阿哌沙班能进入母乳。在大鼠乳汁中,发现乳汁-母体血浆药物浓度比很高(Cmax约为8,AUC约为30),可能是因为药物向乳汁中主动转运。对新生儿及婴儿的风险不能排除。必须决定究竟是停止母乳喂养还是停止/避免阿哌沙班治疗。 【儿童用药】目前尚无在18岁以下患者中使用阿哌沙班的安全性和有效性方面的数据。 【老年患者用药】无需调整剂量 【药物过量】尚无针对阿哌沙班的任何解毒剂。阿哌沙班过量可能导致出血风险升高。当出现出血并发症时,应立即停药,并查明出血原因。应考虑采取恰当的治疗措施,如外科手术止血、输入新鲜冰冻血浆等。在一项对照临床试验中,健康志愿者口服高达50mg阿哌沙班3到7天(25mg,每日两次,服用7天或50mg,每日一次,服用3天)[相当于人每日最大推荐剂量的10倍],未出现有临床意义的不良反应。一项用犬进行的临床前试验发现:阿哌沙班给药后3小时内口服活性炭可以降低阿哌沙班的暴露量;因此,在处理阿哌沙班过量时可以考虑使用活性炭。如果采用上述治疗措施无法控制危及生命的出血,可以考虑给予重组凝血因子VIIa。然而,目前尚无将重组因子VIIa用于服用阿哌沙班患者的经验。可以考虑重组凝血因子VIIa重复给药,并根据出血改善情况调整剂量。 [2] 【临床试验】阿哌沙班临床研究项目旨在证明接受择期髋或膝关节置换术的成年患者服用阿哌沙班预防静脉血栓栓塞的有效性及安全性。共有8464例患者随机分配到两个关键性双盲、国际多中心试验中,比较阿哌沙班2.5mg每日两次(4236例患者)和伊诺肝素40mg每日一次(4228例患者)的治疗方案。其中有1262例年龄在75岁以上患者(阿哌沙班组618例),1004例低体重(≤60kg)患者(阿哌沙班组499例),1495例BMI指数≥33kg/m(阿哌沙班组743例)患者及415例中度肾损害患者(阿哌沙班组203例)。在ADVANCE-3试验中,共入组5407例接受择期髋关节置换术的患者,在ADVANCE-2试验中,共入组3057例接受择期膝关节置换术的患者。受试者口服阿哌沙班2.5mg,每日两次,或皮下注射伊诺肝素40mg,每日一次。阿哌沙班首次给药时间在术后12到24小时间,伊诺肝素则在术前9到15小时开始全身给药。阿哌沙班及伊诺肝素的给药时间在ADVANCE-3试验均为32~38天,在 ADVANCE-2试验均为10~14天。根据ADVANCE-3和ADVANCE-2研究人群中患者的病史(8464例患者),46%患有高血压,10%患有高脂血症,9%患有糖尿病,8%患有冠心病。与伊诺肝素比较,在接受择期髋关节置换术或膝关节置换术患者中,阿哌沙班显著减少主要终点-所有VTE/全因死亡复合终点的发生率,以及重大的VTE终点事件-近端深静脉血栓(DVT),非致死性肺栓塞(PE)及VTE相关死亡的复合终点的发生率,统计学上具有优效性。服用阿哌沙班2.5mg每日两次的患者与伊诺肝素40mg每日一次相比,安全性终点一大出血事件、大出血和有临床意义的非大(CRNM)出血的复合终点及所有出血事件的发生率相当。所有的出血标准中均包括手术部位出血。在ADVANCE-2试验中,中国6个研究中心共180名患者被随机分入双盲研究药物治疗(每治疗组各90名)。在 ADVANCE-3试验中,中国7个研究中心共245名患者被随机分入双盲研究药物治疗(阿哌沙班组121名;伊诺肝素组124名)。中国受试者中,阿哌沙班的总体有效性特点与研究总体结果一致。在中国亚组中,观察到的阿哌沙班2.5mg BID治疗组终点事件少于伊诺肝素40mg QD治疗组。中国受试者中,阿哌沙班的总体安全性特征与全球研究中的安全性特征一致。阿哌沙班在中国受试者中是最安全的,并且耐受良好,整个试验过程中报告的出血事件很少(见表5)。此外,中国受试者中的总体不良反应事件率更低,没有中国受试者死亡。在择期髋关节和膝关节置换手术的患者中实施的II期和III期研究中,阿哌沙班组患者的出血、贫血和转氨酶异常(如丙氨酸氨基转移酶水平)等不良事件的总发生率在数字上少于伊诺肝素组。在膝关节置换手术研究中,意向治疗期间阿哌沙班组有4例发生PE,伊诺肝素组无PE发生,原因不明。中国亚组研究中,两组均无PE发生。 [2] 【药理毒理】药理作用 阿哌沙班是一种强效、口服有效的可逆、直接、高选择性的Xa因子活性位点抑制剂,其抗血栓活性不依赖抗凝血酶III。阿哌沙班可以抑制游离及与血栓结合的Xa因子,并抑制凝血酶原活性。阿哌沙班对血小板聚集无直接影响,但间接抑制凝血酶诱导的血小板聚集。通过对Xa因子的抑制,阿哌沙班抑制凝血酶的产生,并抑制血栓形成。在动物模型中进行的临床前试验结果显示,阿哌沙班在不影响止血功能的剂量水平下,具有抗栓作用,可预防动脉及静脉血栓。毒理研究遗传毒性:阿哌沙班Ames试验、中国仓鼠卵巢细胞染色体畸变试验、大鼠骨髓微核试验结果均为阴性。生殖毒性:大鼠生育力及早期胚胎发育毒性试验结果显示,阿哌沙班给药剂量达600mg/kg,母体毒性可见对凝血参数值的影响,未见对母体生育力的明显影响,未见对子代生长发育的明显影响;妊娠大鼠和妊娠家兔分别经口给予阿哌沙班达3000mg/kg/天和1500mg/kg/天,未见药物相关的子代生长发育的明显异常;大鼠围产期生殖毒性试验结果显示,对母体生殖功能影响的NOAEL为1000mg/kg/天,对子代生长发育影响的NOAEL未25mg/kg/天。致癌性:小鼠和大鼠经口给予阿哌沙班104周致癌性试验,雄性和雌性小鼠给药剂量分别达1500mg/kg/天和3000mg/kg/天,未见与给药剂量相关的肿瘤发生率增加。大鼠经口给予阿哌沙班剂量达600mg/kg/天,未见与药物相关的肿瘤发生率增加。 [2] 【药代动力学】吸收 在10mg剂量范围内,阿哌沙班的绝对生物利用度约为50%。阿哌沙班吸收迅速,服用后3~4小时达到最大浓度(Cmax),进食对阿哌沙班10mg的AUC或Cmax无影响。阿哌沙班可以在进餐时或非进餐时服用。在10mg剂量范围内,阿哌沙班呈线性药代动力学特征,具有剂量依赖性。当阿哌沙班剂量≥25mg时,显示为溶出限制性吸收,生物利用度下降。阿哌沙班的暴露参数表现为低至中度变异,其个体内变异系数(CV)约为20%,个体间约为30%。分布 在人体内,与血浆蛋白结合率约为87%。分布容积(Vss)约为21升。代谢 阿哌沙班生物转化的主要位点是3-哌啶酮基的o-脱甲基或羟基化。阿哌沙班主要通过CYP3A4/5代谢,很少部分通过CYP1A2,2C8,2C9,2C19及2J2代谢。原型阿哌沙班是人血浆中的主要药物相关成分,未发现具有活性的循环代谢产物。阿哌沙班是转运蛋白P-gp及乳腺癌耐药蛋白(BCRP)的底物。排泄 阿哌沙班可通过多种途径清除。人体给予阿哌沙班后,约25%以代谢产物形成出现,绝大多数在粪便检出。肾脏的排泄量约占总清除率的27%。此外,临床试验还发现额外的胆汁排泄,非临床试验发现额外的直接肠道排泄。阿哌沙班的总清除率约为3.3L/h,半衰期约为未12小时。特殊人群肾损害 肾损害对阿哌沙班的最大血浆浓度无影响。阿哌沙班暴露量随肾功能(以肌酐清除率评估)的下降而增加。与肌酐清除率正常者相比,肾轻度损害(肌酐清除率51-80ml/mim)、中度损害(肌酐清除率30-50ml/mim)及重度损害(肌酐清除率15-29ml/mim)患者的阿哌沙班血浆浓度曲线下面积(AUC)分别升高16%、29%及44%。肾损害对阿哌沙班血浆浓度与抗FXa活性的关系无明显影响。肝损害 在一项比较轻度肝损害(Child Pugh A级,其中评分5分6例,评分6分2例)和中度肝损害患者(Child Pugh B级,其中评分7分6例,评分8分2例)和健康受试者(16例)的研究中,单词给予阿哌沙班5mg后,肝损害患者阿哌沙班的药代动力学及药效学无变化,轻度或中度肝损害患者抗FXa活性及INR的变化与健康受试者相当。老年患者 老年患者(大于65岁)的血浆浓度比年轻患者高,平均AUC大约升高32%。性别 女性的阿哌沙班暴露量约比男性高18%,无需调整剂量。人种及种族 I期临床试验的结果显示,在白种/高加索人、亚洲人和黑人/非洲裔美国人之间,阿哌沙班的药代动力学无明显差异。对接受择期髋关节或膝关节置换术后服用阿哌沙班的患者进行群体药代动力学分析,结果与上述I期试验结论一致。体重 与体重在65kg~85kg的患者相比,体重>120kg者阿哌沙班暴露量约降低30%,体重<50kg者,暴露量升高约30%,无需调整剂量。药代动力学/药效学关系已对阿哌沙班血药浓度与几个药效学终点(抗Xa因子活性、INR、PT、aPTT)之间的药代动力学/药效学(PK/PD)关系进行了评价,阿哌沙班的给药剂量范围为0.5mg~50mg。阿哌沙班浓度与Xa因子活性之间的关系最符合线性模型。接受择期髋或膝关节置换术的患者中的PK/PD关系,与健康受试者中结果一致。【贮藏】30℃以下保存【包装】Alu-PVC/PVDC水泡眼包装,盒装,10片/盒,14片/盒,20片/盒,60片/盒.【有效期】 36个月 二、市场情况2007年,百时美施贵宝与辉瑞正式执行全球战略性合作协议,联合开发并销售抗凝血产品阿哌沙班;2011年,在欧盟27国及冰岛、挪威,率先批准用于择期髋关节或膝关节置换手术成人患者静脉血栓症的预防;2013年1月,获得中国国家食品药品监督管理局颁发的进口药品许可证,用于髋关节或膝关节择期置换术的成年患者,预防静脉血栓栓塞事件(VTE),然后于2013年4月正式在中国上市。阿哌沙班是新型口服抗凝药物,是一种新型口服Xa因子抑制剂,是一种用于预防和治疗血栓的药品。推荐剂量为2.5mg,每日口服两次,有效预防静脉血栓栓塞症同时并不增加出血风险,无需常规监测凝血功能,亦无需剂量调整。基于阿哌沙班突出的产品优势,阿哌沙班在新一代口服抗凝剂中地位愈发突出。近五年,其全球销售额快速上涨,2015年突破10亿美元关口,2017年全球销售额达74.0亿美元。虽然阿哌沙班在国外势不可挡,但由于在国内由于缺乏渠道优势,2016年阿哌沙班在中国市场销售额仅为0.61亿元。2017年样本医院抗凝药物销售占比前五的分别是利伐沙班、低分子肝素钙、依诺肝素、那曲肝素和低分子肝素钠。 三、国内已上市产品信息经检索国家药监局数据库,现已有16家国内药企获得本品种生产批件,规格均为2.5mg。另有4个施贵宝不同规格进口批准上市信息。"国产药品" "阿哌沙班" 的内容列表 , 共有 16 条记录1.阿哌沙班片 (齐鲁制药(海南)有限公司 国药准字H20203340)2.阿哌沙班片 (湖南千金湘江药业股份有限公司 国药准字H20213271)3.阿哌沙班片 (浙江海正药业股份有限公司 国药准字H20213173)4.阿哌沙班片 (江西青峰药业有限公司 国药准字H20203204)5.阿哌沙班片 (江苏嘉逸医药有限公司 国药准字H20203434)6.阿哌沙班片 (江苏云阳集团药业有限公司 国药准字H20213468)7.阿哌沙班片 (江苏万邦生化医药集团有限责任公司 国药准字H20213062)8.阿哌沙班片 (正大天晴药业集团股份有限公司 国药准字H20193134)9.阿哌沙班片 (成都倍特药业股份有限公司 国药准字H20203602)10.阿哌沙班片 (广东东阳光药业有限公司 国药准字H20213064)11.阿哌沙班片 (常州恒邦药业有限公司 国药准字H20193003)12.阿哌沙班片 (四川科伦药业股份有限公司 国药准字H20193301)13.阿哌沙班片 (南京海辰药业股份有限公司 国药准字H20213556)14.阿哌沙班片 (南京正科医药股份有限公司 国药准字H20213768)15.阿哌沙班片 (南京正大天晴制药有限公司 国药准字H20203336)16.阿哌沙班片 (保定天浩制药有限公司 国药准字H20213757) 2.5mg "进口药品" "阿哌沙班" 的内容列表 , 共有 4 条记录1.阿哌沙班片 (H20170237 86979559000031 Bristol-Myers Squibb / Pfizer EEIG )施贵宝 艾乐妥 2.5mg 192000片/桶2.阿哌沙班片 (H20170235 86979559000017 Bristol-Myers Squibb / Pfizer EEIG )施贵宝 艾乐妥 2.5mg 10片/盒;14片/盒3.阿哌沙班片 (H20170236 86979559000055 Bristol-Myers Squibb / Pfizer EEIG )施贵宝 艾乐妥 2.5mg 20片/盒,60片/盒4.阿哌沙班片 (国药准字J20171044 86900842000513 Bristol-Myers Squibb / Pfizer EEIG )施贵宝 艾乐妥 2.5mg 10片/盒,14片/盒,20片/盒,60片/盒 四、申报记录经检索国家药监局审评中心,已有多家国内公司均已完成临床,生产申请记录,现整理2018年后所有受理记录如下: 序号受理号药品名称申请类型注册分类企业名称承办日期1CYHS2101769阿哌沙班片仿制4迪沙药业集团有限公司;迪沙药业集团有限公司;2021-09-262CXHL2101277阿哌沙班多释片新药2.2泰州越洋医药开发有限公司;2021-07-093CYHS2101308阿哌沙班片仿制4合肥英太制药有限公司;合肥英太制药有限公司;2021-06-174CYHS2101121阿哌沙班片仿制4上海理想制药有限公司;上海理想制药有限公司;2021-04-305CYHS2100243阿哌沙班片仿制4深圳九瑞健康科技开发有限公司;天津汉瑞药业有限公司;2021-02-276CYHB2100173阿哌沙班片补充申请原6常州恒邦药业有限公司;常州恒邦药业有限公司;2021-01-257CYHS2000967阿哌沙班片仿制4浙江诺得药业有限公司;浙江诺得药业有限公司;2021-01-018CYHS2000951阿哌沙班片仿制4常州制药厂有限公司;常州制药厂有限公司;2020-12-299JYHB2002543阿哌沙班片补充申请Bristol-Myers Squibb / Pfizer EEIG;Bristol-Myers Squibb Manufacturing Company;2020-12-1010JYHB2002544阿哌沙班片补充申请Bristol-Myers Squibb / Pfizer EEIG;Bristol-Myers Squibb Manufacturing Company;2020-12-1011CYHS2000859阿哌沙班片仿制3福安药业集团宁波天衡制药有限公司;福安药业集团宁波天衡制药有限公司;2020-12-0912CYHS2000850阿哌沙班片仿制4福安药业集团宁波天衡制药有限公司;福安药业集团宁波天衡制药有限公司;2020-12-0713CYHS2000820阿哌沙班片仿制4宁波美诺华天康药业有限公司;宁波美诺华天康药业有限公司;2020-11-2814CYHS2000631阿哌沙班片仿制4无锡凯夫制药有限公司;无锡凯夫制药有限公司;2020-09-1915CYHS2000621阿哌沙班片仿制3乐普药业股份有限公司;乐普药业股份有限公司;2020-09-1716CYHS2000620阿哌沙班片仿制4乐普药业股份有限公司;乐普药业股份有限公司;2020-09-1717CYHS2000581阿哌沙班片仿制4浙江华海药业股份有限公司;浙江华海药业股份有限公司;2020-08-2718JYHB2001192阿哌沙班片补充申请Bristol-Myers Squibb / Pfizer EEIG;Bristol-Myers Squibb Manufacturing Company;2020-07-2819JYHB2001193阿哌沙班片补充申请Bristol-Myers Squibb / Pfizer EEIG;Bristol-Myers Squibb Manufacturing Company;2020-07-2820CYHS2000471阿哌沙班片仿制4成都百裕制药股份有限公司;成都百裕制药股份有限公司;2020-07-0721CYHS2000446阿哌沙班片仿制4扬子江药业集团上海海尼药业有限公司;扬子江药业集团上海海尼药业有限公司;2020-07-0422CYHS2000311阿哌沙班片仿制4江西青峰药业有限公司;2020-05-1023CYHS2000174阿哌沙班片仿制4石药集团欧意药业有限公司;石药集团欧意药业有限公司;2020-03-1124CYHS2000138阿哌沙班片仿制4南京海辰药业股份有限公司;南京海辰药业股份有限公司;2020-03-1025CYHS2000139阿哌沙班片仿制4华润双鹤药业股份有限公司;2020-02-2726CYHS1900792阿哌沙班片仿制4江苏云阳集团药业有限公司;南京卡文迪许生物工程技术有限公司;2019-11-2727JYHB1901304阿哌沙班片补充申请Bristol-Myers Squibb / Pfizer EEIG;Bristol-Myers Squibb Manufacturing Company;2019-11-0928JYHB1901305阿哌沙班片补充申请Bristol-Myers Squibb / Pfizer EEIG;Bristol-Myers Squibb Manufacturing Company;2019-11-0229CYHS1900727阿哌沙班片仿制4保定天浩制药有限公司;2019-10-2530CYHS1900730阿哌沙班片仿制4北京百奥药业有限责任公司;北京阳光诺和药物研究股份有限公司;2019-10-2431CYHS1900665阿哌沙班片仿制4南京正科医药股份有限公司;南京正科医药股份有限公司;2019-09-2932CYHS1900650阿哌沙班片仿制4山东朗诺制药有限公司;漳州片仔癀药业股份有限公司;2019-09-2833CYHB1903501阿哌沙班片补充申请南京正大天晴制药有限公司;南京正大天晴制药有限公司;2019-06-2634CYHS1700700阿哌沙班仿制3江苏嘉逸医药有限公司;2019-06-1335CYHS1700701阿哌沙班片仿制4江苏嘉逸医药有限公司;2019-06-1336CYHS1900177阿哌沙班片仿制4浙江海正药业股份有限公司;浙江海正药业股份有限公司;2019-03-1137CYHS1900068阿哌沙班片仿制4湖南千金湘江药业股份有限公司;2019-02-0138JYHB1801431阿哌沙班片补充申请Bristol-Myers Squibb / Pfizer EEIG;Bristol-Myers Squibb Manufacturing Company;2018-12-1739JYHB1801432阿哌沙班片补充申请Bristol-Myers Squibb / Pfizer EEIG;Bristol-Myers Squibb Manufacturing Company;2018-12-0540CYHS1800407阿哌沙班片仿制3齐鲁制药(海南)有限公司;2018-11-1641CYHS1800405阿哌沙班片仿制4齐鲁制药(海南)有限公司;2018-11-1442CYHS1800329阿哌沙班片仿制4广东东阳光药业有限公司;东莞市阳之康医药有限责任公司;2018-10-3043CYHS1800279阿哌沙班片仿制3成都倍特药业股份有限公司;成都倍特药业股份有限公司;2018-09-2844CYHS1800282阿哌沙班片仿制4上海上药信谊药厂有限公司;2018-09-2145CYHS1800262阿哌沙班片仿制4成都倍特药业股份有限公司;成都倍特药业股份有限公司;2018-09-0346CYHS1700727阿哌沙班片仿制4南京正大天晴制药有限公司;2018-08-2247JYHB1800852阿哌沙班片补充申请Bristol-Myers Squibb / Pfizer EEIG;Bristol-Myers Squibb Manufacturing Company;2018-07-1748JYHB1800853阿哌沙班片补充申请Bristol-Myers Squibb / Pfizer EEIG;Bristol-Myers Squibb Manufacturing Company;2018-07-1749CYHS1800090阿哌沙班片仿制4江苏万邦生化医药集团有限责任公司;2018-05-2550CYHS1700726阿哌沙班仿制3南京正大天晴制药有限公司;2018-05-2351JYHB1800362阿哌沙班片补充申请Bristol-Myers Squibb / Pfizer EEIG;Bristol-Myers Squibb Manufacturing Company;2018-05-0752JYHB1800363阿哌沙班片补充申请Bristol-Myers Squibb / Pfizer EEIG;Bristol-Myers Squibb Manufacturing Company;2018-03-2753CYHS1800008阿哌沙班片仿制4江西青峰药业有限公司;2018-01-19 五、专利查询核心专利情况:本品化合物专利2821537.0有效期至2022-09-16,其他核心专利详见下表: 序号申请号名称申请人申请日期法律状态专利类型102821537.0含有内酰胺的化合物及其衍生物作为Xa因子的抑制剂百时美施贵宝2002-09-17授权2010-11-24化合物2201180011229.X阿哌沙班制剂百时美施贵宝2011-02-24实审制剂专利3201380049617.6阿哌沙班液体制剂百时美-施贵宝2013-09-26授权2020-03-03液体制剂专利42010800362888阿哌沙班的剂型百时美-施贵宝+辉瑞2010-06-15视为撤回制剂专利 六、参比信息 阿哌沙班参比制剂目录:序号药品通用名称英文名称商品名规格持证商备注1备注2信息来源14-7阿哌沙班片Apixaban TabletsEliquis2.5mgBristol-Myers Squibb / Pfizer EEIG原研进口参比制剂目录第十四批22-78阿哌沙班片Apixaban TabletsEliquis5mgBRISTOL MYERS SQUIBB CO PHARMACEUTICAL RESEARCH INSTITUTE未进口原研药品美国橙皮书参比制剂目录第二十二批26-55阿哌沙班片Apixaban TabletsEliquis2.5mgBristol-Myers Squibb Co Pharmaceutical Research Institude未进口原研药品美国橙皮书参比制剂目录第二十六批 七、原料来源本品种原料药市场可购,也可带原料药申报。经查询国家局审评中心数据库,现已有以下公司获得原料药的备案。江苏嘉逸医药有限公司 南通经济技术开发区通旺路29号 A 江苏南京海辰药业股份有限公司 镇江国际化工园新竹路10号 A 江苏南京正大天晴制药有限公司 南京经济技术开发区恒广路99-1号 A 江苏徐州万邦金桥制药有限公司 江苏省徐州市金山桥开发区综合区 A 江苏连云港润众制药有限公司 连云港经济技术开发区大浦工业区 A CYHS1700098江苏豪森药业集团有限公司 江苏省连云港经济技术开发区 A CYHS1600196江苏常州制药厂有限公司 常州市天宁区劳动东路518号 1kg;2kg;3kg;4kg A江苏扬子江药业江苏海慈生物药业有限公司 0.5kg/袋,1.0kg/袋,1.5kg/袋,2.0kg/袋 A浙江海正药业股份有限公司 浙江省台州市椒江区外沙路46号 A 浙江华海药业股份有限公司 临海市汛桥 根据客户要求包装 2019-02-22 A浙江燎原药业股份有限公司 浙江临海园区 2.0kg/袋、2.5kg/袋 A 广东乳源东阳光药业有限公司 广东省韶关市乳源瑶族自治县乳城 A 广东广州安信医药有限公司 广州高新技术产业开发区科学城 A 山东齐鲁制药有限公司;齐鲁制药有限公司 济南市工业北路243号 A 山东新华制药股份有限公司 山东省淄博市张店区湖田镇2.5 kg/桶 A山东朗诺制药有限公司 德州市齐河县 (可根据客户需求进行包装) A四川仁安药业有限责任公司 四川省岳池县九龙镇工业园区 A 四川新开元制药有限公司 简阳市简城镇十里坝工业园区 A CYHS1700090四川成都百裕制药股份有限公司 四川省广安市岳池县 0.5kg/袋 A 河北石药集团欧意药业有限公司 石家庄经济技术开发区扬子路88号 3kg/袋 A河南乐普药业股份有限公司 河南省项城市平安大道东段216号 10kg/桶 A

可开发剂型: 原料、片剂。工艺研发进度: 原料和制剂已有多次中试经验,可包过BE。服务内容: 原料和制药药学研究及临床试验。 一、品种概况(片剂说明书) 【药品名称】通用名称:非布司他片英文名称:FebuxostatTablets汉语拼音:FeiBuSiTaPian【成份】本品主要成份为非布佐司他。化学名:2-[(3-氰基-4-异丁氧基)苯基]-4-甲基-5-噻唑羧酸分子量:C16H16N2O3S【性状】本品为薄膜衣片,除去包衣后显白色或类白色。【适应症】本品为黄嘌呤氧化酶(XO)抑制剂,适用于具有痛风症状的高尿酸血症的长期治疗。【用法用量】起始剂量为20mg,每日一次,大剂量可能导致血尿酸值急速降低反而诱发痛风性关节炎(痛风发作)。患者可在服用20mg非布司他4周后在医生指导下根据血尿酸值逐渐增量,每次增量20mg。最大日剂量为80mg。血尿酸水平达到目标值(小于6mg/dL 或360μmol/L)后,维持最低有效剂量。给药时,无需考虑食物和抗酸剂的影响,详情请遵医嘱。特殊人群老年患者:无需调整剂量。轻、中度肝功能不全患者:无需调整剂量。轻、中度肾功能不全患者:无需调整剂量。慢性肾脏疾病(CKD)4-5期患者:推荐起始剂量为20mg/天,最大剂量40mg/天。儿童:目前尚不确定非布司他对儿童患者的安全性和有效性。如需用药,请在医生指导和成人监护下使用。尿酸水平 在开始非布司他治疗2周后,就可评估血尿酸水平是否达到目标值(小于6mg/dL)。痛风发作 在服用本品的初期,可能会引起痛风的发作,这是因为血尿酸水平的改变导致组织沉积的尿酸盐被动员出来。为预防服用非布司他起始阶段的痛风发作,建议同时服用非甾体抗炎药或秋水仙碱。预防性治疗的获益可长达6个月。在非布司他治疗期间,如果痛风发作,无需中止服药。应根据患者的个体情况,对痛风进行相应治疗。【不良反应】虚弱、胸痛/不适、水肿、疲劳、情绪异常、步态障碍、流行性感冒症状、痞气、疼痛、口渴。以下信息为国外文献报道:1. 临床试验经验由于临床试验是在广泛多样的条件下进行的,所以在临床试验中观察到的某种药物的不良反应发生率不能与临床试验中的另一种药物进行直接比较,也不能反映临床实践中的发生率。在临床研究中,2757例痛风的高尿酸血症患者分别接受每次40mg或80mg,每日一次非布司他的治疗。40mg剂量组中,559例患者治疗期≥6个月。80mg剂量组中,1377例患者治疗期≥6个月,674例患者治疗期≥1年,515例患者治疗期≥2年。常见不良反应三项随机对照临床试验中,在持续6~12个月治疗期内,医生判定与试验药物有关的不良反应如下:表1 非布司他常见不良反应不良反应安慰剂非布司他别嘌醇*(N=134)40mg/d(N=757)80mg/d(N=1279)(N=1277)肝功能异常恶心关节痛皮疹0.7%0.7%0%0.7%6.6%1.1%1.1%0.5%4.6%1.3%0.7%1.6%4.2%0.8%0.7%1.6% 常见不良反应:非布司他治疗组发生率至少为1%,并且高于安慰剂组至少0.5%的不良反应。根据肾功能不全的情况分别给予不同剂量的别嘌醇,其中100mg 10例,200mg 145例,300mg 1122例。导致中止治疗最常见的不良反应是肝功能异常,中止治疗发生率分别为:非布司他40mg组1.8%、80mg组1.2%、别嘌醇组0.9%。除了表1中的不良反应,尽管头晕在非布司他治疗组中发生率超过了1%,但高于安慰剂组不足0.5%。偶见不良反应在II期和III期临床研究中,在给药剂量40~240mg范围内,以下不良反应在受试者中发生率低于1%:血液和淋巴系统:贫血、特发性血小板减少性紫癜、白细胞增多/减少、中性粒细胞减少、全血细胞减少、脾肿大、血小板减少。心脏:心绞痛、心房颤动/心房扑动、心脏杂音、心电图异常、心悸、窦性心动过缓、心动过速。耳和迷路:耳聋、耳鸣、眩晕。眼:视力模糊。胃肠道:腹胀、腹痛、便秘、口干、消化不良、肠胃胀气、大便频繁、胃肠不适、胃炎、胃食管反流病、牙龈痛、咯血、胃酸过多、便血、口腔溃疡、胰腺炎、消化性溃疡、呕吐。全身和给药部位:虚弱、胸痛/胸部不适、水肿、疲劳、感觉异常、步态异常、流行性感冒类症状、肿块、疼痛、口渴。肝胆系统:胆结石/胆囊炎、肝脂肪变性、肝炎、肝肿大。免疫系统:过敏反应。感染:带状疱疹。并发症:挫伤。代谢及营养:厌食、食欲降低/增加、脱水、糖尿病、高胆固醇血症、高血糖、高血脂、高甘油三酯血症、低钾血症、体重减轻/增加。肌肉骨骼和结缔组织:关节炎、关节僵硬、关节肿胀、肌肉痉挛/抽搐/紧张/无力、骨骼痛/僵硬、肌痛。神经系统:味觉异常、平衡异常、脑血管意外、Guillain-Barré综合征、头痛、轻偏瘫、感觉迟钝、嗅觉减退、腔隙性脑梗死、昏睡、精神障碍、偏头痛、感觉异常、嗜睡、短暂性脑缺血发作、震颤。精神疾病:烦躁、焦虑、抑郁、失眠、易怒、性欲减退、神经过敏、急性焦虑症、人格改变。泌尿系统:血尿症、肾结石、尿频、蛋白尿、肾功能衰竭、肾功能不全、尿急、尿失禁。生殖系统和乳房:乳房疼痛、勃起功能障碍、男性乳房发育症。呼吸、胸、纵隔:支气管炎、咳嗽、呼吸困难、鼻衄、鼻腔干燥、鼻窦分泌过多、咽部水肿、呼吸道充血、喷嚏、咽喉发炎、上呼吸道感染。皮肤及皮下组织:脱发、血管性水肿、皮炎、皮肤划痕症、瘀斑、湿疹、毛发颜色改变、毛发生长异常、多汗症、脱皮、瘀点、光过敏、瘙痒症、紫癜、皮肤变色/色素沉着、皮损、皮肤气味异常、荨麻疹。血管:面红、热潮红、高血压、低血压。实验室指标:活化部分凝血活酶时间延长、肌酸升高、碳酸氢盐减少、钠增多、脑电图异常、血糖升高、胆固醇升高、甘油三酯升高、淀粉酶升高、钾增多、促甲状腺激素升高、血小板计数降低、红细胞比容降低、血红蛋白降低、红细胞平均体积增加、红细胞减少、肌酐升高、血尿素升高、血尿素氮/肌酐比值升高、肌酸磷酸激酶增加、碱性磷酸酶升高、乳酸脱氢酶升高、前列腺特异性抗原增加、尿量增多/减少、淋巴细胞计数减少、嗜中性粒细胞计数减少、白细胞升高/降低、凝血试验异常、低密度脂蛋白增高、凝血酶原时间延长、管型尿、尿白细胞阳性、尿蛋白阳性。心血管风险在随机对照及长期扩展性研究中,心血管事件和死亡是APTC(Anti-PlateletTrialists’ Collaborations)预先确定的终点(包括心血管死亡、非致死性心肌梗死、非致死性卒中)之一。在随机对照的III期试验中,APTC事件中,每100例患者-年的发生率分别是:安慰剂组0 (95%CI 0.00-6.16)、非布司他40mg组0(95% CI 0.00-1.08)、非布司他80mg组1.09(95% CI 0.44-2.24)、别嘌醇组0.60(95% CI 0.16-1.53)。在长期扩展性研究中,APTC事件的发生率分别是:非布司他80 mg组0.97(95% CI 0.57-1.56),和别嘌醇组 0.58(95% CI 0.02-3.24)。总之,相比于别嘌醇组,非布司他治疗组具有较高的APTC事件发生率,但与非布司他的因果关系还未确定。服药时应监测心肌梗死和脑卒中的症状和体征。2. 国外产品上市后经验对非布司他上市后药物的使用中,对药品的不良反应进行了鉴别。由于这些不良反应是从未知数量的患者中自发报告的,因此不可能准确评估其发生频率或判断其与药物的因果关系。肝胆异常:肝功能衰竭(有些是致命的)、黄疸、肝功能检查结果严重异常、肝脏疾病。免疫系统异常:过敏反应。肌肉骨骼和结缔组织异常:横纹肌溶解症。精神异常:包括攻击性倾向的精神病行为。肾脏和泌尿系统异常:肾小管间质性肾炎。皮肤和皮下组织异常:全身性皮疹,Stevens Johnson综合征,皮肤过敏反应。【禁忌】正在服用硫唑嘌呤、巯嘌呤或胆茶碱的患者禁用本品。【注意事项】1.开始应用本品治疗后,可观察到痛风发作增加。这是由于变化的血清尿酸水平减少导致沉积的尿酸盐活动引起的。为预防给药本品时发生痛风发作,推荐同时给药非甾体抗炎药或秋水仙碱。2.随机对照研究中,使用本品[0.74per100P-Y(95%CI0.36-1.37)]的患者比给药别嘌醇[0.60per100P-Y(95%CI0.16-1.53)]患者更易发生心血管血栓事件(心血管死亡、非致命性心肌梗塞、非致命性中风)相关原因尚未明确。应对心肌梗塞(MI)及中风的体征和症状进行监测。3.随机对照研究中,观察到转氨酶水平比正常上限的3倍还高(给药本品及别嘌呤醇患者分别提高,AST:2%,2%、ALT:3%,2%)。未发现转氨酶的提高具有量效关系。肝功能实验室分析推荐,应用本品治疗2月和4月,此后周期性治疗。请仔细阅读说明书并遵医嘱使用。【特殊人群用药】儿童注意事项:18以下儿童患者使用本品的安全性及有效性尚未确定。妊娠与哺乳期注意事项:1.在器官生成期对大鼠和兔子口服给药非布佐司他,剂量达到48mg/kg(按照体表面积计算分别为人给药80mg/天的40和50倍)时,无致畸性。在器官生成期及泌乳期,对怀孕期大鼠口服给药本品,剂量达到48mg/kg(为人给药80mg/天的40倍),发现新生儿死亡率增加,新生儿体重增加减少。2.非布佐司他经大鼠乳汁分泌。非布佐司他是否经人体乳汁分泌尚未知。由于很多药物通过人乳汁分泌,故对哺乳期妇女给药本品时应谨慎。老人注意事项:老年患者使用本品无需剂量调整。与其他年龄组相比,在安全性及有效性方面无临床显著差异,但不排除有些老年患者对本品较敏感。老年患者(≥65岁)多剂量口服给药非布佐司他后的Cmax及AUC24与年轻患者(18-40岁)相似。【药物相互作用】非布佐司他是黄嘌呤氧化酶(XO)抑制剂。虽然本品与通过XO代谢药物(例如胆茶碱、巯嘌呤、硫唑嘌呤)的相互作用尚无研究,但本品对XO的抑制作用会这些药物在血浆中浓度的增加从而产生毒性。正在服用硫唑嘌呤、巯嘌呤或胆茶碱患者禁止使用本品。【药理作用】非布佐司他是黄嘌呤氧化酶抑制剂,通过减少血清尿酸达到疗效。【贮藏】密封。【规格】40mg 二、市场情况非布司他主要成份为非布佐司他,其化学名为2-[(3-氰基-4-异丁氧基)苯基]-4-甲基-5-噻唑羧酸。为黄嘌呤氧化酶(XO)抑制剂,适用于具有痛风症状的高尿酸血症的长期治疗。最新进入中国的非布司他片(菲布力)于2018年9月4日被国家药品监督管理局批准在中国市场上市。近年来,随着人们日常生活方式以及饮食习惯的改变,我国高尿酸血症发病率逐年递增,并呈明显的年轻化发展趋势,被称为继高血压、高血脂、高血糖之后的“第四高”。痛风与高尿酸血症呈密切正相关关系。多项研究表明,高尿酸血症是嘌呤代谢紊乱引起的代谢异常综合征,血尿酸超过其在血液或组织液中的饱和度可在关节局部形成尿酸钠晶体并沉积,诱发局部炎症反应和组织破坏,即痛风。痛风症状发作时,主要表现为夜晚出现突然性的关节疼,发病急,关节部位出现严重的疼痛、水肿、红肿和炎症。此外,痛风可并发肾脏病变,严重者可出现关节破坏、肾功能损害,常伴发高脂血症、高血压病、糖尿病、动脉硬化及冠心病等,严重威胁健康与预期寿命。《中国高尿酸血症与痛风诊治指南(2019)》指出,痛风患者应积极采取降尿酸治疗,并推荐非布司他、别嘌醇等为一线用药。对于降尿酸药物的具体选择上,指南表明,无论在疗效还是不良反应方面,非布司他均优于别嘌醇。作为一种新型降尿酸药物,非布司他通过同时抑制黄嘌呤氧化酶和黄嘌呤还原酶两种酶的活性来降低血尿酸,因此疗效优于别嘌醇。此外,非布司他属于高选择性抑制剂,不会影响身体的其它嘌呤、嘧啶代谢,相比容易在汉族中引发超敏反应的别嘌醇来说不良反应更少,且能提供降尿酸之外的肾保护,对慢性肾功能不全的患者十分友好,因此肾功能不全患者的降尿酸治疗应首选非布司他。据悉,非布司他为日本帝人制药株式会社原研药品,英文名为Febuxostat,中文商品名:菲布力®。在1999年被日本帝人化学合成后,于2009年在美国首发上市,由于其疗效佳、副作用小等优点,在治疗药并不多的高尿酸血症及痛风领域,被称为世界上近40年来有效控制痛风的新药。目前菲布力已在全球近80个国家和地区上市。为使我国痛风患者在用药方面有更多优质选择,2018年9月,非布司他被中国药监局批准进口,正式进军国内市场;2019年6月,以菲布力® 作为商品名在中国正式上市,作为日本原研高品质药物,菲布力®在原料、辅料、制剂工艺等方面与仿制药均存在较大差异,在品质、疗效上要优于国产非布司他。此外,新版《指南》推荐非布司他的起始剂量为20mg,而国产非布司他均为40mg规格,患者只能掰药服用,存在用药剂量不精确且有药品被污染、药片丢失等风险,隔天再服用影响药品效果和依从性。因此,不规范的服用方式,无法更好的起到预防痛风的作用。与之相比,有20mg品规的非布司他可以从推荐的低剂量开始服用,小剂量递增用药,预防痛风更科学、患者依从性更佳。事实上,“非布司他”、“非布索坦”以及上述英文和日文均是“Febuxostat”的音译,都是日本帝人制药株式会社原研及生产的药品,因为翻译及各国家运营代理不同,不同地区中文译名不同,在不同国家和地区品牌名称也不一样,如在日本常被称作“帝人痛风”(フェブリク),在中国台湾被称为“福避痛”、在中国香港和内地则被叫作“菲布力”。药物在化学本质上和疗效上是一样的,都同为日本帝人生产的同一种痛风原研药物,但外包装存在一些差异。因此,患者无需担心菲布力®与帝人痛风药的品质差别。菲布力®就是日本原研非布司他(即帝人痛风)2016年,全球非布司他原研药销售额为6.33亿美元,比上一年增长了7.77%,2017年美国市场非布司他片销售额约5.4亿美元。据Menet数据,2017年国内重点城市公立医院非布布司他销售额已超过1亿元,同比上一年增长104.45%。其中江苏万邦生化占据59.7%,江苏恒瑞占据25.58%,杭州朱养心占据15.36%。另据人类数据科学公司IQVIA信息,2017年中国非布司他销售额约4.43亿元。 三、国内已上市批件信息经查过国家药监局网站,已有本品种原料药和片剂批件共25个,分别记录如下: 1、杭州中美华东制药有限公司 非布司他 国药准字H201300082、徐州万邦金桥制药有限公司 非布司他 国药准字H201300573、江苏恒瑞医药股份有限公司 非布司他 国药准字H201300804、南京海纳制药有限公司 非布司他片 国药准字H202130925、成都倍特药业股份有限公司 非布司他片 国药准字H202139266、重庆圣华曦药业股份有限公司 非布司他片 国药准字H202138597、山东朗诺制药有限公司 非布司他片 国药准字H202138648、江苏万邦生化医药集团有限责任公 非布司他片 国药准字H201300589、杭州朱养心药业有限公司 非布司他片 国药准字H2020503010、南京海纳制药有限公司 非布司他片 国药准字H2021372011、成都倍特药业股份有限公司 非布司他片 国药准字H2021392712、广东东阳光药业有限公司 非布司他片 国药准字H2021332413、江苏万邦生化医药集团有限责任 非布司他片 国药准字H2013005814、杭州朱养心药业有限公司 非布司他片 国药准字H2020503015、南京海纳制药有限公司 非布司他片 国药准字H2021372016、江苏恒瑞医药股份有限公司 非布司他片 国药准字H2021368917、重庆圣华曦药业股份有限公司 非布司他片 国药准字H2021386018、江苏恒瑞医药股份有限公司 非布司他片 国药准字H2013008219、南京海纳制药有限公司 非布司他片 国药准字H2021309120、南京海纳制药有限公司 非布司他片 国药准字H2021371921、江苏恒瑞医药股份有限公司,成都... 非布司他片 国药准字H2013008122、江苏中天药业有限公司 非布司他片 国药准字H2021317123、杭州朱养心药业有限公司 非布司他片 国药准字H2013001024、江苏中天药业有限公司 非布司他片 国药准字H2021317225、广东东阳光药业有限公司 非布司他片 国药准字H20213325 有日本TEIJIN PHARMA LIMITED公司不同规格和包装的进口注册信息如下:1、日本TEIJIN PHARMA LIMITED 非布司他片 H20180051 20mg 70片(14片/板,5板/盒);500片(10片/板,50板/盒)2、日本TEIJIN PHARMA LIMITED 非布司他片 J20180085 40mg 14片/盒3、日本TEIJIN PHARMA LIMITED 非布司他片 H20181257 20mg聚丙烯薄膜/铝箔:28000片/箱;聚乙烯袋:150000片/桶4、日本TEIJIN PHARMA LIMITED非布司他片H20180050 40mg 140片(14片/板,10板/盒)5、日本TEIJIN PHARMA LIMITED非布司他片 J20180084 20mg 14片/盒6、日本TEIJIN PHARMA LIMITED非布司他片H20180050 40mg 聚丙烯薄膜/铝箔:28000片/箱;聚乙烯袋:76400片/桶 四、申报记录经检索,现国家局已有本品种片剂的申请记录,检索时间自21年8月至今。 CYHB2200760 非布司他片 化药4 补充申请 2022-05-11 天方药业有限公司;南京海纳制药有限公司CYHB2200761 非布司他片 化药4 补充申请 2022-05-11 天方药业有限公司;南京海纳制药有限公司CYHS2200441 非布司他片 化药4 仿制 2022-03-14 吉林省辉南长龙生化药业股份有限公司CYHS2200442 非布司他片 化药4 仿制 2022-03-14 吉林省辉南长龙生化药业股份有限公司CYHS2200331 非布司他片 化药4 仿制 2022-02-17 南京海辰药业股份有限公司;曹于平CYHS2200332 非布司他片 化药4 仿制 2022-02-17 南京海辰药业股份有限公司 CYHS2200022 非布司他片 化药4 仿制 2022-01-07 浙江诺得药业有限公司 CYHS2200021 非布司他片 化药4 仿制 2022-01-07 浙江诺得药业有限公司 CYHS2102239 非布司他片 化药4 仿制 2021-12-23 宜昌人福药业有限责任公司 CYHS2102240 非布司他片 化药4 仿制 2021-12-23 宜昌人福药业有限责任公司 CYHS2102247 非布司他片 化药4 仿制 2021-12-22 华润双鹤药业股份有限公司 CYHS2102195 非布司他片 化药4 仿制 2021-12-22 芜湖杨燕制药有限公司;华益药业科技(安徽)有限公司 CYHS2102194 非布司他片 化药4 仿制 2021-12-22 芜湖杨燕制药有限公司;华益药业科技(安徽)有限公司 CYHS2102176 非布司他片 化药4 仿制 2021-12-11 青岛黄海制药有限责任公司 CYHS2102175 非布司他片 化药4 仿制 2021-12-11 青岛黄海制药有限责任公司 CYHS2101666 非布司他片 化药4 仿制 2021-08-31 浙江亚太药业股份有限公司 CYHS2101665 非布司他片 化药4 仿制 2021-08-31 浙江亚太药业股份有限公司 JTH2100596 非布司他降解产物I对照品 化药 2021-08-10 F.I.S. - Fabbrica Italiana Sintetici S.p.A;TEIJIN PHARMA LINITED;安斯泰来制药(中国)有限公司 JTH2100597 非布司他有关物质V对照品 化药 2021-08-10 F.I.S. - Fabbrica Italiana Sintetici S.p.A;TEIJIN PHARMA LINITED;安斯泰来制药(中国)有限公司 CYHS2101528 非布司他片 化药4 仿制 2021-08-05 西洲医药科技(浙江)有限公司;浙江北生药业汉生制药有限公司 五、专利查询 本品种无专利限制,可按四类化药申报。 六、参比信息 七、原料来源经调研,本品种市场已有合法原料来源,威海迪沙药业已通过原料药备案的原料价格在3500每公斤左右,本品种规格40mg/片,每片原料价格0.0035元,每100片原料价格为0.35元。经检索京东药店,万邦医药生产的非布司他,商品名:优立通。线上零售价格为30.50元/合/35片,平均每片售价0.87元,每100片售价87.14元,每100片原料成本仅0.35元,市场利润可观。 八、可申报剂型原料药、片剂。 九、研究进度本品种原料和制剂工艺成熟,原料可直接大生产。

1美阿沙坦钾片40mg、80mg成人原发性高血压。2019年美阿沙坦钾为武田带来了767亿日元的营收,约合人民币48亿元,号称史上最强降压药。(阿齐沙坦的前药,体内代谢成阿齐沙坦)合成+湿法制粒1家上市。2021年1月原研武田国内上市;暂无企业申报专利期综合制剂车间4类需专利评估2沙库巴曲缬沙坦钠片200mg、100mg、50mg用于射血分数降低的慢性心力衰竭(NYHA Ⅱ-Ⅳ级,LVEF ≤40%)成人患者,降低心血管死亡和心力衰竭住院的风险等。全球首款心衰治疗领域的突破性创新药物。2017年7月首次获批进入中国市场,2019年纳入全国医保乙类目录。2021年新增原发性高血压适应症。2022年,诺华原研片全球销售额46.44亿美元,同比增长37%。2023年上半年,全球销售额达29.15亿美元,同比增长31%。2023年,前3季度,本品业绩为44亿美元。干法制粒9家上市。14家仿制已受理,9家正在进行BE试验专利已挑战成功综合制剂车间4类小试已完成,可直接中试。处方工艺有过BE经验。3比索洛尔氨氯地平片5mg/5mg轻中度高血压。目前唯一在国内上市的β受体阻滞剂+钙通道阻滞剂的长效单片复方制剂。比索单方市场国内在15亿元左右。混粉直压原研独家上市。17家已完成BE或正在进行BE中制剂专利可绕开,2029年到期综合制剂车间4类小试进行中。处方工艺有过BE经验。4甲苯磺酸艾多沙班片60mg、30mg、15mg用于静脉血栓栓塞, 房颤艾多沙班成为继达比加群酯、利伐沙班和阿哌沙班之后第四个获得FDA批准的新型口服抗凝药(NOAC)。该药2022年全球销售额约合人民币111亿元。NOACs药物全球市场峰值预估在220亿美元左右,目前阿哌沙班是化学药物分子中全球销售额排首位的药物。湿法制粒3家已上市。9家已完成BE或正在BE中无专利限制综合制剂车间4类有批产经验5比拉斯汀片20mg适用于12岁及以上青少年和成年人荨麻疹的对症治疗。第二代长效组胺H1受体拮抗剂,适用于中国慢性荨麻疹患者,无镇静副作用,起效持续时间可长达24小时。疗效不劣于左西替利嗪5 mg,且表现出良好的安全性。预估2024年国内抗过敏药物市场规模将达到340亿元左右。混粉直压原研2023年06月刚上市。11家已完成BE或正在BE中无专利限制综合制剂车间4类小试已完成,可直接中试。处方工艺有过BE经验。6恩格列净片25mg、10mg治疗2型糖尿病。2022年新增适应症为治疗伴或不伴糖尿病、射血分数降低的成人心力衰竭患者。糖尿病肾病的适应症正在临床研究中。首个在 2 型糖尿病患者中被证实具有心血管保护作用并能改善心血管结局的 SGLT2 抑制剂。2021-2022年全球销售排名最靠前的糖尿病药物,2022年全球销售额82亿美元,米内网数据国内销售额5.71亿元,同比增长39.65%。湿法制粒13家已上市。另有30家左右已完成BE或正在进行BE中无专利限制综合制剂车间4类成功批产经验7恩格列净二甲双胍片500mg/5mg、850mg/5mg、1000mg/12.5mg适用于适合接受恩格列净和盐酸二甲双胍治疗的2型糖尿病成人患者,用于改善这些患者的血糖控制。湿法制粒2家已上市。另有30家左右在BE或在审评中无专利限制综合制剂车间4类小试已完成,可直接中试。处方工艺有过BE经验。8非奈利酮片10mg、20mg2型糖尿病相关的慢性肾病。可降低eGFR持续下降、终末期肾病的风险。全球首个用于2型糖尿病相关的慢性肾病治疗的盐皮质激素受体拮抗剂;全球最大规模3期研究项目证实非奈利酮肾心双重获益,获得指南一致推荐。2023年第一季度非奈利酮销售额为5200万欧元,同比增长372%。拜耳预期年销售额可超过30亿欧元。合成+湿法制粒仅原研上市。无仿制厂家进行BE化合物和晶型均在专利期综合制剂车间4类需专利评估9硫辛酸片0.6g、0.2g治疗糖尿病多发性周围神经病变。我国糖尿病周围神经病变患病率超50%,中国糖尿病患者当前约1.4亿人。硫辛酸注射液2021年国内样本医院销售额超人民币10亿元,片剂市场潜力更广。湿法制粒3家上市,2023年12月首家过评。另有3家在审评无专利限制综合制剂车间3类有全套研究经验及资料10苯磺酸美洛加巴林片15mg、10mg、5mg神经性疼痛(包括糖尿病周围神经性疼痛、带状疱疹后神经痛、脊髓损伤后神经痛)2022年,本品在日本销售额为385亿日元(约合18.44亿人民币),同比增长27.9%。与普瑞巴林和加巴喷丁相比,米诺巴林在缓解DPNP和PHN相关疼痛方面具有较高的镇痛效果,其安全边际较宽,不良反应发生率相对较低。合成+混粉直压原研第一三共在报产阶段;正大天晴首仿BE已完成,原料药尚无备案厂家化合物专利2028年9月到期,晶型及制剂组合物专利期更晚综合制剂车间4类原料小试工艺已打通,正在进行规避晶型研究

山东博创医药技术有限公司济南市综合保税区港兴一路592号济南市高新区春兰路银丰生物城B10联系人:李女士电话:183 7541 7530 可开发剂型: 原料、片剂、注射液。 片剂:按3类申请,做等效。 注射液:按4类申请工艺研发进度: 工艺成熟,可包过BE(需做验证性临床)服务内容: 原料和制剂药学研究及临床试验。 一、品种概况(片剂说明书)【药品名称】通用名称:硫辛酸片英文名称:Thioctic Acid Tablets汉语拼音:ThiocticAcidCapsules【成份】硫辛酸。【性状】本品为淡黄色至黄色片,有特殊臭味。【适应症】治疗糖尿病多发性周围神经病变。【用法用量】口服,每日一次,每次0.6g(两片),早餐前半个小时服用。对于较严重的症状,建议起始先采用注射治疗。由于糖尿病周围神经病变是慢性疾病,一般需长期服用,具体使用时间由医生根据个体特点决定。【不良反应】胃肠道系统:非常罕见(1/10,000):恶心、呕吐、胃肠疼痛和腹泻。过敏反应:非常罕见(1/10,000):皮肤过敏反应如皮疹、荨麻疹和搔痒。神经系统:非常罕见(1/10,000):味觉改变或异常。全身反应:非常罕见(1/10,000):由于糖利用的改善,少数病例中出现血糖降低。此时低血糖的症状有眩晕.出汗、头痛和视物异常。如发生上述一项症状,应立即停药,并通知医生,医生会根据程度决定是否继续用药。过敏症状一出现,即应停药并通知医生。如发生任何上述未来提及的不良反应,请通知医生或药师。【禁忌】对于本品及其他处方组成过敏者禁用。【注意事项】 对本品过敏者禁用,过敏体质者慎用。【特殊人群用药】儿童注意事项:儿童患者用药的安全有效性尚未确立。妊娠与哺乳期注意事项:只有在谨慎评估利益一风险后,本品才能用于妊娠或哺乳期妇女。生殖毒理学来提示对生育力及胚胎早期发育的影响,胚胎毒性效应不明照,目前有关硫辛酸进入母乳的途径尚未知。因此妊娠和哺乳期妇女只有在医生强烈建议时才能使用本品。老人注意事项: 尚不明确。【药物相互作用】只有在谨慎评估利益一风险后,本品才能用于妊娠或哺乳期妇女。生殖毒理学来提示对生育力及胚胎早期发育的影响,胚胎毒性效应不明照,目前有关硫辛酸进入母乳的途径尚未知。因此妊娠和哺乳期妇女只有在医生强烈建议时才能使用本品。【药理作用】毒理作用:硫辛酸为B族维生素,是丙酮酸脱氢酶系和α-同戊二酸脱氢酶系的辅酶。离体试验显示,硫辛酸可以降低神经组织的脂质氧化,可抑制蛋白质糖基化作用,抑制醛糖还原酶。在体内,硫辛酸具有抗氧作用,参与谷胱甘肽及辅酶Q10等抗氧化剂再循环。硫辛酸能螯合某些金属离子(如铜、锰、锌)。【贮藏】遮光、密封保存。【规格】0.3g【包装规格】0.3g【有效期】24月 二、市场情况硫辛酸注射液原研厂家为德国史达德大药厂,为国家医保乙类药物,主要用于糖尿病周围神经病变引起的感觉异常。硫辛酸通过降低神经组织的脂质氧化,抑制蛋白质糖基化作用,抑制醛糖还原酶,进而阻止葡萄糖或半乳糖转化成为山梨醇,用于防止糖尿病、控制血糖及防止因高血糖造成的神经病变,临床适应症:糖尿病周围神经病变引起的感觉异常。糖尿病周围神经病变(DPN)是糖尿病最常见的慢性并发症之一。关于DPN的发病机制有多种学说,糖尿病并发症的统一机制学说提出,线粒体超氧化物产生过多是导致包括DPN在内的糖尿病慢性并发症的共同机制。硫辛酸是一种强抗氧化剂,国外研究证实其可明显改善DPN的临床症状和神经传导速度,在德国用于治疗糖尿病性神经病已有50余年临床应用历史,因此,近年来抗氧化剂在DPN治疗中的作用日益受到重视,为DPN的治疗提供了一条新途径。 三、国内已上市批件信息经检索国家局数据库,现国家局已有本品种原料药、片剂和胶囊剂及注射液生产批件记录如下: 1国药准字H20053854硫辛酸山东齐都药业有限公司2国药准字H20123157硫辛酸苏州富士莱医药股份有限公司3国药准字H20073869硫辛酸江苏同禾药业有限公司4国药准字H20059736硫辛酸江苏神龙药业有限公司5国药准字H20041815硫辛酸亚宝药业集团股份有限公司6国药准字H20067503硫辛酸青岛金峰制药有限公司7国药准字H20066705硫辛酸重庆药友制药有限责任公司8国药准字H20065200硫辛酸丹东医创药业有限责任公司9国药准字H20067501硫辛酸武汉生物化学制药有限公司10国药准字H20100152硫辛酸片山东齐都药业有限公司11国药准字H20130007硫辛酸片山德士(中国)制药有限公司12国药准字H20133253硫辛酸胶囊蓬莱诺康药业有限公司13国药准字H20100158硫辛酸胶囊江苏万禾制药有限公司14国药准字H20205042硫辛酸注射液重庆药友制药有限责任公司15国药准字H20183110硫辛酸注射液四川美大康华康药业有限公司16国药准字H20203033硫辛酸注射液花园药业股份有限公司17国药准字H20203385硫辛酸注射液河南润弘制药股份有限公司18国药准字H20203386硫辛酸注射液河南润弘制药股份有限公司19国药准字H20183534硫辛酸注射液成都倍特药业股份有限公司20国药准字H20203241硫辛酸注射液西安汉丰药业有限责任公司21国药准字H20203242硫辛酸注射液西安汉丰药业有限责任公司22国药准字H20066706硫辛酸注射液重庆药友制药有限责任公司23国药准字H20065201硫辛酸注射液丹东医创药业有限责任公司24国药准字H20203121硫辛酸注射液安徽威尔曼制药有限公司25国药准字H20213242硫辛酸注射液湖南华纳大药厂股份有限公司26国药准字H20213741硫辛酸注射液天方药业有限公司27国药准字H20055869硫辛酸注射液亚宝药业集团股份有限公司28国药准字H20193123硫辛酸注射液四川美大康佳乐药业有限公司29国药准字H20059737硫辛酸注射液江苏神龙药业有限公司30国药准字H20203417硫辛酸注射液亚宝药业集团股份有限公司31国药准字H20203120硫辛酸注射液安徽威尔曼制药有限公司32国药准字H20203384硫辛酸注射液河南润弘制药股份有限公司33国药准字H20213242硫辛酸注射液湖南华纳大药厂股份有限公司34国药准字H20213741硫辛酸注射液天方药业有限公司35国药准字H20055869硫辛酸注射液亚宝药业集团股份有限公司36国药准字H20193123硫辛酸注射液四川美大康佳乐药业有限公司37国药准字H20059737硫辛酸注射液江苏神龙药业有限公司38国药准字H20203417硫辛酸注射液亚宝药业集团股份有限公司39国药准字H20203421硫辛酸注射液江苏万高药业股份有限公司40国药准字H20080523注射用硫辛酸福安药业集团烟台只楚药业有限公...41国药准字H20080522注射用硫辛酸福安药业集团烟台只楚药业有限公...42国药准字H20061176注射用硫辛酸江苏奥赛康药业有限公司 四、申报记录经检索国家局药审中心近二年内受理数据,现审评中心已有本品种片剂和注射液申请记录,其中片剂按3类受理,注射液按4类受理。序号受理号药品名称申请类型分类企业名称承办日期1CYHB2250483硫辛酸注射液补充申请原6湖南华纳大药厂股份有限公司;湖南华纳大药厂股份有限公司;2022-08-082CYHS2200928硫辛酸注射液仿制4蓬莱诺康药业有限公司;蓬莱诺康药业有限公司;2022-06-223CYHB2201012硫辛酸注射液补充申请山东新时代药业有限公司;山东新时代药业有限公司;2022-06-224CYHS2200832硫辛酸注射液仿制4吉林省辉南长龙生化药业股份有限公司;吉林省辉南长龙生化药业股份有限公司;2022-06-035CYHS2200340硫辛酸注射液仿制4黑龙江珍宝岛药业股份有限公司;黑龙江珍宝岛药业股份有限公司;2022-02-186CYHS2102326硫辛酸片仿制3亚宝药业集团股份有限公司;亚宝药业集团股份有限公司;2021-12-307CYHS2102325硫辛酸片仿制3亚宝药业集团股份有限公司;亚宝药业集团股份有限公司;2021-12-308CYHS2102123硫辛酸注射液仿制4福安药业集团烟台只楚药业有限公司;福安药业集团烟台只楚药业有限公司;2021-12-079CYHS2102018硫辛酸注射液仿制3石家庄四药有限公司;石家庄四药有限公司;2021-11-1510CYHS2101975硫辛酸注射液仿制4成都市海通药业有限公司;成都市海通药业有限公司;2021-11-05 序号受理号药品名称申请类型注册分类企业名称承办日期11CYHS2101836硫辛酸注射液仿制4吉林惠升生物制药有限公司;北京四环制药有限公司;2021-10-1112CYHB2101423硫辛酸注射液补充申请原6亚宝药业集团股份有限公司;亚宝药业集团股份有限公司;2021-06-2213CYHB2101308硫辛酸注射液补充申请原6亳州万诺医药科技有限公司;江苏万高药业股份有限公司;2021-05-2714CYHB2140506硫辛酸注射液补充申请重庆药友制药有限责任公司;重庆药友制药有限责任公司;2021-05-2115CYHS2000670硫辛酸注射液仿制3南京海融制药有限公司;南京海融制药有限公司;2020-09-3016CYHS2000669硫辛酸注射液仿制3南京海融制药有限公司;南京海融制药有限公司;2020-09-3017CYHB2050397硫辛酸注射液补充申请丹东医创药业有限责任公司;2020-07-1818JYHZ2000166硫辛酸注射液进口再注册Hemony Pharmaceutical Germany GmbH;Siegfried Hameln GmbH;2020-07-1519CYHB2040023硫辛酸注射液补充申请花园药业股份有限公司;花园药业股份有限公司;2020-06-1820CYHB2050213硫辛酸注射液补充申请江苏神龙药业有限公司;江苏神龙药业有限公司;2020-04-21 五、专利查询经检索国家专利局数据库,本品种注册生产无专利限制。 六、参比信息略 七、原料来源经检索国家局数据库,现已有以下企业原料备案为A状态。 Y20210000898硫辛酸广安凯特制药有限公司武胜县工业集中区中心片区IY20190021622硫辛酸国药集团威奇达药业有限公司山西省大同市经济技术开发区医药工业园区AY20190007208硫辛酸青岛金峰制药有限公司青岛莱西市烟台路3号AY20190006792硫辛酸江苏同禾药业有限公司常熟市东南经济开发区武夷山路188号AY20190006576硫辛酸苏州富士莱医药股份有限公司江苏省常熟新材料产业园海旺路16号AY20190006326硫辛酸武汉生物化学制药有限公司武汉东湖新技术开发区庙山小区武汉医药产业园AY20190006301硫辛酸丹东医创药业有限责任公司辽宁省丹东市振兴区胜利街488号AY20190006137硫辛酸重庆药友制药有限责任公司重庆市渝北区人和镇星光大道100号AY20190004580硫辛酸亚宝药业集团股份有限公司山西省风陵渡经济开发区工业大道1号AY20190004123硫辛酸北京四环科宝制药有限公司北京市丰台区科技园区海鹰路11号AY20190003078硫辛酸江苏神龙药业股份有限公司东台市纬八路15号AY20190002414硫辛酸上海现代制药股份有限公司上海市浦东新区建陆路378号AY20190002067硫辛酸山东齐都药业有限公司淄博市临淄区宏达路17号AY20190001222硫辛酸福安药业集团烟台只楚药业有限公司烟台市芝罘区烟福路1号AY20190000265硫辛酸天津乾启医药科技有限公司河东区卫国道189号帅越地热科技开发中心425室I

可开发剂型: 原料、片剂。申报类型:4类工艺研发进度: 原料和制剂已有多次中试经验,可包过BE。服务内容: 原料和制药药学研究及临床试验。

可开发剂型: 原料、片剂、注射液。 片剂:注册分类4类 注射液:按4类申请工艺研发进度: 原料、制剂工艺成熟服务内容:原料和制剂药学研究及临床试验。 一、品种概况(片剂说明书)【药品名称】盐酸莫西沙星片【成份】本品主要成份为盐酸莫西沙星。【性状】(1)盐酸莫西沙星片:暗红色薄膜衣片。(2)盐酸莫西沙星氯化钠注射液:黄色的澄清液体。 【适应症】本品用于治疗成人(≥18岁)敏感细菌所引起的下列感染: 急性细菌性鼻窦炎:由肺炎链球菌、流感嗜血杆菌或卡他莫拉菌引起。由于使用氟喹诺酮类药物(包括盐酸莫西沙星)已有报道发生严重不良反应,且对于一些患者,急性细菌性鼻窦炎有自限性,应在没有其它药物治疗时方可使用盐酸莫西沙星。慢性支气管炎急性发作:由肺炎链球菌、流感嗜血杆菌、副流感嗜血杆菌、肺炎克雷伯菌、甲氧西林敏感的金黄色葡萄球菌或卡他莫拉菌引起。由于使用氟喹诺酮类药物(包括盐酸莫西沙星)已有报道发生严重不良反应,且对于一些患者,慢性支气管炎急性发作有自限性,应在没有其它药物治疗时方可使用盐酸莫西沙星。社区获得性肺炎:由肺炎链球菌(包括多药耐药株)、流感嗜血杆菌、卡他莫拉菌、甲氧西林敏感的金黄色葡萄球菌、肺炎克雷伯菌、肺炎支原体或肺炎衣原体引起。非复杂性皮肤和皮肤组织感染:由甲氧西林敏感的金黄色葡萄球菌或化脓性链球菌引起。复杂性皮肤和皮肤组织感染:由甲氧西林敏感的金黄色葡萄球菌、大肠埃希氏菌、肺炎克雷伯氏菌或阴沟肠杆菌引起。复杂性腹腔内感染:由大肠杆菌、脆弱类杆菌、咽峡炎链球菌、星座链球菌、粪肠球菌、变形杆菌、产气荚膜梭菌、多形类杆菌或消化链球菌属等引起,包括腹腔脓肿。鼠疫,包括成人因鼠疫耶尔森氏杆菌(Y.pestis)引起的肺鼠疫和败血性鼠疫,也可预防鼠疫。由于可行性原因,无法对人类进行有效性临床研究,因此,该适应症仅是基于动物有效性研究数据所确定。不伴有输卵管-卵巢或盆腔脓肿的轻至中度盆腔炎性疾病(即:女性上生殖道感染,包括输卵管炎和子宫内膜炎)。由于淋病奈瑟氏菌对莫西沙星的耐药性增加,不建议本品用于单药治疗轻至中度盆腔炎性疾病,而是应当与另一种合适的抗菌药物(例如:头孢菌素)联合用药,除非能够排除对莫西沙星耐药的淋病奈瑟氏菌。 【药品规格】盐酸莫西沙星片:0.4g。盐酸莫西沙星氯化钠注射液:250ml:莫西沙星:0.4g与氯化钠2.0g。 【用法用量】本品不同剂型、不同规格的用法用量可能存在差异,请阅读具体药物说明书使用,或遵医嘱。 盐酸莫西沙星片:1、成人剂量、疗程和给药方法:盐酸莫西沙星片的剂量为0.4g(口服),每24小时一次。治疗的持续时间取决于感染的类型,如表(详见说明书)。2、老年患者:老年患者不必调整用药剂量。3、肾功能或肝功能不全患者:(1)肝损害:轻中度肝功能受损的患者(ChildPughA级或B级)与健康志愿者或肝功能正常的患者血浆药物浓度在临床上无明显差别。(2)肾损害:肾功能受损的患者(包括肌酐清除率≤30ml/min/1.73m2)和慢性透析,如血液透析和连续卧床腹膜透析的患者无需调整剂量。 4、给药说明(1)口服制剂可与食物或不与食物一同服用,饮水不限。(2)与多价阳离子药物相互作用(3)应在使用含有镁,铝,铁或锌,包括抗酸剂,硫糖铝,多种维生素和去羟肌苷咀嚼/缓释片或小儿口服颗粒之前至少4小时或8小时后服用盐酸莫西沙星片。(4)当开具盐酸莫西沙星来治疗某种细菌感染时,应告知患者:尽管在疗程早期病情通常会好转,但仍应遵医嘱使用药物。跳过剂量或不完成整个疗程可能会降低紧急治疗的有效性;增加细菌耐药性形成的可能性,未来将不能使用盐酸莫西沙星或其他抗菌药进行治疗。 5、种族差异:对高加索人、日本人、黑人及其他种族人群进行了可能的种族间差别试验,未发现临床相关的药代动力学差别。因此,不同种族间不必调整药物剂量。 盐酸莫西沙星氯化钠注射液:用于感染性疾病的治疗,通用的用法用量如下所示,但必须结合疾病严重程度由临床医生最终确定。 1、成人剂量、疗程和给药方法:(1)盐酸莫西沙星氯化钠注射液的剂量为0.4g(静脉滴注),每24小时一次。(2)根据中国健康受试者心脏所能耐受的输液速率以及国内I、II、III期临床研究的结果,推荐本品的输液时间应为90分钟。(3)静脉注射液给患者(例如,患者无法忍受口服剂型)提供了一个可选择的给药途径。从静脉切换口服时,无需调整剂量。临床医师认为有必要时,可以从开始的静脉给药转换为口服给药。(4)使用时,请将输液器针头垂直扎入橡胶塞内环中心,勿用力过大以避免胶塞受损。2、老年患者:老年患者不必调整用药剂量。3、肾功能或肝功能不全患者:(1)肝损害:轻中度肝功能受损的患者(ChildPughA级或B级)与健康志愿者或肝功能正常的患者血浆药物浓度在临床上无明显差别。(2)肾损害:肾功能受损的患者(包括肌酐清除率≤30ml/min/1.73m2)和慢性透析,如血液透析和连续卧床腹膜透析的患者无需调整剂量。4、给药说明:(1)给药前应检查本品是否有不溶颗粒或变色。应使用澄明,无不溶颗粒的本品。穿刺使用前应对本品进行目视检查,不得使用变色、存在颗粒物质或容器存在破损的产品。(2)盐酸莫西沙星氯化钠注射液为静脉注射剂,只能用于静脉滴注,不能用于动脉内、肌内、鞘内注射,不能腹膜内或皮下给药。(3)由于本品与其他注射液的相容性数据较少,本品中不得加入溶媒或其他药物,也不得使用同根静脉输液管同时输注本品,溶媒或其他药物。如使用同根静脉输液管或Y型管来连续滴注其他药物,或采用背负式输液,在滴注本品之前和之后,应使用和本品和其他滴注药物相容的注射液冲洗该管路。(4)当开具盐酸莫西沙星来治疗某种细菌感染时,应告知患者:尽管在疗程早期病情通常会好转,但仍应遵医嘱使用药物。跳过剂量或不完成整个疗程可能会降低紧急治疗的有效性,增加细菌耐药性形成的可能性,未来将不能使用盐酸莫西沙星或其他抗菌药进行治疗。5、药物相容性:比例在1:10至10:1之间时,本品与下列静脉注射液相容:(1)0.9%氯化钠注射液,无菌注射用水。(2)1M氯化钠注射液,10%葡萄糖注射液。(3)5%葡萄糖注射液,乳酸林格注射液6、种族差异:对高加索人、日本人、黑人及其他种族人群进行了可能的种族间差别试验,未发现临床相关的药代动力学差别。因此,不同种族间不必调整药物剂量。 【不良反应】严重和其他重要的不良反应:致残和潜在的不可逆转的严重不良反应,包括肌腱炎和肌腱断裂、周围神经病变和中枢神经系统的影。(1)肌腱病和肌腱断裂。(2)QT间期延长。(3)过敏反应。(4)其他严重并且有时致命的反应。(5)中枢神经系统的影响。(6)艰难梭菌相关性腹泻。(7)周围神经病变。(8)对血糖的干扰。(9)光敏感性/光毒性。(10)耐药菌的形成。 【临床试验的经验】由于临床试验实施的条件不同,在临床实验中观察到的药物不良反应发生率不能直接与另一种药物比较,可能也不能反映实际发生率。下面数据描述的是在不同条件下71项盐酸莫西沙星同活性药物对照的II-IV期临床试验。共14981例患者使用盐酸莫西沙星,平均年龄为50岁(约73%的患者小于65岁),50%为男性,63%是白人,12%是亚裔,9%是黑人。患者接受0.4g盐酸莫西沙星每日一次,口服、静脉滴注或序贯给药(静脉滴注后改为口服)。治疗时间通常是6-10天,平均治疗天数为9天。5%的患者由于发生不良事件停止使用盐酸莫西沙星。4.1%的患者口服0.4g盐酸莫西沙星,3.9%的患者静脉给药0.4g,8.2%的患者采用序贯疗法0.4g口服/静脉给药。在口服0.4g剂量的患者中,导致停药的最常见不良事件(>0.3%)是恶心、腹泻、头晕、呕吐。在静脉滴注0.4g剂量的患者中,导致停药的最常见不良事件是皮疹。在注射/口服序贯治疗剂量的患者中,导致停药的最常见不良事件是腹泻和发热。在接受盐酸莫西沙星治疗的患者中,不良反应≥1%和不太常见的不良反应(发生率在0.1%至<1%)分别显示在表2和表3中(详见说明书)。最常见的药物不良反应(3%)有恶心、腹泻、头痛、头晕。 实验室检查参数变化:以下实验室检查参数的变化在上面表中并未列出,是在≥2%患者中发生且发生率高于对照组,但不考虑与药物的因果关系得出的:红细胞平均血红蛋白、中性粒细胞、白细胞计数、凝血酶原时间比值、钙离子、氯离子、清蛋白、球蛋白、胆红素升高;血红蛋白、红细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、凝血酶原时间比值、葡萄糖、氧分压、胆红素、淀粉酶降低。不能确定上述实验室异常是由于药物或被治疗的原发疾病所引起的。 【上市后的经验】(1)血液和淋巴系统疾病:粒细胞缺乏症、全血细胞减少症。(2)心脏疾病:室性快速型心律失常(包括在非常罕见的情况下心脏骤停和尖端扭转型室性心动过速),通常在患者并发严重的药物性心律失常时发生。(3)耳和迷路疾病:听力损害,包括耳聋(一般可以逆转)。(4)肝胆系统疾病:肝炎(主要是淤胆型)、肝脏衰竭(包括死亡病例)、黄疸、急性肝坏死。(5)免疫系统疾病:过敏反应、过敏性休克、血管性水肿(包括喉头水肿)。(6)肌肉骨骼和结缔组织疾病:肌腱断裂。(7)神经系统疾病:协调障碍、步态异常、重症肌无力(加重)、肌肉无力、周围神经病变(可能不可逆),多发性神经病。(8)精神疾病:精神病反应(非常罕见病例可能最终致自我伤害行为如自杀意念/自杀想法或企图自杀)。(9)肾脏和泌尿系统疾病:肾功能障碍、间质性肾炎。(10)呼吸系统、胸和纵隔疾病:过敏性肺炎。(11)皮肤和皮下组织类疾病:光敏性/光毒性反应、Stevens-Johnson综合征、中毒性表皮坏死松解症。(12)眼器官疾病:视觉丧失(特别是在中枢神经系统反应过程中,大部分是一过性的)。 【禁忌】已知对莫西沙星、其他喹诺酮类药物或任何辅料过敏者禁用。妊娠和哺乳期妇女禁用。由于临床数据有限,患有肝功能损伤(ChildPughC级)的患者和转氨酶升高大于5倍正常值上限的患者应禁止使用盐酸莫西沙星。18岁以下患者禁用。有喹诺酮类药物治疗相关肌腱疾病/病症病史的患者禁用。在临床前研究及在人体研究的研究数据显示,暴露于莫西沙星后曾经观察到心脏电生理改变,表现为QT间期延长。基于安全性考虑,下列患者禁用莫西沙星:先天性或证明有获得性QT间期延长患者;电解质紊乱,尤其是未纠正的低钾血症患者;有临床意义的心动过缓患者;有临床意义的心力衰竭并伴有左心室射血分数降低患者;既往发生过有症状的心律失常患者。盐酸莫西沙星不应与其他能延长QT间期的药物同时使用。 【注意事项】 致残和潜在的不可逆转的严重不良反应,包括肌腱炎和肌腱断裂、周围神经病变和中枢神经系统的影响:使用氟喹诺酮类药物(包括盐酸莫西沙星),已有报告在同一患者的身体不同器官系统同时发生致残和潜在的不可逆转的严重不良反应,通常包括:肌腱炎,肌腱断裂,关节痛,肌痛,周围神经病变和中枢神经系统反应(幻觉,焦虑,抑郁,失眠,严重头痛和错乱)。这些不良反应可发生在使用盐酸莫西沙星后数小时至数周。任何年龄段的患者,之前没有相关风险因素,均有报告发生这些不良反应。肌腱病和肌腱断裂:氟喹诺酮类药物,包括盐酸莫西沙星,会使所有年龄段患者的肌腱炎和肌腱断裂的风险增加。这种不良反应最常发生在跟腱,跟腱断裂可能需要手术修复。也有报告在肩,手部,肱二头肌,拇指和其他肌腱点出现肌腱炎和肌腱断裂。肌腱炎和肌腱断裂可发生在开始使用莫西沙星后数小时或数天,或结束治疗后几个月。肌腱炎和肌腱断裂可双侧发生。这种风险在60岁以上老年患者,服用皮质类固醇药物患者及肾脏、心脏或肺移植手术的患者中进一步增加。除了年龄和使用皮质类固醇的因素外,另可独立增加肌腱断裂风险的因素包括剧烈的体力活动,肾功能衰竭以及以前的肌腱疾病,如类风湿关节炎。肌腱炎和肌腱断裂也发生在没有上述风险因素的使用氟喹诺酮类药物的患者中。肌腱断裂可发生在治疗过程中或治疗结束后;也有报告在治疗结束数月后发生肌腱断裂。在患者发生肌腱疼痛,肿胀,炎症或断裂后,应停止使用本品。在出现肌腱炎或肌腱断裂的迹象后,应建议患者休息,并与医生联系,换用非喹诺酮类抗生素药物。有肌腱疾病病史或发生过肌腱炎和肌腱断裂的患者应避免使用氟喹诺酮类抗生素,包括盐酸莫西沙星。重症肌无力加重:氟喹诺酮类药物,包括盐酸莫西沙星,有神经肌肉阻断活性,可能加剧重症肌无力患者的肌无力症状。上市后的严重不良事件,包括死亡和需要通气支持,和患有重症肌无力患者使用氟喹诺酮类药物相关。患有重症肌无力的患者应避免使用盐酸莫西沙星。QT间期延长:盐酸莫西沙星已被证明可使某些患者的心电图QT间期延长。口服0.4g的盐酸莫西沙星,从给药前至盐酸莫西沙星达最大浓度时,平均QTc变化为6msec(±26)(n=787)。静脉滴注0.4g的盐酸莫西沙星(每天滴注时间为1小时),从给药前至给药第1天时,平均QTc变化为10msec(±22)(n=667),第3天平均QTc变化为7msec(±24)(n=667)。由于缺乏这些患者的用药经验,本品应避免用于下列患者:(1)已知QT间期延长;(2)室性心律失常,包括尖端扭转型,因为QT间期延长可能导致发生这些状况的风险增加;(3)持续的心律失常状况,如具有临床显著性的心动过缓和急性心肌缺血;(4)未治疗的低钾血症或低镁血症;(5)使用抗心律失常IA类药物(例如,奎尼丁、普鲁卡因胺)或III类药物(例如,胺碘酮、索他洛尔);(6)其他延长QT间期的药物,如西沙必利、红霉素、抗精神病药物和三环抗抑郁药。老年患者使用盐酸莫西沙星的注射液可能更容易发生药物相关的QT间期延长。患有轻度、中度或重度肝硬化,代谢紊乱伴随肝功能不全的患者使用本品可能会导致QT间期延长。肝硬化患者使用盐酸莫西沙星应监测心电图。QT间期延长的程度会随着药物浓度或者注射液的输液速率的增加而增加,因此,不应超过推荐剂量或滴注速度。在上市前临床试验中,798例使用盐酸莫西沙星的患者和702例同时使用已知可致QT间期延长药物的对照患者的心血管不良事件的发生率相似。在超过15500例患者使用盐酸莫西沙星的对照临床研究中,包括759例在治疗开始时为低血钾的患者,没有因QT间期延长导致的心血管疾病发病率或死亡率的增加。在1项超过18000例患者使用盐酸莫西沙星片上市后观察性研究中,没有观察到死亡率的增加,这些患者未进行心电图的检测。过敏反应:使用喹诺酮类药物,包括盐酸莫西沙星的患者,已报告发生严重的过敏反应。一些患者在第一次给药后即发生,有些反应可伴随有心血管系统衰竭、丧失意识、刺痛、咽或面部水肿、呼吸困难、荨麻疹、瘙痒等。严重的过敏反应需要肾上腺素紧急治疗。盐酸莫西沙星应在第一次出现皮疹或其他任何过敏迹象时停止使用。必要时可进行输氧,静脉注射类固醇,气道管理,包括插管等措施。其他严重并且有时致命的反应:使用喹诺酮类药物,包括盐酸莫西沙星的患者,已有出现其他严重并且有时致命的事件的报告。这些事件中有些是由于过敏,有些则病因不明。这些事件可能是重度的,通常发生在多剂量给药后。临床表现可包括以下的一个或多个症状:发热、皮疹、严重的皮肤反应(例如,中毒性表皮坏死松解症,Stevens-Johnson综合征);血管炎;关节痛;肌痛;血清病;过敏性肺炎;间质性肾炎;急性肾功能不全或肾衰竭;肝炎、黄疸、急性肝坏死或肝功能衰竭;贫血,包括溶血性贫血和再生障碍性贫血;血小板减少症,包括血栓性血小板减少性紫癜;白细胞减少症;粒细胞缺乏症;全血细胞减少症和/或其他血液学异常。应在第一次出现皮疹、黄疸或任何其他过敏表现时立即停药并且采取措施。中枢神经系统的影响:使用氟喹诺酮类药物,包括盐酸莫西沙星,已有报告会使中枢神经系统不良反应的风险增加,包括:惊厥和颅内压增高(包括假性脑瘤)以及中毒引起的精神病。使用氟喹诺酮类药物可能会导致中枢神经系统反应包括焦躁、激动、失眠、焦虑、噩梦、偏执狂、头晕、错乱、震颤、幻觉、抑郁和自杀想法或行为。这些反应可能发生在首次用药后。如果这些反应发生在患者使用盐酸莫西沙星时,应停止给药并采取适当的措施。与所有的氟喹诺酮类药物一样,已知或怀疑有中枢神经系统疾病的患者(例如,严重的脑动脉硬化、癫痫)或存在其他风险因素的患者(如有发作倾向或发作阈值降低)应在获益超过风险时使用盐酸莫西沙星。周围神经病变:已有报告患者使用氟喹诺酮类药物,包括盐酸莫西沙星,产生罕见的感觉或感觉运动性轴索神经病,影响小和/或大的轴索,致皮肤感觉异常、感觉迟钝、触物痛感和衰弱。对于某些患者,症状可能在盐酸莫西沙星用药后很快发生并且可能是不可逆的。如果患者出现外周神经病变症状,包括疼痛、烧灼感、麻刺感、麻木和/或无力,或其他感觉,包括轻触觉、痛觉、温觉、位置觉和振动觉的变化,应立即停药。有周围神经病变病史的患者应避免使用氟喹诺酮类抗生素,包括盐酸莫西沙星。精神病学反应:即使在第一次使用喹诺酮类药物后(包括莫西沙星)也可能会发生精神病学反应。在非常罕见病例中出现了发展为自杀意念和自我伤害行为的抑郁或精神病反应,例如企图自杀等。如果患者出现了上述反应,应该停止使用莫西沙星并进行适当的疾病治疗。精神病患者或有精神性疾病病史的患者应慎用莫西沙星。艰难梭菌相关性腹泻:几乎所有的抗菌药物均出现过艰难梭菌相关性腹泻(CDAD)的报告,包括盐酸莫西沙星,严重程度从轻度腹泻至严重结肠炎。抗菌药物治疗使结肠的正常菌群改变,从而导致艰难梭菌过度生长。艰难梭菌产生的毒素A和B,是艰难梭菌相关性腹泻的原因。高毒性的梭菌引起的发病率和死亡率均升高,这些感染抗菌治疗无效,并可能需要结肠切除术。在接收抗生素治疗后,出现腹泻均应考虑CDAD的可能性。因为CDAD可能发生在使用抗菌药物治疗后两个月,因此仔细询问病史是必要的。如果怀疑或证实艰难梭菌相关性腹泻,可能需要停止目前使用的不针对艰难梭菌的抗生素。应适当补充液体和电解质,补充蛋白质,采用针对艰难梭菌的抗生素治疗,出现临床指征时应进行手术评价。动物的关节病:口服盐酸莫西沙星引起未成熟犬跛行。负重关节的组织病理学检查发现这些犬软骨永久性改变。相关喹诺酮类药物也产生负重关节的软骨糜烂以及在未成熟的各种动物物种产生其他关节症状。对血糖的干扰:和所有氟喹诺酮类药物一样,使用盐酸莫西沙星有报告血糖受到干扰,包括高血糖和低血糖。在使用盐酸莫西沙星的患者中,血糖障碍主要发生于那些同时口服降糖药(如磺酰脲类药物)或使用胰岛素的老年患者中。对于糖尿病患者,需更加注意监测血糖。如发生低血糖,需立即停用盐酸莫西沙星并开展适当治疗。光敏感性/光毒性:在使用喹诺酮类抗生素后暴露于阳光或紫外线照射下,会发生中度至严重的光敏性/光毒性反应,后者可能表现过度的晒伤反应(例如,烧灼感、红斑、水泡、渗出、水肿),常在暴露于光的部位出现(通常是脖子的“V”型区域、前臂伸肌表面、手的背部)。因此,应该避免过度暴露于光源下。发生光毒性反应时应停药。细菌耐药性的发生:在没有证据证明高度疑似细菌感染或用来预防细菌感染的情况下,使用盐酸莫西沙星并不能使患者受益,反而会增加耐药菌发生的风险。对驾驶或操作机械能力的影响:没有进行有关盐酸莫西沙星对驾驶和操作机械能力的影响方面的试验。然而,包括盐酸莫西沙星在内的氟喹诺酮类药物可能会导致患者出现中枢神经系统反应(如头晕,急性、短暂的目盲,参见【不良反应】)或急性和短时间的意识丧失(晕厥,参见【不良反应】),会损害患者的驾驶或操作机械的能力。应当建议患者在驾驶或操作机械之前考虑自己对盐酸莫西沙星是否有反应。盆腔炎性疾病:针对复杂盆腔感染患者(如伴有输卵管-卵巢或盆腔脓肿)治疗时,需考虑使用盐酸莫西沙星的注射液进行治疗,而不推荐口服莫西沙星治疗。盆腔炎性疾病可能是由对氟喹诺酮类耐药的淋病奈瑟氏菌导致的。因而在此类患者中,莫西沙星应当与另外一种合适的抗生素(例如头孢菌素)同时使用,除非能够排除对莫西沙星耐药的淋病奈瑟氏菌。如果治疗3天后临床上无改善,应当重新考虑治疗。 【特殊人群用药】 孕妇及哺乳期妇女:(1)孕妇:怀孕类别C。动物研究显示盐酸莫西沙星有生殖毒性,但对人的潜在危险性尚不明确。人类在怀孕期间使用盐酸莫西沙星的安全性尚未被证实,儿童服用喹诺酮类药物可引起可逆性关节损伤。因此,盐酸莫西沙星禁用于妊娠期的妇女。(2)哺乳期妇女:与其他喹诺酮类药物相同,盐酸莫西沙星可造成未成年试验动物负重关节的软骨损伤。临床前研究证实小量的盐酸莫西沙星可以分布到人类的乳汁中,尚缺乏哺乳期妇女的数据。因此,盐酸莫西沙星禁用于哺乳期的妇女。 儿童用药:儿童和青少年(<18岁)禁止使用盐酸莫西沙星。尚未确定盐酸莫西沙星在儿童和青少年中的有效性和安全性。 老年用药:老年患者不必调整用药剂量。(1)老年患者在使用氟喹诺酮类药物,如盐酸莫西沙星时会增加严重肌腱疾病,包括肌腱断裂的风险,在患者同时接受皮质类固醇治疗时,这种风险会进一步增加。肌腱炎或肌腱断裂可以涉及跟腱、手、肩或其他肌腱所在位置,可能发生在治疗期间或完成治疗之后,已有报告在使用氟喹诺酮类药物治疗数月后发生肌腱炎或肌腱断裂。在向老年患者,尤其是同时使用皮质类固醇的老年患者开具处方时应谨慎,患者应该被告知这个潜在的副作用,并建议如果发生任何症状的肌腱炎或肌腱断裂应停用盐酸莫西沙星并联系医生。一项多剂量对照临床试验,口服盐酸莫西沙星的患者中有23%的患者大于或等于65岁,9%是大于或等于75岁。临床试验数据证明,65岁及以上的老年患者口服盐酸莫西沙星的安全性和有效性与普通成年人相比无差异。(2)在静脉滴注盐酸莫西沙星的试验中,患者年龄65周岁及以上的占42%,年龄75周岁及以上的占23%。临床试验数据表明,65周岁及以上的患者静脉滴注盐酸莫西沙星的安全性与对照组一致。总体而言,老年患者更容易受与QT间期相关药物的影响。因此,服用可导致QT间期延长的药物(如IA类或III类抗心律失常药物)的患者或具有尖端扭转型室性心动过速风险因素(如已知QT间期延长,未纠正的低钾血症)的患者应避免使用盐酸莫西沙星。 【药物过量】单剂量口服用药到2.8g,未观察到严重不良事件发生。如出现急性过量的情况,应排空胃并保持充足的水分。由于可能会引起患者QT间期延长,应进行心电监护,并仔细观察,根据患者临床情况给予患者适当的支持治疗。药物过量后口服活性炭可有效防止莫西沙星系统暴露的过量增加。约3%和9%的莫西沙星以2%和4.5%的葡萄糖醛酸代谢产物可分别通过连续卧床腹膜透析和血液透析除去。 单剂量口服2000mg/kg、500mg/kg和1500mg/kg盐酸莫西沙星,可以分别导致大鼠、小鼠和食蟹猴死亡。静脉注射小鼠和大鼠的最小致死剂量为100mg/kg。临床表现包括中枢神经系统(CNS)和消化系统症状如活动力下降、震颤、抽搐、呕吐和腹泻。 【药物相互作用】抗酸药、硫糖铝、复合维生素和其他含有多价阳离子的产品:喹诺酮类药物会与碱金属和过渡态金属阳离子以螯合物形式结合。喹诺酮类药物与含有铝、镁、硫酸铝、金属阳离子的口服抗酸药,或含有铁、锌复合维生素,或与处方中含有二价和三价阳离子如去羟肌苷咀嚼/缓释片或小儿口服颗粒同时使用,可能大大影响其吸收,导致血浆中的喹诺酮类药物浓度远低于预期。因此,应在使用这些药物至少4小时前或8小时后口服盐酸莫西沙星片。 华法林:有报告称喹诺酮类药物,包括盐酸莫西沙星有增强华法林或其衍生物对患者的抗凝效果。此外,患者所患的感染性疾病及其伴随炎症过程、年龄和一般状态都是抗凝活性增加的危险因素。因此,如果喹诺酮类药物与华法林或其衍生物合并使用,必须严密监控患者的凝血酶原时间、国际标准化比值(INR)或其他合适的抗凝测试。 抗糖尿病药物:同时使用抗糖尿病药物和氟喹诺酮类药物的患者有报告血糖受到干扰,包括高血糖和低血糖。因此,当上述药物联用时,需密切监测血糖,如发生低血糖反应,需立即停用盐酸莫西沙星并开展适当治疗。 非甾体类抗炎药(NSAIDs):虽然在临床前研究和临床试验中均没有得到相关结论,但喹诺酮类药物和非甾体类抗炎药联用会增加患者中枢神经系统的刺激和抽搐的风险。 延长QT间期的药物:有限的资料表明盐酸莫西沙星和其他有延长QT间期作用的药物联用时具有潜在药效学相互作用。已证实III类抗心律失常药索他洛尔和大剂量盐酸莫西沙星的注射液联用后对犬有进一步延长QT间期的作用。因此,应避免盐酸莫西沙星与IA类和III类抗心律失常药同时使用。 【药理作用】作用机制:莫西沙星是具有广谱作用和抗菌活性的8-甲氧基氟喹诺酮类抗菌药。莫西沙星在体外显示出对革兰阳性细菌、革兰阴性细菌、厌氧菌、抗酸菌、和非典型微生物(如支原体、衣原体、军团菌)有广谱抗菌活性。抗菌作用机制为干扰Ⅱ、Ⅳ拓扑异构酶。拓扑异构酶是控制DNA拓扑和在DNA复制、修复和转录中关键的酶。其杀菌曲线表明,莫西沙星是具有浓度依赖性的杀菌活性。最低杀菌浓度和最低抑菌浓度基本一致。莫西沙星对β-内酰胺类抗生素和大环内酯类耐药的细菌亦有效。通过感染的实验动物模型证实,莫西沙星体内活性高。 耐药:导致对青霉素类、头孢菌素类、氨基糖甙类、大环内酯类和四环素类耐药的耐药机制不影响莫西沙星的抗菌活性。莫西沙星和这些抗菌药无交叉耐药性。至今未发现质粒介导的耐药性的出现。莫西沙星的8-甲氧基部分与8-氢部分相比具有对革兰阳性菌高活性和耐药突变的低选择性。庞大的7位的重氮杂环取代基能阻止活性流出,该活性流出为氟喹诺酮耐药机制。体外试验显示经过多步变异才能缓慢的出现对莫西沙星的耐药性。总之其耐药率很低(10−7-10−10)。序列的将细菌暴露在低于莫西沙星MIC浓度时只能使MIC值有少量的增加。其他喹诺酮类之间存在交叉耐药。但是,一些对其他喹诺酮类耐药的革兰阳性菌和厌氧菌对莫西沙星敏感。 对人类肠道菌群的作用:通过对两名志愿者服用莫西沙星后的研究观察到下列的变化:大肠杆菌,芽孢杆菌,普通拟杆菌,肠球菌,克雷白杆菌和厌氧菌如双歧杆菌,真杆菌和消化链球菌等的减少,这些变化在两周内可以恢复正常,未发现艰难梭菌毒素。 【毒理作用】盐酸莫西沙星与其他喹诺酮类药物一样,毒性靶器官均为血液系统(犬及猴的骨髓细胞减少)、中枢神经系统(猴的惊厥)和肝脏(大鼠、犬及猴的肝酶升高、单细胞坏死),这些变化均于大剂量或长期使用盐酸莫西沙星后出现。在犬体内进行的局部耐受性研究中,静脉注射盐酸莫西沙星后未出现局部不耐受的征象。经动脉内注射用药后,动脉周围软组织可见炎性变化,提示应避免经动脉内注射使用盐酸莫西沙星。1、遗传毒性:Ames试验中4株(TA1535,TA1537,TA98和TA100)为阴性,中国仓鼠卵巢HPRT的突变试验和大鼠原发肝细胞的UDS试验也均为阴性。与其他喹诺酮类药物一样,盐酸莫西沙星对TA102的Ames试验为阳性,可能是由于其抑制拓扑异构酶。体外试验显示大剂量莫西沙星(300μg/ml)可导致中国仓鼠的V79细胞出现染色体异常,然而,小鼠体内微核试验为阴性结果。此外,体内试验测定其对小鼠的显性致死试验为阴性。总之,体内试验的结果充分反应了其体内的基因毒性。2、生殖毒性:以大鼠、兔和猴进行的生殖毒性研究表明,盐酸莫西沙星可以通过胎盘。对大鼠(经口给药和静脉注射)和猴(经口给药)的研究表明,给予莫西沙星后未显示致畸作用和对生育力的损害。兔静脉给药20mg/kg可观察到骨骼畸形。该研究结果与已知的喹诺酮类药物对骨骼发育的影响一致。在人治疗浓度下,猴和兔的流产发生率增加。在大鼠,当经口给药剂量为使血药浓度在人治疗剂量范围内所推荐的最大药物剂量的63倍(按mg/kg体重计算)时,会出现胎鼠体重减少、流产增多、轻度延长孕期和一些雌性和雄性幼鼠自发活动增加等现象。3、致癌性:虽然有关盐酸莫西沙星致癌作用的常规长期研究尚未进行,但该药进行了基因毒性体外和体内试验。此外,对大鼠进行了对于人类的致癌作用加速试验(诱癌/促癌试验)。在大鼠的诱癌/促癌试验中未发现其有致癌的证据。4、光毒性:盐酸莫西沙星对光很稳定且潜在光毒性很低。体外试验和动物试验均显示盐酸莫西沙星的光毒性较其他喹诺酮类药物小。给予小鼠一些喹诺酮类药物并同时照射紫外线,这些喹诺酮类药物可增加紫外线的光致癌作用。尚未进行盐酸莫西沙星的光致癌作用研究,在志愿者的I期研究中证实盐酸莫西沙星无潜在的光毒性。4、心电图:高浓度的盐酸莫西沙星对心脏延迟整流钾电流有抑制作用,因此导致QT间期延长。犬经口给予大于90mg/kg莫西沙星进行毒理研究,导致血药浓度大于16mg/L,引起QT间期延长,但未出现心律失常。仅当累积静脉给药高于50倍人用剂量(>0.3g/kg)后,可导致血药浓度≥0.2g/L(高于静脉给药治疗浓度的30倍),可见可逆的非致命的室性心律失常。5、眼毒性:大鼠和猴重复给药6个月毒性试验未见眼毒性。在犬试验中,给予高剂量(≥60mg/kg)时血浆浓度≥20mg/L,可引起视网膜电流图的变化,个别动物出现视网膜萎缩。6、关节毒性:众所周知,喹诺酮类药物可以造成未成年实验动物的承重关节软骨的病变。可造成幼年犬的关节毒性的盐酸莫西沙星最小经口给药剂量是推荐最大治疗剂量(0.4g/50kg人体重)的4倍,其血药浓度比推荐治疗剂量时血药浓度高2-3倍。 【药代动力学】1、吸收、分布、代谢、排泄:(1)吸收:莫西沙星片口服后,在胃肠道中吸收良好。莫西沙星的绝对生物利用度为90%左右。莫西沙星与高脂餐(即脂肪中含500卡路里热量)同服时,不影响莫西沙星的吸收。莫西沙星与1杯酸奶同服不会对全身吸收程度或吸收率(AUC)产生明显影响。(2)分布:莫西沙星与血清蛋白的结合率约为30-50%,与药物浓度不相关。莫西沙星的分布容积在1.7-2.7L/kg之间。莫西沙星在体内广泛分布,组织浓度通常超过血药浓度。在口服或静脉滴注400mg莫西沙星后,已在唾液、鼻和支气管分泌物、窦粘膜、皮肤水疱液、皮下组织、骨骼肌肉和腹部组织和体液中检测到莫西沙星。口服或静脉滴注400mg莫西沙星后,各组织和体液中测得的莫西沙星浓度的总结见表。莫西沙星从组织的消除速率通常与血浆消除速率相似。(3)代谢:大约52%的口服剂量或静脉给药剂量以葡萄糖苷酸和硫酸盐结合的形式进行代谢。细胞色素P450系统不参与莫西沙星的代谢,并且不受莫西沙星的影响。硫酸盐共轭物(M1)占莫西沙星给药剂量的38%,主要通过粪便排出。大约14%的口服剂量或静脉给药剂量被转换成葡萄糖苷酸共轭物(M2),并通过尿液排出。M2的血药峰浓度约为母体药物的40%,而M1的血药浓度通常不足莫西沙星浓度的10%。细胞色素(CYP)P450酶的体外研究显示,莫西沙星不抑制CYP3A4、CYP2D6、CYP2C9、CYP2C19或CYP1A2。(4)排泄:大约45%的莫西沙星口服剂量和静脉给药剂量以原型药物排出(尿液中约20%,粪便中约25%)。共计96%±4%的口服剂量以原型药物或已知的代谢物形式排出。表观总体清除率和肾清除率的平均值(±标准差)分别为12±2L/h和2.6±0.5L/h。2、对特定人群的药代动力学:(1)老年人:16名健康的老年志愿者(8名男性;8名女性)和17名年轻的健康志愿者(8名男性;9名女性)在连续10天口服400mg莫西沙星后,莫西沙星的药代动力学未观察到年龄相关性变化。16名健康的男性志愿者(8名年轻人;8名老年人)单次口服200mg莫西沙星,年轻人与老年人的全身暴露程度(AUC和Cmax)未观察到统计学差异,消除半衰期保持不变。不需根据年龄调整剂量。在大型的III期研究中,在静脉滴注400mg莫西沙星后,老年患者在滴注结束时观察到的浓度与年轻患者相似。(2)儿童:尚未进行莫西沙星在儿童受试者体内的药代动力学研究。(3)性别:23名健康的男性受试者(19-75岁)和24名健康的女性受试者(19-70岁)每日一次口服400mg莫西沙星,连续服用10天之后,女性受试者的平均AUC和Cmax分别比男性受试者高8%和16%。当考虑体重差异时,男性受试者与女性受试者的莫西沙星药代动力学未见显著差异。对18名年轻的女性和男性进行一项单剂量400mg研究。该研究中(9名年轻女性和9名年轻男性),莫西沙星的药代动力学比较显示,性别未导致AUC或Cmax出现差异。不需根据性别调整剂量。种族在每日一次口服400mg莫西沙星后,日本男性受试者的莫西沙星稳态药代动力学与高加索人相似,平均Cmax为4.1mcg/mL,AUC24为47mcgŸh/mL,消除半衰期为14小时。(4)肾功能不全:轻度、中度、重度或终末期肾病中,莫西沙星的药代动力学参数未出现明显变化。肾损害患者(包括需血液透析(HD)或连续卧床腹膜透析(CAPD)的患者)不需调整剂量。在对肾功能从正常到重度损害的24名患者进行的一项单次口服给药研究中,中度(CLCR≥30和≤60mL/min)和重度(CLCR<30mL/min)肾损害患者的莫西沙星平均峰浓度(Cmax)分别降低21%和28%。这些患者的平均全身暴露量(AUC)增加13%。在中度和重度肾损害患者中,硫酸盐共轭物(M1)的平均AUC增加了1.7倍(最高达2.8倍),葡萄糖苷酸共轭物(M2)的平均AUC和Cmax分别增加了2.8倍(最高达4.8倍)和1.4倍(最高达2.5倍)。对CLCR<20mL/min的血液透析患者或连续卧床腹膜透析患者(8名血液透析患者,8名连续卧床腹膜透析患者)进行莫西沙星单次给药和多次给药,以研究药代动力学。在单次口服400mg莫西沙星后,这些血液透析和连续卧床腹膜透析患者的AUC与健康志愿者通常观察到的AUC相比,并不存在显著变化。血液透析和连续卧床腹膜透析患者的莫西沙星Cmax值,与健康志愿者的历史对照相比,分别降低45%和33%左右。这些患者的硫酸盐共轭物(M1)暴露量(AUC)增加了1.4-1.5倍。与健康受试者相比,葡萄糖苷酸共轭物(M2)的平均AUC增加了7.5倍,而平均Cmax值则增加了2.5-3倍。莫西沙星的硫酸盐和葡萄糖苷酸共轭物不具有生物活性,肾病患者(包括进行血液透析和连续卧床腹膜透析的患者)体内这些代谢物暴露量增加的临床意义尚未进行研究。血液透析患者或连续卧床腹膜透析患者每日一次口服400mg盐酸莫西沙星,连续服用7天后,莫西沙星的平均全身暴露量(AUCss)与健康志愿者通常观察到的平均全身暴露量相似。血液透析患者的稳态Cmax值比连续卧床腹膜透析患者低22%左右,但后者与健康志愿者具有可比性。血液透析和连续卧床腹膜透析只从体内排出少量的莫西沙星,分别为9%和3%左右。血液透析和连续卧床腹膜透析分别排出约4%和2%的葡萄糖苷酸代谢物(M2)。(5)肝功能不全:轻度、中度肝功能不全(Child-PughA、B级)不需调整剂量。不过,与肝功能不全相关的代谢紊乱可能会引起QT间期延长,这些患者应慎用本品。6名轻度肝功能不全(Child-PughA级)患者和10名中度肝功能不全(Child-PughB级)患者单次口服400mg莫西沙星后,莫西沙星的平均全身暴露量(AUC)分别为18名健康对照者的78%和102%,平均峰浓度(Cmax)分别为对照者的79%和84%。轻度肝功能不全组和中度肝功能不全组的莫西沙星硫酸盐共轭物的平均AUC分别增加了3.9倍(最高达5.9倍)和5.7倍(最高达8倍)。两组的M1Cmax平均增加了3倍左右(最高达4.7倍和3.9倍)。两组的莫西沙星葡萄糖苷酸共轭物(M2)的平均AUC增加了1.5倍(最高达2.5倍)。M2的平均Cmax分别增加了1.6倍和1.3倍(最高达2.7倍和2.1倍)。硫酸盐和葡萄糖苷酸共轭物暴露量增加的临床意义尚未进行研究。在一些参与临床试验的患者中,Child-PughC级患者(n=10)在首次静脉滴注或口服本品后莫西沙星达峰时间左右测得的莫西沙星及其代谢物的血药浓度与Child-PughA/B级患者(n=5)相似;此外,也与健康志愿者研究观察到的血药浓度相似。(6)潜在光敏感性:对32名健康志愿者(每组8名)进行一项紫外线(UVA和UVB)和可见光辐射引起的皮肤反应研究。该研究证实,本品与安慰剂相比,并不显示光毒性。在本品(200mg或400mg,每日一次)、洛美沙星(400mg,每日一次)或安慰剂给药前后,测定最小红斑剂量(MED)。在该研究中,本品的两种给药剂量测得的最小红斑剂量与安慰剂相比,不具有显著差异;而洛美沙星则显著降低了最小红斑剂量。3、患者实际使用过程中,很难确定各种不同氟喹诺酮类药物之间相对光敏感性/光毒性的产生原因,因为其他因素在确定受试者是否易发生该不良事件方面也起着重要作用:患者的皮肤色素沉着、日晒和人工紫外光暴露的频率和时间、涂抹防晒霜和穿上保护服、伴随使用其他药物、氟喹诺酮类药物的用量和持续时间。 【贮藏】盐酸莫西沙星片:遮光,低于25℃密封保存,盐酸莫西沙星片需贮藏于生产者的原包装内。将药品置于儿童触及不到的地方。盐酸莫西沙星氯化钠注射液:1、遮光,密闭,在15℃以上保存。在原包装中贮存。不要冷藏或冷冻。15℃以下可发生沉淀,室温下(15℃-25℃)可再溶解。因此建议不要将盐酸莫西沙星氯化钠注射液贮藏在冰箱中。2、将药品置于儿童触及不到的地方。 【有效期】36个月【执行标准】(1)盐酸莫西沙星片:进口药品注册标准JX20120212。(2)盐酸莫西沙星氯化钠注射液:进口药品注册标准JX20030339。 二、市场情况 莫西沙星属第四代喹诺酮类抗菌药物,是新一代抗菌谱广的抗生素,是国内第四大抗生素。其独特化学结构明显提高了对革兰氏阳性菌、革兰氏阴性菌、厌氧菌等常见病原菌的抗菌活性。主要用于治疗呼吸系统感染、泌尿生殖系统感染、腹腔感染、皮肤软组织感染等疾病。盐酸莫西沙星抗菌作用机制为干扰Ⅱ、Ⅳ拓扑异构酶。此外,其组织穿透力强,可在感染关键部位获得较高的药物浓度,达到快速治愈的效果,同时具有安全性高、耐药率低的优势。 本品于2004年进入国家医保目录乙类,为新一代氟喹诺酮类抗菌药物,经过临床试验,莫西沙星与克拉霉素、头孢呋辛、左氧氟沙星临床对照,在抗感染方面具有更大的优势。抗革兰阳性菌的活性约比环丙沙星强4倍,具有抗厌氧菌、支原体、衣原体等作用和光敏反应低的特点,且对一些耐药性细菌也有较好的抗菌效果。口服吸收良好的抗菌药物,在治疗社区获得性肺炎,慢性支气管炎急性发作,泌尿生殖系感染,急性鼻窦炎等感染性疾病中,疗效显著。 盐酸莫西沙星氯化钠注射液已成为医院多个科室抗感染治疗的一线用药,广泛应用于呼吸科、外科、妇产科等科室,是国家医保乙类和新版基药目录品种。据米内网数据显示,2017年在中国城市公立医院、县级公立医院、城市社区中心及乡镇卫生院(简称中国公立医疗机构)终端莫西沙星销售额达31.14亿元,城市公立医院占比超过90%。在剂型方面,莫西沙星有片剂和注射剂两种,其中,注射剂占80%,销售额超过25亿元,注射剂包括盐酸莫西沙星注射液和盐酸莫西沙星氯化钠注射液。 三、国内已上市批件信息经检索国家局数据库,现国家局已有本品种原料药、片剂和滴眼液及注射液生产批件记录如下:1、国药准字H20130042 盐酸莫西沙星 南京优科制药有限公司2、国药准字H20183412 盐酸莫西沙星氯化钠注射液 江苏正大丰海制药有限公司3、国药准字H20183246 盐酸莫西沙星片 东莞市阳之康医药有限责任公司4、国药准字H20183366 盐酸莫西沙星氯化钠注射液 成都正康药业有限公司5、国药准字H20183530 盐酸莫西沙星片 四川国为制药有限公司6、国药准字H20183411 盐酸莫西沙星氯化钠注射液 石家庄四药有限公司7、国药准字H20223606 盐酸莫西沙星氯化钠注射液 华夏生生药业(北京)有限公司8、国药准字H20223552 盐酸莫西沙星氯化钠注射液 石药银湖制药有限公司9、国药准字H20223586 盐酸莫西沙星氯化钠注射液 浙江医药股份有限公司新昌制药厂10、国药准字H20223434 盐酸莫西沙星氯化钠注射液 北京汇恩兰德制药有限公司11、国药准字H20223142 盐酸莫西沙星滴眼液 石家庄格瑞药业有限公司12、国药准字H20223332 盐酸莫西沙星滴眼液 北京汇恩兰德制药有限公司13、国药准字H20223319 盐酸莫西沙星氯化钠注射液 回音必集团江西东亚制药有限公司14、国药准字H20223256 盐酸莫西沙星滴眼液 杭州国光药业股份有限公司15、国药准字H20227050 盐酸莫西沙星滴眼液 沈阳兴齐眼药股份有限公司16、国药准字H20227045 盐酸莫西沙星滴眼液 江西科伦药业有限公司17、国药准字H20223059 盐酸莫西沙星滴眼液 武汉诺安药业有限公司18、国药准字H20223006 盐酸莫西沙星片 石家庄四药有限公司19、国药准字H20213879 盐酸莫西沙星注射液 山西威奇达光明制药有限公司20、国药准字H20213851 盐酸莫西沙星片 桂林南药股份有限公司21、国药准字H20213835 盐酸莫西沙星滴眼液 扬子江药业集团有限公司22、国药准字H20213609 盐酸莫西沙星片 瑞阳制药股份有限公司23、国药准字H20213564 盐酸莫西沙星滴眼液 齐鲁制药有限公司24、国药准字H20213563 盐酸莫西沙星滴眼液 齐鲁制药有限公司25、国药准字H20213553 盐酸莫西沙星片 扬子江药业集团江苏紫龙药业有限公司26、国药准字H20213520 盐酸莫西沙星氯化钠注射液 陕西金裕制药股份有限公司27、国药准字H20213500 盐酸莫西沙星片 湖南迪诺制药股份有限公司28、国药准字H20213403 盐酸莫西沙星氯化钠注射液 吉林四长制药有限公司29、国药准字H20213367 盐酸莫西沙星片 浙江海正药业股份有限公司30、国药准字H20213323 盐酸莫西沙星片 江苏天一时制药有限公司31、国药准字H20213266 盐酸莫西沙星滴眼液 沈阳兴齐眼药股份有限公司32、国药准字H20213280 盐酸莫西沙星滴眼液 江西科伦药业有限公司33、国药准字H20213236 盐酸莫西沙星滴眼液 珠海亿胜生物制药有限公司34、国药准字H20213165 盐酸莫西沙星滴眼液 华润紫竹药业有限公司 35、国药准字H20213157 盐酸莫西沙星滴眼液 上海信谊金朱药业有限公司36、国药准字H20203717 盐酸莫西沙星氯化钠注射液 杭州民生药业股份有限公司37、国药准字H20203516 盐酸莫西沙星片 四川科伦药业股份有限公司38、国药准字H20203433 盐酸莫西沙星片 湖南天济草堂制药股份有限公司39、国药准字H20203328 盐酸莫西沙星氯化钠注射液 北大医药股份有限公司40、国药准字H20203091 盐酸莫西沙星氯化钠注射液 海南爱科制药有限公司41、国药准字H20203073 盐酸莫西沙星氯化钠注射液 南京正大天晴制药有限公司42、国药准字H20203062 盐酸莫西沙星片 深圳信立泰药业股份有限公司43、国药准字H20203057 盐酸莫西沙星氯化钠注射液 天津红日药业股份有限公司44、国药准字H20193431 盐酸莫西沙星注射液 北大医药股份有限公司45、国药准字H20193432 盐酸莫西沙星片 南京圣和药业股份有限公司46、国药准字H20193406 盐酸莫西沙星片 重庆华邦制药有限公司47、国药准字H20193387盐酸莫西沙星片 南京优科制药有限公司48、国药准字H20193203 盐酸莫西沙星注射液 扬子江药业集团有限公司49、国药准字H20193201 盐酸莫西沙星注射液 南京正大天晴制药有限公司50、国药准字H20193171 盐酸莫西沙星注射液 四川美大康华康药业有限公司51、国药准字H20193110 盐酸莫西沙星氯化钠注射液 四川科伦药业股份有限公司52、国药准字H20193111 盐酸莫西沙星氯化钠注射液 山东齐都药业有限公司53、国药准字H20193112 盐酸莫西沙星氯化钠注射液 扬子江药业集团有限公司54、国药准字H20183096 盐酸莫西沙星片 北京福元医药股份有限公司55、国药准字H20130039 盐酸莫西沙星注射液 南京优科制药有限公司56、国药准字H20140125 盐酸莫西沙星注射液 成都天台山制药有限公司 四、申报记录经检索国家局药审中心近二年内受理数据,现审评中心已有本品种片剂和注射液申请记录,其中片剂按4类受理,注射液按4类受理。1CYHS2201780盐酸莫西沙星氯化钠注射液仿制4北京融英医药科技有限公司;东莞市普济药业有限公司;2022-10-202CYHS2201754盐酸莫西沙星滴眼液仿制4修正药业集团长春高新制药有限公司;修正药业集团长春高新制药有限公司;2022-10-183CYHS2201680盐酸莫西沙星滴眼液仿制4中山万汉制药有限公司;中山万汉制药有限公司;2022-10-104CYHB2201673盐酸莫西沙星氯化钠注射液补充申请4华夏生生药业(北京)有限公司;华夏生生药业(北京)有限公司;2022-09-155CYHS2201416盐酸莫西沙星片仿制4江苏联环药业股份有限公司;江苏联环药业股份有限公司;2022-08-306CYHS2201389盐酸莫西沙星滴眼液仿制4济宁光明制药有限公司;济宁光明制药有限公司;2022-08-297CYHS2201388盐酸莫西沙星滴眼液仿制4济宁光明制药有限公司;济宁光明制药有限公司;2022-08-298CYHS2201299盐酸莫西沙星滴眼液仿制4广州仁恒医药科技股份有限公司;广州大光制药有限公司;2022-08-169CYHS2201235盐酸莫西沙星氯化钠注射液仿制4西安万隆制药股份有限公司;西安万隆制药股份有限公司;2022-08-0410CYHS2201148盐酸莫西沙星滴眼液仿制4艾尔健康眼药(辽宁)有限公司;辽宁格林生物药业集团股份有限公司; 2022-07-2711CYHS2201130盐酸莫西沙星滴眼液仿制4杭州民生药业股份有限公司;杭州民生药业股份有限公司;2022-07-2212CYHS2201129盐酸莫西沙星滴眼液仿制4杭州民生药业股份有限公司;杭州民生药业股份有限公司;2022-07-2213CYHS2200702盐酸莫西沙星滴眼液仿制4江苏万高药业股份有限公司;江苏万高药业股份有限公司;2022-05-0614CYHS2200701盐酸莫西沙星滴眼液仿制4江苏万高药业股份有限公司;江苏万高药业股份有限公司;2022-05-0615CYHS2200621盐酸莫西沙星滴眼液仿制4陕西博森生物制药股份集团有限公司;陕西博森生物制药股份集团有限公司;2022-04-2116CYHS2200616盐酸莫西沙星氯化钠注射液仿制4辰欣药业股份有限公司;辰欣药业股份有限公司;2022-04-1917CYHS2200475盐酸莫西沙星滴眼液仿制4成都普什制药有限公司;成都普什制药有限公司;2022-03-2318CYHB2200547盐酸莫西沙星氯化钠注射液补充申请原6西安天一秦昆制药有限责任公司;陕西金裕制药股份有限公司;2022-03-2219CYHB2200533盐酸莫西沙星氯化钠注射液补充申请原6舒美奇成都生物科技有限公司;四川美大康华康药业有限公司;2022-03-2220CYHS2200429盐酸莫西沙星滴眼液仿制4国药集团三益药业(芜湖)有限公司;国药集团三益药业(芜湖)有限公司;2022-03-1121CYHS2200410盐酸莫西沙星氯化钠注射液仿制4安徽博诺美科生物医药有限公司;上海华源安徽锦辉制药有限公司;2022-03-0422CYHB2200372盐酸莫西沙星滴眼液补充申请4上海昊海生物科技股份有限公司;北京汇恩兰德制药有限公司;2022-03-0123CYHS2200306盐酸莫西沙星滴眼液仿制4江苏广承药业有限公司;江苏广承药业有限公司;2022-02-2124CYHS2200313盐酸莫西沙星滴眼液仿制4四川美大康华康药业有限公司;四川美大康华康药业有限公司;2022-02-1425CYHS2200195盐酸莫西沙星滴眼液仿制4浙江尖峰药业有限公司;浙江尖峰药业有限公司;2022-01-2626CYHS2200194盐酸莫西沙星滴眼液仿制4浙江尖峰药业有限公司;浙江尖峰药业有限公司;2022-01-2627CYHB2200193盐酸莫西沙星滴眼液补充申请4上海昊海生物科技股份有限公司;北京汇恩兰德制药有限公司;2022-01-2428CYHS2200165盐酸莫西沙星氯化钠注射液仿制4江苏长江药业有限公司;江苏长江药业有限公司;2022-01-2429CYHS2200145盐酸莫西沙星滴眼液仿制4合肥华威药业有限公司;合肥华威药业有限公司;2022-01-2130CYHS2200068盐酸莫西沙星片仿制4浙江永太药业有限公司;浙江永太药业有限公司;2022-01-1731CYHB2200063盐酸莫西沙星注射液补充申请原6江苏海岸药业有限公司;江苏海岸药业有限公司;2022-01-1332CYHS2200035盐酸莫西沙星滴眼液仿制4宁夏康亚药业股份有限公司;宁夏康亚药业股份有限公司;2022-01-1133CYHS2102358盐酸莫西沙星氯化钠注射液仿制4重庆圣华曦药业股份有限公司;重庆圣华曦药业股份有限公司;2022-01-04 五、专利查询经检索国家专利局数据库,本品种注册生产无专利限制。 六、参比信息略 参比制剂的选择:德国拜耳公司在我国进口的盐酸莫西沙星片作为参比制剂。规格:0.4g,商品名:拜复乐(Avelox) 参比制剂的选择:德国拜耳公司在我国进口的盐酸莫西沙星氯化钠注射液作为参比制剂。规格:250ml:莫西沙星0.4g与氯化钠2.0g,商品名:拜复乐(Avelox) 七、原料来源 经检索国家局数据库,现已有以下企业原料备案为A状态。 浙江医药股份有限公司新昌制药厂绍兴市新昌县城关镇新昌大道东路98号1.0kg/桶、5.0kg/桶、10.0kg/桶、25.0kg/桶2022/8/3A四川国为制药有限公司四川省眉山经济开发区新区A南京优科制药有限公司南京经济技术开发区恒竞路28号A瑞阳制药股份有限公司山东省沂源县城荆山路288号每袋25kg2019/10/25A四川国为制药有限公司;四川国为制药有限公司四川省眉山经济开发区新区;眉山市经济开发区新区20kg/袋2019/6/12A北京福元医药股份有限公司;北京福元医药股份有限公司北京市通州区通州工业开发区广源东街8号;河北省沧州市临港经济技术开发区华佗路5号5.0kg/袋,1袋/桶;10.0kg/袋,1袋/桶;25.0kg/袋,1袋/桶。2019/7/19A浙江新和成股份有限公司浙江省新昌县七星街道新昌大道西路428号1kg/桶,5kg/桶,25kg/桶2022/10/10A浙江国邦药业有限公司浙江省杭州湾上虞经济技术开发区纬五路6号每桶25kg。2018/9/29A江苏天一时制药有限公司;江苏天一时制药有限公司泰州市药城大道1号G08厂房;泰州市药城大道1号G08厂房每袋25公斤2018/8/27A桂林南药股份有限公司;桂林南药股份有限公司桂林市七里店路43号;桂林市七里店路43号10公斤/桶43322A四川新开元制药有限公司简阳市简城十里坝工业园区44834A浙江海正药业股份有限公司浙江省台州市椒江区滨海路56号A南京圣和药业股份有限公司南京化学工业园赵桥河南路68号25kg/袋2022/10/17A湖南天济草堂制药有限公司湖南省长沙市高新开发区环联路7号5kg/袋2022/10/20A北京莱瑞森医药科技有限公司 北京市朝阳区北苑东路19号院2号楼25层2508室50kg/桶2019/1/14A北大医药股份有限公司重庆市江北区寸滩水口5kg/袋,20kg/袋或按需包装2022/10/18A 瑞迪博士(北京)药业有限公司北京市朝阳区建国路91号院8号楼15层1509单元直接接触药品的药包材:聚乙烯袋包装规格:2kg/桶,10kg/桶A山西振东泰盛制药有限公司山西省大同市经济技术开发区第一医药园区A山西同达药业有限公司山西省大同市经济技术开发区第一医药园区1kg/袋A青松医药集团股份有限公司S天津自贸试验区(空港经济区)领航路16号直接接触药品的药包材:聚乙烯袋包装规格: 50g/桶, 100g/桶,200g/桶, 300g/桶, 400g/桶, 500g/桶, 600g/桶, 700g/桶, 800g/桶, 900g/桶, 1kg/桶, 2kg/桶, 3kg/桶, 4kg/桶, 5kg/桶, 6kg/桶, 7kg/桶, 8kg/桶, 9kg/桶, 10kg/桶, 11kg/桶, 12kg/桶, 13kg/桶, 14kg/桶, 15kg/桶, 16kg/桶,17kg/桶, 18kg/桶, 19kg/桶,20kg/桶A湖南迪诺制药有限公司浏阳经济技术开发区康平路165号每袋12kgA四川协力制药股份有限公司四川省彭州市医药工业园区1kg/袋2022/9/29A陕西大生制药科技有限公司西安沣京工业园振兴路8号5kg/袋2022/9/30A河北国龙制药有限公司河北省石家庄经济技术开发区兴业街9号5Kg/袋。2022/9/29A深圳信立泰药业股份有限公司深圳市宝安区西乡镇凤凰岗华宝工业区1号包装规格为5Kg/桶和10Kg/桶2022/9/7A江苏正大丰海制药有限公司盐城市大丰区南翔西路266号2.0kg/袋2022/10/18A珠海润都制药股份有限公司珠海市金湾区三灶镇机场北路6号每桶15kgA浙江新和成股份有限公司浙江省新昌县七星街道新昌大道西路428号10kg/桶,24kg/桶2022/10/10A成都通德药业有限公司成都海峡两岸科技产业开发园柳台大道B段2kg/袋2022/9/7A山东齐都药业有限公司淄博市临淄区人民东路28号每桶5千克2022/9/30A宜昌东阳光长江药业股份有限公司湖北省宜昌宜都市滨江路62号15kg/桶2022/9/7A天方药业有限公司河南省驻马店市光明路2号15kg/桶A重庆华邦胜凯制药有限公司重庆市合川区南津街街道办事处荣军路666号5kg/袋2022/9/30A天津红日药业股份有限公司天津新技术产业园区武清开发区泉发路西5kg/袋2022/10/19A四川青木制药有限公司;四川青木制药有限公司四川省眉山市东坡区经济开发区东区顺江大道南段55号;四川省眉山市东坡区经济开发区东区顺江大道南段55号1kg/袋;2kg/袋;5kg/袋2022/9/29A扬子江药业集团江苏海慈生物药业有限公司江苏省泰州经济开发区滨江工业园泰镇路8号5kg/袋2022/9/27A陕西太白山制药有限责任公司陕西省宝鸡市太白县咀头镇南大街2022/10/21A连云港润众制药有限公司连云港经济技术开发区大浦工业区金桥路16号2022/10/10A 八、可申报剂型原料药、片剂(4类)、注射液(4类)

可开发剂型: 原料、片剂。工艺研发进度: 原料和制剂已有多次中试经验,可包过BE。服务内容: 原料和制药药学研究及临床试验。 一、品种概况(片剂说明书) 【药品名称】通用名称:利格列汀片英文名称:Linagliptin Tablets拼音全码:OuTangNing(LiGeLieTingPian)10HeZhuang【成份】本品主要成份为利格列汀。【性状】本品为浅红色原形双凸,斜边薄膜衣片。一面凹刻BI公司标志,另一面凹刻“D5”,除去包衣后显白色或类白色。【适应症/功能主治】利格列汀片是一种二肽肽酶-4(DPP-4)抑制剂适用作为2型糖尿病成年中膳食和运动的辅助治疗改善血糖控制。【用法用量】利格列汀片的推荐剂量是5mg每天1次。TRADJENTA可与食物或无食物服用。【不良反应】用TRADJENTA治疗患者报道≥5%并常比用安慰剂治疗患者更多的不良反应包括鼻咽炎;用TRADJENTA和磺酰脲类联用治疗患者与安慰剂和磺酰脲联用治疗患者比较低血糖症报道更为常见;随机化至利拉利汀患者更常报道胰腺炎(1每538人年相比对比药零每433人年)。【禁 忌】禁用于对利格列汀有过敏史,诸如荨麻疹、血管性水肿或支气管高敏反应的患者。【注意事项】一般信息本品不能用于治疗1型糖尿病患者,也不能用于治疗糖尿病性酮症酸中毒。与已知会引起低血糖的药物合用已知促胰岛素分泌药和胰岛素会引起低血糖。在一项临床试验中,利格列汀与促胰岛素分泌药(例如,磺脲类)合用引起的低血糖发生率,高于安慰剂。在重度肾功能不全患者中利格列汀与胰岛素合用会引起较高的低血糖的发生率。因此,与利格列汀合用时,需要较低剂量的促胰岛素分泌药或胰岛素,从而减少低血糖的风险。大血管的结果尚无临床研究建立利格列汀或其他降糖药能够降低大血管风险的确切证据。对驾驶和操作机器能力的影响未进行过对驾驶和机械操作能力影响的研宄。但是,应提醒患者发生低血糖症的风险,尤其是在和磺脲类联合使用的情况下。 【儿童用药】低于年龄18患者中TRADJENTA的安全性和有效性尚未确定。【老年患者用药】老年患者无需调整剂量。在15项利格列汀的临床试验中,共有4040名2型糖尿病患者接受了利格列汀5 mg 治疗:1085名患者(27%)为65岁或以上,而131名患者(3%)为75岁或以上。在这些患者中,有2566名参加了12项双盲安慰剂对照研宄:591名(23%)为65岁或以上,82名(3%)为75岁或以上。在65岁及以上的患者和较年轻的患者之间,没有发现总体安全性或有效性的差异。因此对老年人群并无剂量调整建议。虽然利格列汀的临床研宄中未发现老年和年轻患者之间的差异,但是不能排除某些老年个体会更为敏感的可能性。【孕妇及哺乳期妇女用药】 妊娠期 在大鼠和家兔中,进行了生殖研究。但是,并没有在妊娠妇女中进行充分的、对照良好的研究。因为动物的生殖研宄并不是总能预测人类的反应,因此除非确有需要外,本品不得在妊娠期间使用。 利格列汀在子代器官形成期给予孕鼠,剂量达30mg/kg,给予孕家兔,剂量达150mg/kg,并无致畸性,根据AUC暴露水平,约为临床剂量的49和1943倍。在大鼠和家兔中,引起母体毒性的利格列汀剂量,在大鼠中(临床剂量的1000倍),引起骨骼骨化的发育延迟以及大鼠的胚胎丢失略有增加;在家兔中(临床剂量的1943倍),会引起胚胎吸收增加以及内脏和骨骼变化。 利格列汀从妊娠第6天开始,给予雌性大鼠直至哺乳第21天,在母体毒性剂量下(暴露水平>临床剂量1000倍),会引起雄性和雌性后代的体重减轻以及身体和行为发育迟缓。大鼠暴露水平达临床剂量的49倍,在后代中未观察到功能、行为或生殖毒性。 利格列汀口服给药,在雌性大鼠和家兔中,能够透过胎盘到达胎儿。 哺乳期 现有的动物数据表明,利格列汀可以分泌到乳汁中,乳汁/血浆比为4:1。尚不明确该药物是否会分泌到人乳汁中。因为许多药物都会在人乳汁中分泌,故当哺乳的妇女接受利格列汀给药时必须非常小心。 【药物相互作用】P-糖蛋白/CYP 3A4诱导剂:当与联合给药(如,与利福平[rifampin])可能减低TRADJENTA的疗效。强烈建议使用另外治疗。 【药物过量】如果发生利格列汀过量,即刻至医院就诊。还应当根据患者的临床情况采取常用的支持措施(例如,清除胃肠道中未吸收的药物,进行临床监测,以及支持性治疗)。利格列汀不太可能可以通过血液透析或腹膜透析清除。 在健康受试者中开展的对照试验中,利格列汀单次给药剂量达600mg(相当于推荐日剂量的120倍),没有与药物剂量相关的临床不良药物反应。在人类中没有600mg以上剂量的使用经验。 【药理毒理】 药理作用 利格列汀是二肽基肽酶4(DPP-4)抑制剂,DPP-4能够降解肠促胰岛素激素样多肽-1(GLP-1)以及葡萄糖依赖性促胰岛素多肽(GIP)。利格列汀能够升高活性肠促胰岛素激素的浓度,以葡萄糖依赖性的方式刺激胰岛素释放,降低循环中的胰高血糖素水平。 这两种肠促胰岛素激素都参与了葡萄糖稳态的生理调节。一天中肠促胰岛素分泌维持较低的基础水平,进餐后立即升高。在葡萄糖水平正常或升高的条件下,GLP-1和GIP能增加胰腺β-细胞胰岛素的生物合成和分泌。此外,GLP-1还能减少胰腺α细胞的胰高血糖素分泌,肝葡萄糖排出量减少。 药效学 利格列汀能与DPP-4进行可逆的结合,从而升高肠促胰岛素激素浓度。利格列汀促进胰岛素的分泌作用呈葡萄糖依赖性,同时能减少胰高血糖素分泌,从而更好的调节体内的葡萄糖平衡。在体外,利格列汀在接近治疗暴露水平下,能够选择性地与DPP-4结合,选择性地抑制DPP-4,但是并不抑制DPP-8或DPP-9活性。 心脏电生理 在一项随机、安慰剂对照、阳性对照、4-治疗组交叉的研究中,36名健康受试者接受利格列汀5mg,利格列汀100mg(推荐剂量的20倍),莫西沙星和安慰剂给药。在推荐剂量5mg或100mg剂量,均未观察到QTc的升高。在100mg剂量,利格列汀的峰血浆浓度水平大约是5mg剂量给药后峰浓度的38倍。 毒理研究? 遗传毒性 利格列汀Ames试验、人淋巴细胞染色体畸变试验和体内微核试验结果均为阴性。 生殖毒性 在大鼠生育力与早期胚胎发育毒性试验中,利格列汀剂量为10、30、240mg/kg(暴露量约为临床剂量5mg/天的943倍),未见对早期胚胎发育、交配、生育力以及受孕的不良影响。 致癌性 大鼠2年致癌性试验中,利格列汀剂量为6、18和60 mg/kg(高剂量暴露量约为临床剂量的418倍),未见肿瘤发生率增加。小鼠2年致癌性试验中,利格列汀剂量为8、25、 80 mg/kg,雄性动物与雌性动物在剂量分别高达80 mg/kg或25 mg/kg(暴露量分别约为临床剂量的35、270倍)未见肿瘤发生率增加,但雌性小鼠在剂量为80 mg/kg(暴露量约为临床剂量的215倍)时可见淋巴瘤发生率增加。 【药代动力学】在健康受试者和2项糖尿病患者中,研究了利格列汀药代动力学的特点。健康受试者单次口服5mg剂量后,血浆峰浓度大约在给药后1.5小时(Tmax)发生;平均血浆曲线下面积(AUC)为139nmol·h/L,最大血浆浓度(Cmax)为8.9nmol/L。利格列汀的血浆浓度以至少二相的方式消除,终末半衰期较长(>100小时),这与利格列汀与DPP-4进行可饱和的结合有关。半衰期较长并不会引起药物的蓄积。经过5 mg剂量利格列汀多次口服可以确定,利格列汀蓄积的有效半衰期约为12个小时。每日给药1次以后,5mg利格列汀在第3次给药以后达到了稳态血药浓度,在稳态时达到的Cmax和AUC与第一次给药相比,增加了1.3倍。利格列汀AUC的受试者自身变异系数和受试者间变异系数都较小(分别为12.6%和28.5%)。在1~10mg剂量范围内,利格列汀的血浆AUC以低于剂量比例的方式增加。利格列汀在健康受试者中的药代动力学通常与2型糖尿病患者相似。详见说明书。 【贮 藏】密封,阴凉。
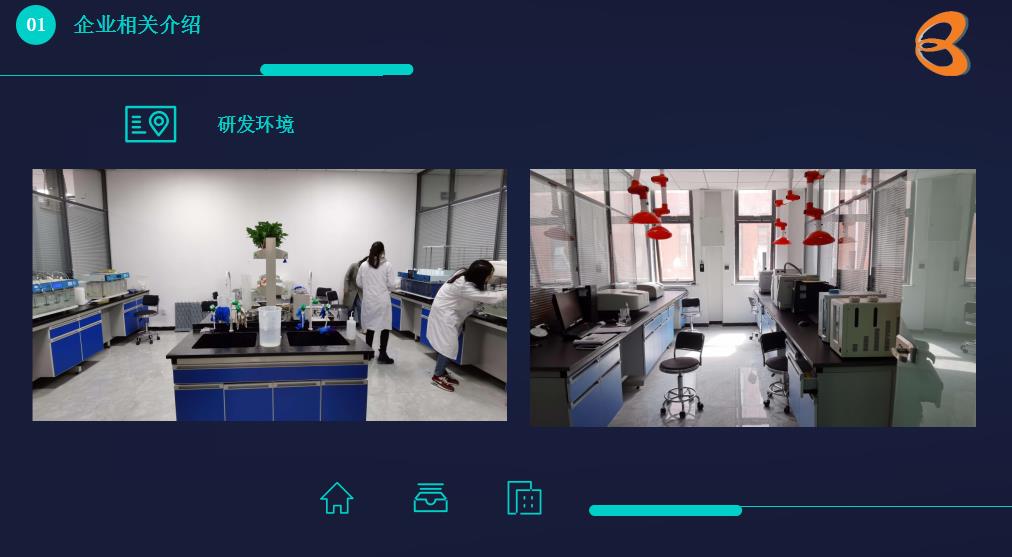
【公司介绍】 山东博创医药技术有限公司成立于2020年9月,公司专业的技术团队采用现代医药学理论和高新技术开展多学科综合性研究,专业从事新药研发、仿制研发、天然药物开发、原料备案、药品一致性评价及新药临床监督等技术服务,致力于成为集研发、生产、销售为一体的多元化高新技术企业。 现有研发人员近50人,部门负责人全部具有12年+从业经验,3年以上研发人员,占80%以上,团队稳定。公司目前已经建立了完善的研发管理体系;现行文件为02版,研发管理合计228个文件;目前正在准备B证申请文件,体系将进一步提升,达到GMP要求。【位置】济南市高新区春兰路1177号银丰国际生物城 优享济南生命科学城及高新东区千亿生物医药产业集聚资源【企业团队】部门负责人全部具有15年+从业经验;10年以上研发经验技术骨干,占30%以上;3年以上研发人员,占80%以上,团队稳定【管理体系】公司建立了完善的研发管理体系;曾接受扬子江、鲁南、济川、力捷迅等数十家药企的研发审计;2020.12 顺利通过国家局口服固体制剂 一致性评价研制现场核查;2022.02 顺利通过国家局原料及注射剂 4类仿制药研制现场核查;2023.07 顺利通过国家局口服固体制剂 研制现场核查;

氢溴酸沃替西汀及片 【项目名称】氢溴酸沃替西汀及片 【注册分类】化药3.1类 【是否医保】无 【剂型】片剂【规格】5mg、10mg、15mg、20mg【药理药效】vortioxetine 是5-HT3、5-HT7、5-HT1D受体拮抗剂、5-HT1B受体部分激动剂(Ki=33nM)、5-HT1A受体激动剂(Ki=15nM)、5-HT转运体抑制剂(Ki=1.6nM),通过调节5-HT起到抗抑郁作用。【适应症】治疗成人重症抑郁障碍。 【用法用量】 (1)推荐开始剂量是10 mg口服给予每天1次不受食物影响 (2)当耐受剂量应增加至20 mg/day。 (3)对不能耐受较高剂量患者考虑5 mg/day。 (4)BRINTELLIX可突然停药。但是,建议如可能完全终止前1周15 mg/day或20 mg/day剂量减低至10 mg/day。 (5)在已知CYP2D6代谢差患者中最大推荐剂量为10 mg/day。 【国内外上市信息】2013年9月30日,FDA批准武田制药与灵北制药共同研发的沃替西汀(vortioxetine)用于治疗成人重症抑郁障碍。该药物被认为是一种新型多模型抗抑郁药物,体外研究显示其可拮抗5-HT3、5-HT7及5-HT1D受体,激活5-HT1A受体,部分激活5-HT1B受体及抑制5-HT的转运。 沃替西汀(vortioxetine)是Lundbeck开发的又一抗抑郁药物,旨在取代专利到期药物西酞普兰。 【知识产权情况】化合物专利2022年到期。 【CDE申报情况】截止到2014年9月份,尚未有国内企业申报。【市场前景】 世界卫生组织发布的报告显示,全球有超过3.5亿人患有抑郁性疾病,治愈率与发病率的落差导致抑郁症患者人数呈现逐年增长的态势。根据IMS 的统计数据,全球精神疾病用药规模已经超过360 亿美元,占药品销售总额的5%。抑郁症及相关精神疾病治疗市场的升温,直接刺激了制药开发热情。但是,随着抑郁症治疗市场品牌药物专利期满,以及通用名仿制药物的激烈竞争,百优解、赛乐特、怡诺思、左洛复等专利药的销售急转直下,也导致近几年抑郁症治疗市场销售额逐年下滑。2013年,全球七大药市500强药品市场上,抑郁症用药总销售额为95亿美元,比上一年下滑1.02%。近两年,抗抑郁新药的上市,或将使下滑局面峰回路转。国外分析家预测,2020年该类药物市场规模仍将达到140亿美元,抑郁症药物市场将成为中枢神经系统疾病领域最大的分支。 重型抑郁症(MDD)的主要特征为心境改变及其他一系列的症状,对患者的工作能力、睡眠、学习、饮食及享受当下的快乐产生困扰。抑郁症状可在一生中多次复发,但部分患者也可能仅经历一次。MDD的其它体征和症状包括对日常活动失去兴趣、体重或饮食发生明显变化、失眠或嗜睡、坐立不安/来回走动(激越)、疲劳、罪恶感或无价值感、思维迟缓、注意受损、自杀未遂或自杀想法。并非所有MDD患者均经历相同的症状。“重型抑郁症具有致残性,使人不能正常工作,”FDA药物评价与研究中心精神病学产品部门代理主任、医学博士Mitchel lMathis称,“鉴于药物对个体的影响不同,所以抗抑郁治疗选择的多样化是很重要的。” 在6项临床研究中,MDD成人患者被随机给予Brintellix或安慰剂,这6项临床研究证实Brintellix可有效抗抑郁。另有一项临床研究显示,Brintellix降低了患者治疗后复发的可能性。这些研究在美国及其它国家完成。灵北公司说,在最近的一项研究中,经过四周的治疗,证明Brintellix比阿戈美拉汀更显著有效。据临床试验报道,Brintellix最常见的副作用包括恶心、便秘及呕吐。Brintellix片剂可供使用的规格有5mg、10mg、15mg和20mg。Brintellix与其它抗抑郁药均有黑框警告及用药指南,以提醒患者和医生,这些抗抑郁药在初始治疗期间可能增加儿童、青少年及18至24岁青壮年自杀观念及行为的风险;而研究显示,24岁以上成年人的自杀风险似乎没有增加,而65岁及以上年龄成年患者的该风险或降低。开始抗抑郁治疗时,应严密监测患者的病情恶化及自杀行为。 全球领先的制药与医疗保健问题研究和咨询公司——决策资源公司(Decision Resources)日前发布报告预测,在2022年,灵北(Lundbeck)和武田(Takeda)的新兴抗抑郁药沃替西汀Brintellix在美国、法国、德国、意大利、西班牙、英国、日本市场中将成为重磅药物。根据迄今取得的数据,鉴于其对认知的积极影响及可耐受的副作用属性,Brintellix预计将成为单相抑郁症市场中最成功的新药。根据汤姆斯路透社制药版报道,德意志银行的行业分析师预测该新药的潜力销售额会超过15亿美元,并有可能卖到一年30亿美元,尽管舆论预测2016年的销售额将为更为温和的5亿美元。

一、 概述 通用名:丁酸氯维地平 英文名:Cleviprex butyrate产品名称:4-(2,3-二氯苯基)-1,4-二氢-2,6-二甲基-3,5-吡啶二甲酸甲基(1-丁酰氧基)甲脂 分子式:C21H23CI2NO6 分子量:456.32 CAS登录号:167221-71-8注册分类:3.1剂型:注射乳剂 给药途径:静脉注射 规格:25MG/50ML(0.5MG/ML)\50MG/100ML(0.5MG/ML) 二:研发背景 近年来,随着生活水平的不断提高、老年人口的增长,高血压正成为一种患病率极高的常见病。目前尚无有效的手段可以根治高血压,一旦患上将伴随终身并引起很多其他相关疾病、据国家卫生部统计,2003年中国居民高血压患病率为26.2‰,其中城市居民高达54.7‰,患病率之高居各种慢性病之首。高血压患病率近年来在中国呈上升趋势,从1998年至2003年,几乎翻了一倍,农村居民患病率增长一倍有余。高血压正严重危害人类生活水平及健康。同时“一次得病,终身用药”的特点和庞大的患者群将为降压药物提供巨大的市场潜力。 根据流行病学资料,我国现有高血压患者2亿人,每年新发脑卒中200万人,新发心肌梗死50万人,死于心脑血管病300万人,每年主要心血管的直接医疗费达1300亿元,其中用于高血压的医疗费达366亿元。 在过去30年中,科研人员开发了几类新药:60年代的利尿剂,70年代的B-受体阻滞剂,80年代的钙通道拮抗剂和血管紧张素转化酶抑制剂(ACEI)。经过多年的临床应用,这些药物治疗效果得到了临床医生及患者的肯定。但在临床应用过程中,这些药物的局限性也日渐明显。 在各类抗高血压药物中,钙拮抗剂占有40%以上的市场,居高榜首。血管紧张素转换酶抑制剂的市场份额逐年缓慢萎缩,而血管紧张素Ⅱ受体拮抗剂的市场份额则从2004年的11.5%快速攀升到2007年的24.65%。 从各种的份额上看,2005年排名前5位的品种的份额为47.5%,2007年排名前5位品种的市场为44.33%,可见该市场的集中度较高。在2007年前20位品种中,钙拮抗剂有6个,占40.21%的市场份额;血管紧张素转换酶抑制剂有5个,占22.76%;血管紧张素Ⅱ受体拮抗剂有3个,占10.71%;β -受体阻滞剂也有3个,占8.48%。在整个抗高血压药物医院市场中钙拮抗剂占据40%以上的市场份额,排在各类药物首位。 钙拮抗剂可用于各种程度的高血压,尤其适用于高血压或并发稳定性心绞痛的老年患者。但心脏传导阻滞和心力衰竭患者禁用非二氢吡啶类拮抗剂;不稳定性心绞痛和急性心肌梗死时禁用速效二氢吡啶类拮抗剂。临床治疗高血压应优选钙拮抗剂的长效制剂。资料显示,第一代CCB为原始型药物,包括硝苯地平,维拉帕米和硫氮唑酮,因其作用时间短,又称短效CCB。第二代CCB药物动力学特征有所改善或血管选择性有所提高。本类药物存在的问题是,生物利用率仍较低,谷峰血浆浓度波动大,作用的突然消失而导致可能的疗效快速消失,临床效应仍不一定。第三代CCB为特殊的长效制剂,其分子结构本身作用时间长,疗效不受胃肠功能和食物的影响,也可以喝绝大多数药物一起服用。 三:研究进展 丁酸氯维地平是由英国AstraZeneca公司研制的第三代新型短效二氢吡啶类钙通道拮抗剂,2008年8月首次在美国上市,商品名Cleviprex。本品为注射乳剂,用于治疗不宜口服或者口服无效的高血压,也可用于治疗外科手术后急性血压升高。 近10年中,尚无静脉注射的抗高血压新药上市。本品是第一个静脉注射用二氢吡啶类钙通道阻滞药。在美国获准上市是基于对1406例治疗和手术患者6项Ⅲ期临床研究的结果。所有Ⅲ期临床研究均其主要终点指标。本品起效快,作用消除也快,可递增剂量准确的控制血压。与目前许多静脉注射经肾和(或)肝代谢的抗高血压药不同,其在血液和组织中代谢,因而不在体内蓄积。 该品作为一种新型静脉注射用抗高血压,代表了当前高血压治疗中的一大进步,其可以在危重病护理中快速、精确地控制高血压。来自急诊室、手术室和重症监护室的综合资料显示,丁酸氯维地平的上市,将为医生控制患者血压时提供新的、重要的临床手段。 本品国内尚无制剂进口。因专利限制,本品国内尚无申报,不过已经有单位进行合成研究,并无原料成品对外销售。 本品25毫克/50毫升/支 10支/盒,美国售价为3000美金,约合人民币2万。 四、临床试验1、心脏手术中氯维地平与安慰剂对照,考察降血压临床效果152名计划进行心脏手术的患者,当前或者近期患有高血压。分别进行氯维地平和安慰剂治疗。研究结果表明:患者给以氯维地平,治疗成功率9205%,治疗失效率明显降低,约为7.5%,而安慰剂对照组治疗失败率为8207%。氯维地平在中间值60min既实现目标血压,氯维地平给药期间心率稍有升高。每一组的不良反应类似。表明氯维地平可以有效的降低血压,达到目标血压水平,同时耐受性良好。2、比较在治疗心脏手术患者急性高血压中氯维地平、硝酸甘油、硝普钠、尼卡地平的疗效 心脏手术期间急性高血压难以处理,并可能影响患者。在评估氯维地平在高血压患者手术期间处理安全性的试验中,对比氯维地平、硝酸甘油、硝普钠、尼卡地平的安全性与有效性。 三组预期、随机、公开平行对比研究中,分别分析在61个临床中心进行的心脏手术患者应用氯维地平、硝酸甘油、硝普钠、尼卡地平的数据。共计招募1964名患者,其中1512名符合试验标准。患者被随机分为三组平行对比处理试验组。主要的试验终点是30天内死亡发生率、心肌梗死、中风或者肾功能紊乱。 研究结果显示:对比其他处理方式对比其他处理方式,氯维地平治疗组心肌梗死、中风或肾功能紊乱的发生率与其他治疗组没有差异。氯维地平治疗组死亡率与硝酸甘油或尼卡地平组无差异,硝普钠治疗组患者的死亡率较氯维地平治疗组的死亡率明显较高(P=0.004)。 在将血压维持在预期的血压范围内,氯维地平较硝酸甘油或硝普钠更为有效,与尼卡地平相当。但是当血压范围狭窄时,与尼卡地平相比较,氯维地平较少发生偏出血压范围的情况。 试验结论:对于治疗心脏手术期间患者的急性高血压,氯维地平是一种安全安全有效的降血压药物。3、治疗难治性高血压 据中国医药报讯 最近完成的一项名为VELOCITY的研究显示,对于合并肾功能不全或急性心力衰竭的严重高血压患者,氯维地平可能是一种有前景的药物。VELOCITY是一项多中心,开放标签临床研究,入选126名严重的高血压患者(持续收缩压>180毫米汞柱)。患者接受氯维地平静注2毫克/小时,≥3分钟,然后根据需要每3分钟倍增剂量,达到最大32毫克/小时,持续18-96小时。每例患者预先设定最初的收缩压靶标范围,要求30分钟内达到靶标。 研究入选了24名肾功能不全患者。多数患者在30分钟内达到最初靶标范围,并可有效持续18小时。另外,研究中心没有患者发生低血压。 研究还入选了19例急性心力衰竭患者。这些患者平均至ITR的时间为11.3分钟,开始治疗3分钟内低于ITR的患者为0.在剂量滴定期间,3分钟时平均收缩压下降7%,30分钟时下降24%。18小时的时候,氯维地平平均输注率为8毫克/小时,有16例患者的收缩压由基线下降50毫米汞柱。 五、相关的钙拮抗剂 现介绍位于前三的钙拮抗剂抗高血压药物1、 氨氯地平 属于第三代钙拮抗剂。辉瑞公司的产品称“活络喜”,于1992年7月31日获FDA批准上市。该药于1993年投放中国市场,于1993年12月1日在中国获得的药品行政保护,于2001年6月1日期限届满。2004年该药居全球畅销药排名的第四位,世界性销售额44.63亿美元,增长3%。2007年销售30.01亿美元,同比下降了38%。该药半衰期长达35-50小时,口服一次可缓和平稳降压。该药在降压的同时可控制心肌缺血,改善心绞痛发生,并对心肌无负性肌力作用,所以对房室传导阻滞伴有高血压的病人,使用此药无顾虑。故心力衰竭病人合并患有高血压和心绞痛时,该药为首选。2007年在中国整个抗高血压药物市场中氨氯地平占据14.53%,排在钙拮抗剂类药物第一位。在中国氨氯地平市场中,美国辉瑞有限公司的产品(商品名:络活喜)占据了62.25%的份额,其他国产品牌只能争夺余下三成多的市场。这其中以北京赛科制药有限公司最为突出,该公司产品(商品名:压氏达)占有16.92%的市场份额,其他品牌如:安内真(苏州东瑞),麦利平(陕西超群)兰迪(扬子江药业)等。2、 硝苯地平 拜耳公司产品的商务名为Adalat,于1995年11月27日获FDA批准上市,多年来文具全球畅销药行列,2000年为第41位,1999年为第38位。2005年世界性销售额为6.59亿欧元。辉瑞公司的商品名为Procardix,于1969年9月6日获准上市。全球畅销药排名由1999年的第86位下落到2000年的161位,2000年世界性销售额为3.12亿美元。2007年在中国整个抗高血压药物医院市场中硝苯地平新韩剧10.62%,排在钙拮抗剂类药物第二位,属于比较成熟的品种,生产企业众多。在中国硝苯地平市场中,德国拜耳公司生产的原研药市场份额达到79.40%,高居榜首,其商品名为“拜新同”。排名2-4位的是国内药企的品牌,依次是“欣然”(上海现代制药)、“伲福达”(青岛黄海制药)和扬子江药业的缓释片,“欣然”在国产品中稍占优势。3、 非洛地平 该药由阿斯利康公司研发,商品名叫“波依定”。于1991年获FDA批准,在2000年全球畅销药排名中位居102位,2007世界性销售额为2.71亿美元,比2006年略微下降1%。该药日服一次可控制24小时血压,适用于糖尿病、肾功能不全和哮喘的高血压患者。该药于1995年进入中国市场。目前其临床用药占抗高血压的份额由2004年的5.89%下滑至2007年的5.70%,变化不大,排在钙拮抗剂类药物第三位。国内主要生产厂家:江苏无锡阿斯利康、江苏联环药业、北京协和药业和山西康宝生物等。在中国非洛地平市场中,阿斯利康公司的品牌“波依定”一枝独秀《占有8成以上的市场份额。山西康宝生物制品股份有限公司的非洛地平缓释片也占有6.76% 的份额排在第三位。其他品牌市场份额都很小。 其中硝苯地平为第一个上市的此类药,此外尚有尼莫地平,尼索地平、尼卡地平、左旋氨氯地平等。 六、项目特色1、第一静脉注射用二氢吡啶类钙通道阻滞药;2、地平类降血压药物目前临床上广泛应用,临床认可度高;3、降血压,尤其是手术期间血压的急性升高效果明显;4、与同类药物尼卡地平相比,疗效具有一定的优势;5、工艺具有一定的难度,步骤较长;6、本品尚处于专利保护期,至2014年,国内尚无申报;7、本品制剂价格贵 七、小结 丁酸氯维地平作为第一个静脉注射用二氢吡啶钙通道阻滞剂,应用于降血压尤其是心脏手术期间的血压急性升高,疗效显著,已获得FDA的批准。地平类降压药是降血压药物中市场占有量最高,应用最为广泛的药物,销售额一直占据优势地位。可以预期,本品具有较高的开发价值。尽管本品受专利限制,但是国内已经开展前期研究工作,并已经得到较成熟的生产工艺。相信随着专利期截止,国内将有诸多厂家申请本品上市。