嗜酸性胃炎(EG)、嗜酸性十二指肠炎(EoD)和嗜酸性食管炎是一类严重的炎症性疾病,表现为胃、十二指肠和食管外嗜酸性粒细胞水平升高。目前没有针对此种疾病的有效疗法,采用全身性的类固醇激素疗法能够改善疾病症状,但长期使用会带来严重副作用。SIGLEC8因为具有强大的嗜酸性粒细胞促凋亡和肥大细胞抑制活性,并选择性表达在这些关键的炎症效应细胞的作用,被认为是很有前途的抗炎靶点。靶点概述Siglecs(结合唾液酸的免疫球蛋白型凝集素)是主要在造血系统细胞上发现的一类免疫调节受体。迄今为止,已在人类中鉴定出14种SIGLEC,主要在各种白细胞群上表达。[1]根据进化上的保守程度分为进化保守型和非保守型两类SIGLEC。保守型SIGLEC由SIGLEC1、SIGLEC2、SIGLEC4和SIGLEC15组成,它们在哺乳动物中存在直系同源基因;非保守型SIGLEC则由其他成员组成,在哺乳动物物种中并不存在真正的同源基因,被称为CD33相关基因 SIGLEC,其中就包括SIGIEC8。图1. SIGLEC8促进嗜酸性粒细胞凋亡并减少肥大细胞炎症反应&SIGLEC8的潜在聚糖配体[2]SIGLEC8是属于SIGLEC 家族 CD33样亚家族成员,全称为“sialic acid binding Ig like lectin 8”。它仅在人类嗜酸性粒细胞和肥大细胞上高度表达,在嗜碱性粒细胞上表达较弱。在体外,SIGLEC8在嗜酸性粒细胞上与抗体或合成聚糖配体包被的聚合物交联可诱导其快速凋亡,而在肥大细胞上,SIGLEC8 连接可抑制 IgE/FceRI介导的炎症介质释放,而不影响他们的生存[3]。用促进存活的促炎性细胞因子预激活嗜酸性粒细胞(过敏性炎症的一个关键过程)不仅不能抵消 SIGLEC8 触发的细胞死亡,反而会有效增强其对 SIGLEC8连接反应中细胞凋亡的敏感性,这表明SIGLEC8介导的免疫抑制在炎症条件下发挥着特殊作用,被认为是很有前途的抗炎靶点,因此在治疗过敏反应、哮喘等由这些细胞引发的炎症性疾病方面具有重要作用[4]。新药研究进展目前以SIGLEC8为靶点的在研药物共5项,开发机构均是Allakos。其中Antolimab(AK-002)处于临床II期,其余四项处于临床前阶段。Antolimab,是一款靶向SIGLEC8的人源重组非岩藻糖基化单克隆IgG1抗体的药物;能够通过SIGLEC8移植肥大细胞和消耗嗜酸性粒细胞,从而抑制有这两类细胞的错误激活导致的一系列疾病,如嗜酸性胃炎(EG)、嗜酸性十二指肠炎(EoD)和嗜酸性食管炎等慢性炎症疾病。2020年5月Allakos公布Antolimab在治疗EG、EoD和嗜酸性食管炎上已经获得了 FDA的孤儿药认定资格。数据来源于科睿唯安为助力靶向SIGLEC8的新药研发,百奥赛图成功开发了相应靶点人源化小鼠。B-hSIGLEC8 miceB-hSIGLEC8 小鼠中的嗜酸性粒细胞和肥大细胞与抗人 SIGLEC8 抗体结合通过流式细胞术分析 B-hSIGLEC8 小鼠的嗜酸性粒细胞和肥大细胞。从野生型 C57BL/6 小鼠和B-hSIGLEC8小鼠中分离出嗜酸性粒细胞和腹膜灌洗肥大细胞。使用基准抗体 Lirentelimab(内部合成)进行流式细胞术分析以评估人 SIGLEC8 表达。Lirentelimab 在纯合 B-hSIGLEC8 小鼠中仅与 SIGLEC8结合,在野生型小鼠中不与 SIGLEC8结合。小鼠哮喘模型BALF免疫细胞数量从B-hSIGLEC8小鼠(n=6)中分离出BALF免疫细胞。在PBS或lirentelimab(内部合成)处理下,通过流式细胞术分析嗜酸性粒细胞的数量。lirentelimab 治疗后,纯合 B-hSIGLEC8 小鼠中炎症细胞的表达水平低于阳性对照。抗人SIGLEC8抗体的药效B-hSIGLEC8 小鼠哮喘样模型中的 H&E 染色。(A) 在研究结束时收集肺组织。H&E染色结果显示,暴露于PBS气雾剂的B-hSIGLEC8小鼠的肺组织没有表现出任何炎症。暴露于OVA导致 B-hSIGLEC8 小鼠的支气管周围和血管周围炎症显着增加。(B) 在用 lirentelimab(内部合成)治疗的小鼠中观察到嗜酸性粒细胞浸润显着减少。注:治疗模型组中lirentelimab单抗通过气管内雾化给药。本期分享到此结束,如果您对相关小鼠模型有需求,欢迎随时与我们联系。参考文献[1] Ravetch JV, Lanier LL (2000) Immune inhibitory receptors.Science290(5489):84–89.[2] Angata T, Varki A. Discovery, classification, evolution and diversity of Siglecs. Mol Aspects Med. 2023 Apr;90:101117. doi: 10.1016/j.mam.2022.101117.Epub 2022 Aug 18. PMID: 35989204; PMCID: PMC9905256.[3] Hudson SA, Bovin NV, Schnaar RL, Crocker PR, Bochner BS (2009) Eosinophil-selectivebinding and proapoptotic effect in vitro of a synthetic Siglec-8 ligand, polymeric6′-sulfated sialyl Lewis x.J Pharmacol Exp Ther330(2):608–612.[4] Na HJ, Hudson SA, Bochner BS (2012) IL-33 enhances Siglec-8 mediated apoptosis ofhuman eosinophils.Cytokine57(1):169–174.

不死的癌症类风湿性关节炎(Rheumatoid Arthritis,RA)是人类最常见的自身免疫性疾病之一,其临床症状主要表现有全身关节肿胀、疼痛和运动失调等,病情极其严重的甚至可能会导致残疾。而病理主要表现出增生性滑膜炎,软骨损伤以及骨结构的破坏。为了更好的研究人类的类风湿性关节炎,研究者在小鼠上开发出多种能模拟人类类风湿性关节炎的动物模型,而这之中胶原诱导型关节炎,能最大程度反映出人类类风湿性关节炎的临床和病理特征。Rheumatoid Arthritis百奥动物在不同品系的小鼠(C57BL/6、DBA)上都建立了稳定的胶原诱导型关节炎疾病模型(Collagen-Induced Arthritis,CIA),可用于相关药物的药效评价。类风湿性关节炎 (RA) 的病理及软骨和骨破坏的机制RA 的特征是增生性滑膜(血管翳)和 T 细胞的过度免疫反应。血管翳包括 T 细胞、滑膜成纤维细胞和巨噬细胞,可产生炎性细胞因子,如肿瘤坏死因子 (TNF)-α、白细胞介素-1(IL-1)、IL-6和IL-17。相关数据展示01RA/CIA 模型介绍 临床评分利用胶原(CII)在C57BL/6小鼠中诱导关节炎模型。(A)小鼠体重变化;(B)临床评分;(C)小鼠发病率。结果显示:在造模组(G2)中,小鼠的临床评分显著增加,提示关节炎模型建立成功。 病理分析C57BL/6小鼠关节炎模型建立后的病理分析。(A)病理评分;(B)病理切片H&E染色。造模组动物全部或部分关节可见皮下混合炎细胞浸润(a),关节周围狭窄(b),踝关节和/或趾骨关节软骨和骨组织破坏(c)等关节炎病变,进一步提示关节炎模型建立成功。02C57BL/6小鼠关节炎模型用于评价甲氨蝶呤(MTX)药效 临床评分甲氨蝶呤在小鼠关节炎模型中的药效作用。(A)小鼠体重变化;(B)临床评分;(C)小鼠发病率。结果显示:在造模组(G2)中,小鼠的临床评分显著增加,表明CIA模型建立成功,同时相比于未造模组(G1),体重波动更加明显。在给于甲氨喋呤(MTX)后,治疗组(G3)的平均临床评分显著低于造模组,证明小鼠的病情得到了有效控制。另外,在发病率方面,治疗组的发病率最大值为40%,也明显低于造模组近80%的发病率,提示小分子药甲氨喋呤对该疾病具有治疗作用。 病理分析甲氨喋呤在小鼠关节炎模型中药效作用的病理分析。(A)病理评分;(B)病理切片H&E染色。病理结果显示:未造模组(G1)动物镜下未见明显异常改变,踝关节软骨表面光滑,关节腔明显(a)。造模组(G2)动物踝关节周围组织,可见皮下混合炎细胞浸润,关节滑膜炎和/或血管翳形成(c),关节软骨破坏,关节腔消失,部分骨组织融合(b)。与G2造模组相比,治疗组虽然有部分踝关节周围皮下组织水肿和炎细胞浸润(d),但其病理评分均值明显低于G2组,甲氨喋呤对动物关节炎病变具有治疗作用。03B-hIL6/hIL6R小鼠关节炎模型用于评价抗人IL6抗体sirukumab药效 临床评分抗人IL-6抗体sirukumab(内部合成)在小鼠关节炎模型中药效作用。(A)小鼠体重变化;(B)临床评分。结果显示:在模型成功建立后,治疗组(G3,G4)小鼠用sirukumab抗体进行治疗,显示出治疗作用,且表现出剂量依赖性。 病理分析抗人IL-6抗体sirukumab(内部合成)在小鼠关节炎模型中药效作用的病理分析。(A)病理切片H&E染色;(B)病理评分。结果显示:未造模组(G1)动物未见明显异常改变,踝关节软骨表面光滑,关节腔明显。造模组(G2)动物踝关节骨组织损伤(d),关节腔或关节周围腔隙消失(e),并出现血管翳(a)。与造模组相比,抗体药治疗低剂量组(G3)有部分炎细胞浸润(b)和血管翳(a)生成,并表现出滑膜增生(c)。但在抗体药治疗高剂量组(G4),仅有部分血管翳,关节炎病变基本消失,关节腔明显,提示sirukumab对小鼠关节炎具有治疗作用。04服务项目更多药效相关服务,CAIA引起的关节炎模型,骨关节炎模型,骨质疏松模型,正在研究进行中,感兴趣的欢迎联系我们获取资料。想要获取更多百奥动物自主研发的自身免疫性疾病模型信息,请访问百奥动物官网。参考文献:1. Tateiwa, D., Yoshikawa, H. & Kaito, T. Cartilage and Bone Destruction in Arthritis: Pathogenesis and Treatment Strategy: A Literature Review. Cells 8, doi:10.3390/cells8080818 (2019).2. McInnes IB, et al. Cytokines in the pathogenesis of rheumatoid arthritis. Nat Rev Immunol 7, 429-42 (2007).

2006年3月,TeGenero公司的CD28超级激动剂单抗TGN1412治疗风湿性关节炎/白血病的1期临床试验中,6名志愿者遭受细胞因子释放综合征并伴有多器官功能衰竭,全身极度肿胀成为“大象人”,万幸的是最终脱离生命危险,该事件直接导致TeGenero破产。16年前的黑天鹅事件也给CD28药物开发蒙上了一层阴影。后续TGN1412并未被就此放弃,莫斯科抗体公司TheraMab顺利接盘并更名为TAB08,有报道称1期临床NCT03006029、NCT01990157不良事件保持在一个可接受的水平(短暂的发热与IL-6有关),然而试验如今已经因“行政原因”终止,这款CD28单抗最终也没能迎来涅槃重生[1]。如此看来,再次沉沦的CD28的未来当真就是砂砾宿命了吗?2017年,Science上发表了一篇题为Rescue of exhausted CD8 Tcells by PD-1 targeted therapies is CD28-dependent的文章,证明了CD28/B7共刺激途径对有效的PD-1疗法至关重要。至此,CD28再次回到研究者的视线中。2019年11月,赛诺菲在Nature Cancer发表了一款CD28/CD3/CD38三抗的研究进展。该三抗在CD3分子亲和力的选择上,采用了中等亲和力的抗体(KD~20nM)平衡了杀伤有效性以及细胞因子大量释放的安全性问题[2]。2020年1月,再生元在Science Translational Medicine发表论文,指出CD28双抗可以增强CD3的抗肿瘤疗效。在动物实验中,共刺激型CD28双抗明显增强了CD3双抗的疗效,且没有细胞因子风暴的风险。2020年6月24日,再生元再次在ScienceTranslational Medicine杂志上发表论文,证实了肿瘤特异性抗原(TSA) x CD28双特异性抗体可以与更广泛的抗PD-1抗体协同作用,增强癌症治疗效果,诱导长效抗肿瘤免疫力,且不会诱发细胞因子风暴,具有很好的耐受性。今年2月,赛诺菲的研发团队在Nature发表了一篇HER2×CD3×CD28三抗的研究进展。研究表明,在原代人CD3+T细胞重组的免疫缺陷NSG小鼠体内,该三抗使CD8 T细胞中颗粒酶的表达增加了6.8倍。相关肿瘤药效实验结果表明,剂量低至10μg/kg时,HER2×CD3×CD28三抗依然能够诱导肿瘤消退。近期,惠和生物靶向CD3×CD28×CD19三特异性抗体CC312的IND申请获得美国FDA默示许可,进入临床研发阶段,CC312是国内首个,也是全球第三个基于CD28共刺激信号的三特异性抗体。随着赛诺菲、再生元等牵头的研究推进,CD28被强势拉回公众视野,更多的潜力有待开发!CD28相关信号通路CD28是T细胞激活最重要的参与者之一,是增强MHC-TCR的主激活信号的主要辅助信号。CD28和CTLA-4具有高度的同源性,具有相同的配体CD80和CD86(B7-1和B7-2),CD28负责传递激活信号,活化T细胞,而CTLA-4负责传递抑制信号给T细胞,让T细胞不会杀伤其它细胞,包括肿瘤细胞。CTLA-4与配体的亲和力要高于CD28,因此会竞争阻断CD28的T细胞激活作用。在T细胞辅助激活的过程中,CD86优先表达,在与CD28结合上,CD86表现出优于CD80的结合能力,有利于T细胞激活。在T细胞激活的过程中,CD28扮演着“加油”角色,CTLA-4扮演着“前刹车”角色,PD-1则扮演着“后刹车”角色[3]。CD28、CTLA-4、PD-1/PD-L1信号通路[4]CD28靶点部分开发进展CD28作为一个老靶点,不仅机制清晰,而且针对不同临床适应症,既可开发拮抗剂也可开发激动剂,理应前景无限,但由于其研发历程的跌宕起伏,目前只有少量抗体药物开发管线。其临床药物开发上主要集中在3个方面:CD28关联靶点融合蛋白药物;单抗药物;多特异性抗体药物。(数据来源科睿唯安及公开信息整理)CD28系列人源化动物模型对于CD28相关药物的研究,再生元和赛诺菲已经做出了很好的表率,进一步的数据也许会让CD28再次火热起来。相关动物模型对于CD28靶向调节剂开发可谓至关重要,BioMice 百奥动物自主研发的CD28系列人源化鼠是评估CD28相关抗体药物的优质临床前实验动物模型。B-hCD28 小鼠验证数据蛋白表达分析流式细胞术分析B-hCD28纯合小鼠CD28的表达取抗CD3ε抗体刺激野生型小鼠和纯合B-hCD28小鼠的脾细胞,用种属特异性抗CD28抗体进行流式分析。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD28小鼠中检测到,而在野生型小鼠中检测不到。抗人CD28抗体的体内药效抗人CD28抗体在B-hCD28小鼠体内的抗肿瘤活性实验结果表明,两种抗人CD28抗体在B-hCD28小鼠体内均能有效控制肿瘤生长,表明B-hCD28小鼠为抗人CD28抗体的体内评价提供了一个优质的临床前模型。抗人PD-L1xCD28双特异性抗体的体内药效抗PD-L1和抗CD28 (PD-L1xCD28)双特异性抗体(BsAb)在B-hCD28小鼠中的抗肿瘤活性结果表明,抗人PD-L1xCD28 BsAbs能够有效控制B-hCD28小鼠的肿瘤生长,表明B-hCD28小鼠为抗人PD-L1xCD28 BsAbs的体内评价提供了一个优质的临床前模型。B-hCD3E/hCD28小鼠验证数据蛋白表达分析流式细胞术分析B-hCD3E/hCD28纯合小鼠CD3E的表达取野生型小鼠和纯合B-hCD3E/hCD28小鼠脾细胞,用种属特异性抗CD3E抗体进行流式细胞术分析。小鼠CD3E在野生型小鼠中检测到。人CD3E仅在纯合B-hCD3E/hCD28小鼠中检测到,而在野生型小鼠中检测不到。流式细胞术分析B-hCD3E/hCD28纯合小鼠CD28的表达取野生型小鼠和纯合B-hCD3E/hCD28小鼠脾细胞,用种属特异性抗CD28抗体进行流式细胞术分析。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD3E/hCD28小鼠中检测到,而在野生型小鼠中检测不到。B-hCD3EDG/hCD28 小鼠验证数据蛋白表达分析流式细胞术分析B-hCD3EDG/hCD28纯合小鼠CD3E的表达取野生型小鼠和纯合B-hCD3EDG/hCD28小鼠脾细胞,用种属特异性抗CD3E抗体进行流式分析。小鼠CD3E在野生型小鼠中检测到。人CD3E仅在纯合B-hCD3EDG/hCD28小鼠中检测到,而在野生型小鼠中检测不到。流式细胞术分析B-hCD3EDG/hCD28纯合小鼠CD28的表达取野生型小鼠和纯合B-hCD3EDG/hCD28小鼠脾细胞,用种属特异性抗CD28抗体进行流式细胞术分析。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD3EDG/hCD28小鼠中检测到,而在野生型小鼠中检测不到。B-hCD28/hTROP2小鼠验证数据蛋白表达分析流式细胞术分析B-hCD28/hTROP2纯合小鼠CD28的表达取野生型小鼠和纯合B-hCD28/hTROP2小鼠脾细胞,用种属特异性抗CD28抗体进行流式细胞术分析。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD28/hTROP2小鼠中检测到,而在野生型小鼠中检测不到。Western blot分析TROP2在B-hCD28/hTROP2纯合小鼠中的表达取野生型小鼠和纯合B-hCD28/hTROP2小鼠的皮肤组织,用抗TROP2抗体进行western blot分析。小鼠TROP2在野生型小鼠中检测到。人TROP2仅在纯合B-hCD28/hTROP2小鼠中检测到,而在野生型小鼠中检测不到。B-hCD28/hB7-H3小鼠验证数据蛋白表达分析流式细胞术分析B-hCD28/hB7-H3纯合小鼠CD28的表达取野生型小鼠和纯合B-hCD28/hB7-H3小鼠脾细胞,用种属特异性抗CD28抗体进行流式细胞术分析。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD28/hB7-H3小鼠中检测到,而在野生型小鼠中检测不到。Western blot分析B-hCD28/hB7-H3纯合小鼠B7-H3的表达采集野生型小鼠和纯合B-hCD28/hB7-H3小鼠附睾,用抗B7-H3抗体进行western blot分析。由于抗体的交叉反应,野生型小鼠和纯合B-hCD28/hB7-H3小鼠均可检测到B7-H3。B-hCD28/hCD20小鼠验证数据蛋白表达分析流式细胞术分析B-hCD28/hCD20纯合小鼠CD28的表达取野生型小鼠和纯合B-hCD28/hCD20小鼠脾细胞,用种属特异性抗CD28抗体进行流式细胞术分析。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD28/hCD20小鼠中检测到,而在野生型小鼠中检测不到。流式细胞术检测B-hCD28/hCD20纯合小鼠CD20的表达取野生型小鼠和纯合B-hCD28/hCD20 小鼠脾细胞,用种属特异性抗CD20抗体进行流式细胞术分析。小鼠CD20在野生型小鼠中检测到。人CD20仅在纯合B-hCD28/hCD20小鼠中检测到,而在野生型小鼠中检测不到。B-hSIRPA/hCD47/hCD3E/hCD28小鼠验证数据蛋白表达分析流式细胞术分析B-hSIRPA/hCD47/hCD3E/hCD28纯合小鼠CD3E、CD28、SIRPA、CD47的表达取野生型小鼠和纯合B-hSIRPA/hCD47/hCD3E/hCD28小鼠脾细胞,分别用种特异性抗CD3E、CD28、SIRPA、CD47抗体进行流式细胞术分析。由于抗体的交叉反应,野生型小鼠和B-hSIRPA/hCD47/hCD3E/hCD28小鼠均可检测到小鼠SIRPA,人SIRPA仅在纯合B-hSIRPA/hCD47/hCD3E/hCD28小鼠中检测到,而在野生型小鼠中未检测到;小鼠CD3E、CD28、CD47在野生型小鼠中检测到,人CD3E、CD28、CD47仅在纯合B-hSIRPA/hCD47/hCD3E/hCD28小鼠中检测到,而在野生型小鼠中检测不到。CD28靶点相关模型列表 想要了解更多人源化小鼠,欢迎扫描下方二维码查看或者来电咨询。 参考资料:[1] https://mp.weixin.qq.com/s/6tuPYtTIr_gNQrb0N7o7_w[2] Sanofi R&D Investor Event[3] Dimitris Skokos et al. A class of costimulatoryCD28-bispecific antibodies that enhance the antitumor activity ofCD3-bispecific antibodies. Sci. Transl. Med. 2020[4]https://oncologypro.esmo.org/education-library/esmo-handbooks/immuno-oncology/immune-synapse
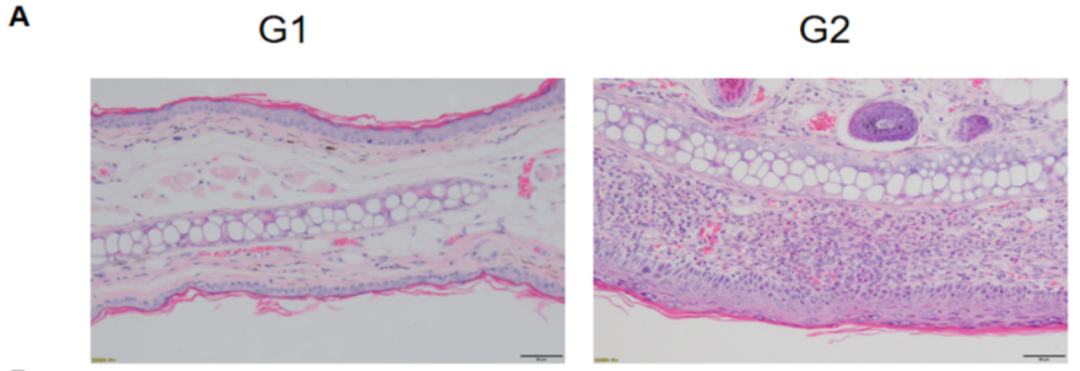
特应性皮炎(Atopic dermatitis, AD)是一种慢性皮肤疾病,其主要症状为发痒、红疹和鳞状病变,伴发心血管,精神疾患(抑郁,焦虑,睡眠障碍等)以及其他疾病。为了更好的研究特应性皮炎,研究者在小鼠上开发出多种特应性皮炎的动物模型,包括(1)利用上皮敏感性抗原、半抗原等增强皮肤敏化引起的AD模型;(2)基因工程小鼠AD模型;(3)自发AD小鼠模型等。百奥动物在C57BL/6小鼠和相同背景品系的B-hIL4/hIL4RA双基因人源化小鼠上,利用Oxazolone(OXA)致敏和持续激发,产生皮炎样病损,建立AD疾病模型,用于AD相关药物的药效评价。01AD小鼠模型的构建模型评价内容l 小鼠体重l 背部及耳部表皮厚度测量l 血清中总IgE检测l 病理分析:皮肤炎症等病变,嗜酸性粒细胞等在野生型C57BL/6小鼠中通过OXA诱导的AD模型。(A) 小鼠体重;(B) 耳部厚度;(C) 血清总IgE浓度。实验结果显示OXA诱导组的耳部厚度和血清IgE显著增加。数值以平均值±标准误表示。在野生型C57BL/6小鼠中诱导的 AD模型的耳部皮肤病理学和淋巴细胞浸润分析。(A)小鼠耳组织切片的苏木精-伊红(H&E)染色;(B)耳表皮嗜酸性粒细胞浸润评分。数值以平均值±标准误表示。治疗策略可以选择在免疫接种时开始治疗-预防性策略,也可以在小鼠发病后开始治疗-治疗性策略。02AD小鼠模型药效评价实例AD小鼠模型(C57BL/6)用于Dexamethasone药效评价1)从B图可以看出,OXA造模组的耳部厚度有明显的增加,同时血清中总的IgE(图C)有明显的升高,证明造模成功。2)从耳部厚度和IgE变化情况可以看出,不同浓度的Dexamethasone对AD疾病具有不同程度的缓解作用。3)高剂量组(0.09% Dexamethasone)对耳部皮肤水肿的缓解作用达到了与对照组持平的效果。但与对照组相比,也会导致明显的体重减轻。4)小鼠耳组织切片苏木精-伊红(H&E)染色(图D);耳表皮嗜酸性粒细胞浸润评分(图E)。数值以平均值±标准误表示。❉ 病理分析组别设置组别只数受试品浓度G15//G25//G35Dexamethasone0.03%G45Dexamethasone0.06%G55Dexamethasone0.09%从病理统计结果发现,除对照组外,其余四组动物背部和耳部皮肤表皮均可见不同程度的基质细胞增生、表皮增厚、角化过度伴角化不全、表皮痂皮、真皮及皮下组织可见混合炎症细胞浸润等特应性皮炎相关的病理性改变,表明G2造模组和G3-G5给药组的模型动物均造模成功。对各组动物的背部皮肤和耳部皮肤嗜酸性粒细胞浸润变化进行了病理学评分和统计,给药组G3-G5背部和耳部皮肤嗜酸粒细胞浸润均低于G2造模组。其中,背部皮肤中,给药组G3-G5嗜酸粒细胞浸润程度未见显著差异。耳部皮肤中,给药组G4、G5组嗜酸粒细胞浸润程度要低于G2和G3组。上述结果表明三组浓度的受试品均对特应性皮炎相关症状有一定改善作用,其中浓度为0.06%和0.09%的Dexamethasone药效较好。AD小鼠模型(B-hIL4/hIL4RA小鼠)用于Dupilumab(内部合成)药效评价Dupilumab减轻OXA诱导的B-hIL4/IL4RA小鼠特应性皮炎。第0天在小鼠的耳部和皮肤上注射0.8%的OXA,然后从第7天到第25天,每周3次注射0.4%的OXA,记录小鼠体重和耳部厚度。小鼠从第6天起每周2次接受PBS或Dupilumab(10,25 mg/kg)治疗,共6次。最后收集耳部、背部皮肤和血液(图A)。Dupilumab对体重没有影响(图C)。Dupilumab给药组小鼠的耳部厚度(图B)和血清IgE (图D)降低。Dupilumab (内部合成)能剂量依赖性治疗OXA诱导的B-hIL4/IL4RA小鼠皮肤损伤。用ELISA法分析OXA诱导的B-hIL4/hIL4RA小鼠AD模型中的蛋白表达。分别于第9、16、23、26天采集建模区耳部和皮肤样本,进行ELISA分析。Dupilumab可以减轻OXA诱导的B-hIL4/hIL4RA小鼠中人IL-4的升高。用Luminex分析OXA诱导的B-hIL4/hIL4RA小鼠AD模型中的蛋白表达。分别于第9、16、23、26天采集建模区耳部和皮肤样本,采用Luminex进行分析。用MSD分析OXA诱导的B-hIL4/hIL4RA小鼠AD模型的蛋白表达。分别于第9、16、23、26天采集建模区耳部和皮肤样本,采用MSD进行分析。用qRT-PCR分析小鼠IL-5和IL-13在OXA诱导的B-hIL4/hIL4RA小鼠AD模型中的表达。分别于第9天和第26天采集耳部样本,提取总RNA。然后逆转录RNA样本,用qRT-PCR检测小鼠IL-5、IL-13水平,用小鼠GAPDH作为管家基因。表1 细胞因子分析汇总03特应性皮炎(AD)模型可提供的临床前检测项目04特应性皮炎(AD)相关人源化小鼠列表
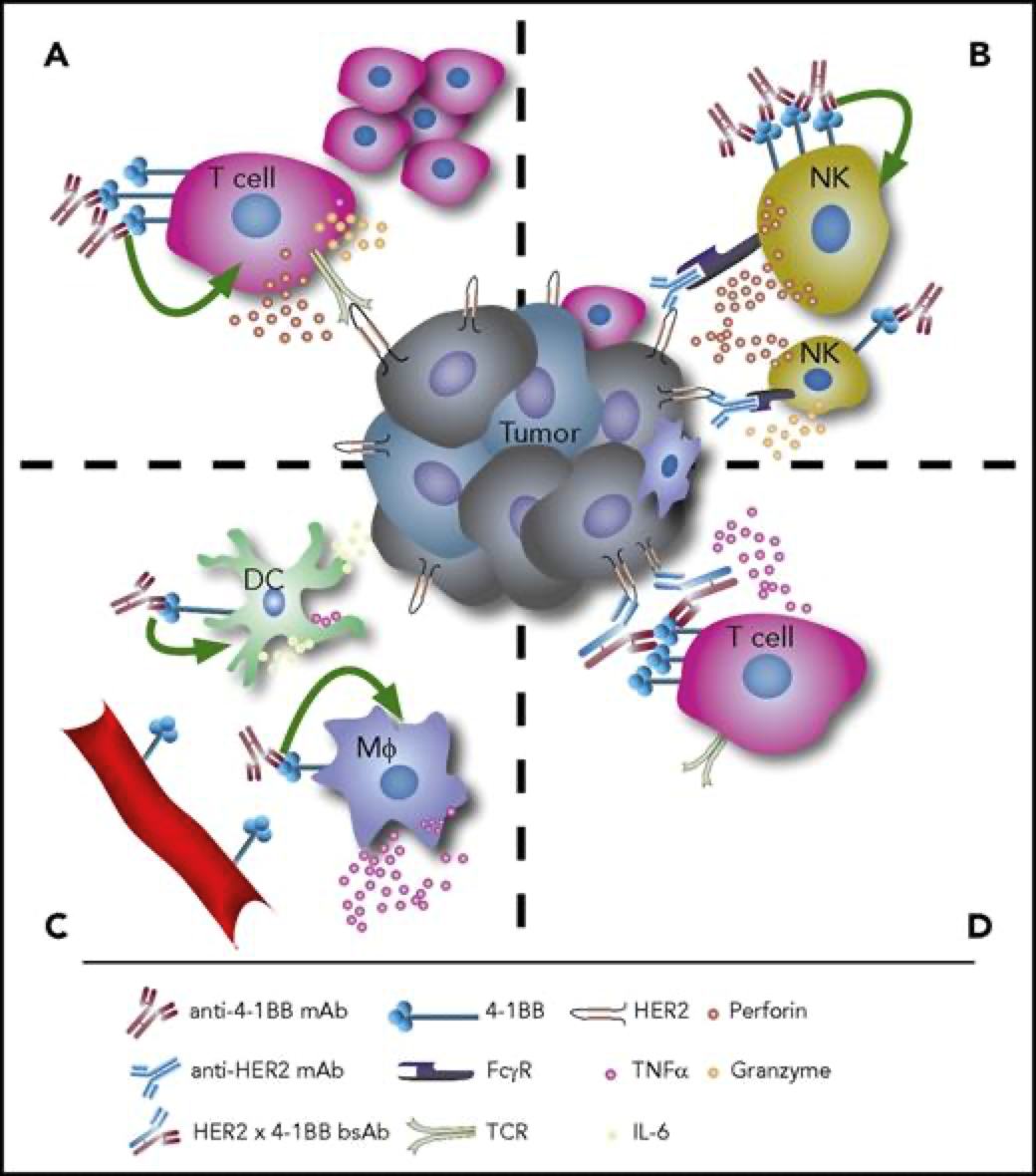
4-1BB靶点介绍4-1BB,即CD137,TNFRSF9(TNF receptor superfamily member 9),它于1989年首次被发现,属于TNF受体超家族。它在抗原启动的T细胞上表达,在静止的T细胞上不表达,除此以外,4-1BB还在树突状细胞(DC)、自然杀伤细胞(NKs)、活化的CD4+和CD8+T淋巴细胞、嗜酸性粒细胞、自然杀伤T细胞(NKT)和肥大细胞中表达。当4-1BB与其配体4-1BBL结合后,可以产生共刺激信号诱导CD4+和CD8+T细胞的活性,促进T细胞增殖,刺激巨噬细胞产生如如IL-6、TNF-α等多种炎症细胞因子。从而激活机体免疫系统,达到抑制肿瘤发生发展、促进肿瘤细胞清除的功效。有研究报道,当在进行4-1BB抗体药物研发时,还要需要考虑抗体结合位点在人和小鼠之间存在的差异性。其结合作用仅限于富含半胱氨酸结构域(CRD),小鼠4-1BBL主要与CRDII结合,人4-1BBL主要与CRDIII结合。小鼠4-1BB/4-1BBL是二聚体,人4-1BB/4-1BBL为三聚体,且人4-1BB不与小鼠的4-1BBL相互作用。[1]图1. 抗4-1BB疗法的免疫调节作用[2]4-1BB药物开发的现状4-1BB作为癌症免疫疗法中十分有潜力的靶点,针对其进行的药物研发非常火热,全球目前已有至少40款4-1BB激动型抗体进入临床研究阶段。4-1BB单抗药物由 BMS研发的Urelumab(全人源IgG4 mAb)是一个4-1BB强激动性的单抗,在I/II期试验中表现出良好的抗肿瘤活性,但在后续治疗过程中发生了两起由肝毒性引起的致命性不良事件。由Pfizer研发的Utomilumab(人源化IgG2 mAb)是一个4-1BB弱激动性的单抗,虽然有较好的肝脏安全性表现,但作为单药治疗抗肿瘤活性十分有限。因此,此前未能很好的在激动作用和肝毒性之间达到良好的平衡,导致4-1BB单抗产品临床应用空间有限;目前新一代单抗设计通过对Fc功能改造试图保留激动性的同时克服安全性问题,Alligator、Agenus以及国内的礼进生物和天演药业的4-1BB单抗产品表现出良好的初步临床数据。4-1BB重点单抗产品临床进度数据来源:Cortellis4-1BB双抗药物平衡抗体激动作用强弱和其肝毒性,是4-1BB单抗药物开发的难点,因此为了克服疗效和毒性的问题,研究者们开始探索新的开发策略。其中以4-1BB为靶点的双抗、三抗以及四抗成为研发的一个热点领域,国内外多家药企均有布局。4-1BB双特异性抗体通过对肿瘤细胞表面靶点和4-1BB亲和力不同精准定位肿瘤微环境,减少肝毒性等副作用。因此双抗疗效相比单抗可以实现更精准的靶向,从而使得临床前的抗肿瘤活性和安全性都得到了提升。如PD-1/PD-L1就是4-1BB双抗常用的另一候选靶点。去年,BioNTech与Genmab联合研发的PD-L1×4-BB双抗药物GEN1046,是一种全长IgG1亚型的PD-L1×4-1BB双抗,其以临床Ⅰ/Ⅱa期结果发表在著名学术期刊《CANCER DISCOVERY》上的文章中,所使用的PD-L1/4-1BB双靶点人源化鼠由百奥动物提供。文中研究结果表明:GEN1046对于CPI耐药的实体瘤治疗效果良好,安全性高,为免疫联合治疗提供了新的方案。4-1BB重点双抗产品临床进度数据来源:Cortellis通过众多临床试验及以往多年研究积累,4-1BB 靶点被证实是肿瘤免疫治疗十分有潜力的靶点,目前如何最大化激动作用并最小化毒性是未来4-1BB激动剂研发亟需解决的问题。百奥动物自主研发的4-1BB系列人源化小鼠(详情见下表),是靶向4-1BB抗体开发相关药物进行药效评价的优质模型。B-h4-1BB/h4-1BBL mice高剂量Urelumab对B-h4-1BB小鼠和B-h4-1BB/h4-1BBL小鼠均产生肝毒性用PBS或Urelumab(内部合成)对纯合子B-h4-1BB小鼠和B-h4-1BB/h4-1BBL小鼠进行治疗 (n=5,雌性,7周龄)。第21天采集血清,检测谷丙转氨酶(ALT)、谷草转氨酶(AST)。与PBS对照相比,使用20mg /kg Urelumab治疗B-h4-1BB小鼠的ALT显著升高,而同样的治疗对B-h4-1BB/h4-1BBL小鼠没有影响。与PBS对照相比,B-h4-1BB小鼠AST无明显升高,但20ug/mL urelumab治疗可使B-h4-1BB/h4-1BBL小鼠AST明显升高。在1mg/kg剂量组,B-h4-1BB小鼠和B-h4-1BB/h4-1BBL小鼠的ALT和AST均无明显变化。表明高剂量urelumab对B-h4-1BB和B-h4-1BB/h4-1BBL小鼠有肝毒性作用。数值以平均值±SEM表示。高剂量Urelumab 治疗可导致B-h4-1BB小鼠和B-h4-1BB/h4-1BBL小鼠肝脏淋巴细胞浸润增加肝毒性的病理分析。在B-h4-1BB小鼠(G1-G3)中,当urelumab剂量为1mg/kg时,肝脏未见明显异常变化(G2)。当剂量为20 mg/kg (G3)时,观察到血管周围细胞浸润或肝脏慢性炎症,并伴有轻度病变。在B-h4-1BB/h4-1BBL小鼠(G4-G6)中,1 mg/kg组(G5) 3/5的小鼠出现病理变化(轻度2/5,轻度1/5),而在20 mg/kg剂量(G6)时,所有实验动物肝脏均出现中度变化。总体而言,20 mg/kg组(G6)肝脏病变程度和发生率显著高于1 mg/kg组(G5)。以上结果提示,高剂量(20mg /kg)的urelumab比低剂量(1mg /kg)的urelumab更容易发生血管周围细胞浸润或肝脏慢性炎症。B-h4-1BB/h4-1BBL小鼠对urelumab毒性作用比B-h4-1BB小鼠更敏感。因此B-h4-1BB/h4-1BBL小鼠是较好的临床前毒性评价模型。B-h4-1BB/h4-1BBL药效验证抗人4-1BB抗体在B-h4-1BB/h4-1BBL小鼠中的抗肿瘤药效。(A) 纯合子B-h4-1BB/h4-1BBL小鼠 (雌性,6-8周龄,n=5) 皮下接种小鼠结肠癌MC38细胞系。结果显示抗人4-1BB抗体能够显著抑制MC38肿瘤细胞的生长。(B)治疗期间体重变化。如图A所示,抗人4-1BB抗体在B-h4-1BB/h4-1BBL小鼠中有效地控制肿瘤生长,这表明B-h4-1BB/h4-1BBL小鼠可为体内评价抗人4-1BB抗体药效提供有力的临床前研究模型。值表示为平均值±SEM。参考文献[1].https://mp.weixin.qq.com/s/kvwfybpx63XQn26xdijIZwhttps://mp.weixin.qq.com/s/999cX0RaXHLyXxZ8MhIaBw[2]. Chester C, Sanmamed MF, Wang J, Melero I. Immunotherapy targeting 4-1BB:mechanistic rationale, clinical results, and future strategies. Blood. 2018 Jan4;131(1):49-57. doi: 10.1182/blood-2017-06-741041. Epub 2017 Nov 8. PMID:29118009.

近年来,免疫治疗在抗肿瘤治疗中的作用备受关注,基于免疫治疗的新药开发和标志物探索,成为了当前肿瘤研究的热点,这也对临床前研究动物模型的建立提出了更高的要求。即可以模拟人肿瘤特征又同时存在“人源化”免疫系统的免疫重建小鼠模型,成为了免疫肿瘤研发中的优质模型。百奥动物B-NDG小鼠缺乏成熟的T、B、NK细胞,是目前国际公认的免疫缺陷程度高、适合人源细胞或组织移植的工具小鼠。将人的免疫细胞、造血干细胞移植到B-NDG及B-NDG衍生小鼠中构建的免疫系统重建小鼠,能够更好的模拟人的免疫系统,进行免疫学研究和免疫药物评价。但在使用重度免疫缺陷小鼠进行PBMC和CD34+ HSC免疫重建时会面临一些常见问题,如PBMC重建后的T细胞会对小鼠自身细胞进行攻击导致严重的xeno-GvHD反应;CD34+ HSC重建后的NK细胞和髓系细胞重建比例不足。我们以B-NDG小鼠为基础分别开发了可延缓xeno-GvHD反应和可促进髓系细胞发育的二代系列小鼠,以满足特定细胞功能研究和相应靶点药物评价的需求。减轻GvHD反应,延长实验窗口期B-NDG MHC I/II DKO mice plus 不表达MHC I/II 类分子B-NDG小鼠、B-NDG B2m KO plus小鼠和B-NDG MHC I/II DKO plus小鼠进行人PBMC重建后GvHD严重程度的比较 第0天将3个健康供体的人PBMCs (5E6)静脉注射B-NDG小鼠、B-NDG B2m KO plus小鼠和B-NDG MHC I/II DKO plus小鼠(雌性,5周龄,n=5)中。A.用Kaplan Meier生存曲线分析小鼠存活率。B.体重变化。GvHD临床体征每周评分两次。结果表明:B-NDG MHC I/II DKO plus小鼠可显著延缓GvHD发生,并降低GvHD严重程度。因此B-NDG MHC I/II DKO plus小鼠更适合将人PBMC移植到免疫缺陷小鼠模型。B-NDG B2m KO mice plus B-NDG小鼠、B-NDG B2m KO plus进行人PBMC重建后GvHD严重程度的比较将3个健康供体的2E6人PBMC静脉注射B-NDG B2m KO plus小鼠(雌性,11周龄,n=5)和B-NDG小鼠(雌性,10周龄,n=6)中。GvHD临床体征每周评分两次。结果表明:在人PBMC诱导的GvHD模型中,B-NDG B2m KO plus小鼠比B-NDG小鼠生存期明显延长,B-NDG B2m KO plus小鼠可延缓GvHD的发病并减轻其严重程度。促进髓系细胞重建B-NDG MGMT3 mice 人源化IL3, CSF2, CSF1, THPO 基因未经辐照的B-NDG MGMT3小鼠进行人CD34+HSC重建将人CD34+HSC造血干细胞(3E4)静脉注射B-NDG小鼠和B-NDG MGMT3小鼠(出生后24-72h,n=15)。B-NDG小鼠给予1.0 gy辐照,B-NDG MGMT3小鼠不辐照。流式细胞分析两种小鼠进行人CD34+HSC免疫重建后的外周血淋巴细胞。结果表明:未经辐照的B-NDG MGMT3小鼠的CD45+细胞比例从移植后12周开始达到25%,并持续上升,明显高于B-NDG小鼠。B-NDG MGMT3小鼠单核细胞、MDSCs、DCs和Treg的比例高于B-NDG小鼠。(注:A面板第18周数据因流式细胞检测问题无意义。)B-NDG hCSF1/hTHPO mice 未经辐照的B-NDG hCSF1/hTHPO小鼠进行人CD34+HSC重建将人CD34+HSC细胞(0.15 M)静脉注射到纯合B-NDG hCSF1/hTHPO小鼠(雌性,6周龄,n=15)。流式细胞术分析人CD34+HSC免疫重建后小鼠外周血淋巴细胞。结果显示:未经辐照的B-NDG hCSF1/hTHPO小鼠成功重建了T、包括B、NK、髓系细胞、单核细胞和中性粒细胞在内的人多系细胞。免疫缺陷动物产品列表

MSLN基因编码一种前体蛋白,经蛋白水解处理生成两种蛋白产物,主要位于正常间皮细胞表面,两种蛋白产物为巨核细胞增强因子(megakaryocyte potentiating,MPF)和间皮素(Mesothelin,MSLN)。巨核细胞增强因子作为细胞因子可刺激骨髓巨核细胞集落形成。间皮素在正常组织中,仅表达在间皮细胞,但在间皮瘤(mesothelioma)、卵巢癌(ovarian cancer)、胰腺癌(pancreatic cancer)、胆管癌(cholangiocarcinoma)等肿瘤中均有高表达。因此间皮素是很有前途的肿瘤特异性治疗候选药物靶点。图1.间皮素的结构和功能[1]MSLN通过ERK和PI3K/Akt通路促进肿瘤细胞存活和增殖;通过MMP-7的活性促进侵袭性和转移过程。通过与表达MUC16的细胞相互作用,也可以促进转移。然而,MSLN与EMT和血管生成相关的基本机制在PDAC中仍然有待阐明。MSLN在80%到90%的PDAC中过度表达,使该靶点成为PDAC患者治疗的一个有吸引力的候选。图2.MSLN在胰腺导管腺癌(PDAC)进展中的作用[2]MSLN与胰腺癌细胞表面的MUC16结合,激活了p38 MAPK依赖性途径,进而上调了MMP-7的合成,导致侵袭和迁移潜力增加。在胰腺癌细胞不表达MUC16的情况下,MSLN能够通过激活ERK依赖性途径上调MMP-7的表达。图3. MSLN-MUC16结合诱导胰腺癌细胞MMP-7的分子通路[3]目前靶向MSLN治疗实体瘤的药物主要有:单克隆抗体药物,携带蛋白毒素的单克隆抗体药物,携带低分子量细胞毒性药物的单克隆抗体药物,靶向MSLN的CAR-T细胞药物,以及可以诱导T细胞针对MSLN产生免疫应答的疫苗。图4. 临床试验中靶向MSLN的方法[4]最新研究进展据不完全统计,目前MSLN靶点处于在研阶段的相关药物有56个,目前进行相关药物研发的企业包括拜耳,Atara Biotherapeutics,诺华在研,亘喜生物,荣昌生物等。目前已有诸多国内外企业在该领域进行了布局。部分处于临床及以上阶段的药物情况统计见下表:数据来源于科睿唯安及公开信息整理针对MSLN靶点机制研究和新药开发的需求,BioMice百奥动物自主研发了B-hMSLN mice和B-hMSLN ID8、B-hMSLN MC38细胞系,助力靶向MSLN药物开发,为临床前药效评估提供了优质模型。B-hMSLN mice基本信息蛋白表达分析利用western blot检测野生型小鼠和B-hMSLN小鼠中种属特异性MSLN的表达。取野生型小鼠(+/+)和杂合B-hMSLN小鼠(H/+)的肺部裂解液,用抗MSLN抗体进行western blot分析。结果显示,小鼠MSLN在杂合B-hMSLN小鼠(H/+)和野生型小鼠(+/+)中均可检测到。人MSLN只在B-hMSLN小鼠(H/+)中可检测到。免疫组化(IHC)方法检测MSLN表达IHC显示在B-hMSLN小鼠肺部组织中有代表性间皮素表达。用人MSLN特异性抗体(A,B)和抗兔IgG抗体(C)特异的抗体对组织进行染色。结果显示,在纯合B-hMSLN小鼠中,细胞膜上显示人MSLN阳性(数据来源于合作方)。B-hMSLN ID8基本信息蛋白表达分析通过流式细胞术对纯合B-hMSLN ID8小鼠细胞中MSLN的表达进行分析。用物种特异性抗MSLN抗体对B-hMSLN ID8培养物的单细胞悬浮液进行染色。在B-hMSLN ID8小鼠细胞的表面检测到人MSLN。B-hMSLN ID8细胞的2-A11克隆被用于体内实验。肿瘤生长曲线&体重变化B-hMSLN ID8小鼠细胞的皮下同种移植肿瘤生长。将B-hMSLN ID8细胞(5x106)和野生型ID8细胞(1x106)皮下植入C57BL/6N小鼠(雌性,6周龄,n=8)。(A)平均肿瘤体积±SEM, (B)体重(平均值±SEM),每周测量两次肿瘤体积和体重,体积以mm3表示,使用公式,V=0.5×长径×短径2。如图A所示,B-hMSLN ID8细胞能够在小鼠体内建立肿瘤,可用于药效研究。肿瘤体积&重量测量肿瘤细胞的蛋白表达分析将B-hMSLN ID8细胞皮下移植到C57BL/6小鼠体内(n=8),在接种后21天,收集肿瘤细胞并通过流式细胞术检测人MSLN的表达。如图所示,人MSLN在肿瘤细胞表面高表达。因此,B-hMSLN ID8小鼠细胞可用于新型MSLN疗法的体内药效研究。B-hMSLN MC38基本信息蛋白表达分析通过流式细胞术对B-hMSLN MC38小鼠进行种属特异性MSLN 表达分析。对 B-hMSLN MC38 培养物的单细胞悬液用种属特异性抗 MSLN 抗体进行染色。结果显示:在B-hMSLN MC38小鼠细胞表面检测到人MSLN,小鼠MSLN不表达。因此 B-hMSLN MC38细胞的1-A03克隆可用于体内实验。肿瘤生长曲线&体重变化B-hMSLN MC38小鼠细胞的皮下同种移植肿瘤生长。B-hMSLN MC38 细胞 (1x106) 和野生型 MC38 细胞 (5x105) 被皮下植入 C57BL/6 小鼠 (雌性, 6 周龄, n=8)。每周两次测量肿瘤体积和体重。(A) 平均肿瘤体积 ± SEM, (B) 体重 (平均值±SEM)。体积以 mm3 表示,使用公式:V=0.5 × 长径 × 短径2。如图 A 所示,B-hMSLN MC38 小鼠细胞能够在体内建立肿瘤,并可用于药效研究。参考文献[1] Mesothelin:An Immunotherapeutic Targetbeyond Solid Tumors. Cancers (Basel). 2022 Mar;14(6):1550.[2] Montemagno C, et al. Int J Mol Sci. 2020 Jun 6;21(11):4067.[3] Chen SH, et al. Sci Rep. 2013;3:1870.[4] Montemagno C, et al. Int J Mol Sci. 2020 Jun 6;21(11):4067.

银屑病(Psoriasis)是一种慢性复发性炎症性皮肤病,最常见的症状是红色发炎的皮疹或红斑,通常覆有银色鳞屑,严重影响患者的生活质量。在中国,银屑病的估计患病率为0.47%,影响超过700万患者;全球来看,至少有1.25亿人受此疾病困扰。银屑病可分为斑块型(最常见类型,占80-90%)、点滴型、脓疱型(局限性、泛发性-GPP,罕见且严重)、银屑病性关节炎等类型。自2004年起,每年的10月29日为世界银屑病日。银屑病是一种由多种致病因子(遗传、环境因素等)刺激引起的T细胞介导的针对皮肤的自身免疫病,不具有传染性。机制上,以往认为Th1通路是银屑病发病的主要原因,代表性细胞因子有TNFα、IL-12、IL-23。第一代治疗银屑病的生物制剂围绕TNFα展开,相继上市了融合蛋白、单抗等多个药物,目前仍占据着银屑病市场的主要份额。然而,TNFα抑制剂使用过程中常常会出现严重的不良反应,并且有40%的患者治疗效果不佳,再伴随着一系列生物类似药的上市,导致TNFα抑制剂面临困境和巨大的内部竞争。后来人们认识到Th17是银屑病发病的关键驱动因素。IL-17/IL-23是致病的主要因素。IL-17由Th17细胞分泌,促进其他细胞因子传递,并直接促进活化的角质细胞产生更多趋化因子。由于IL-17与银屑病发病的关联最为直接,所以抑制IL-17的药物以起效快著称。IL-23位于Th17细胞的上游,靶向IL-23的药物以其长效性闻名,但并不能完全抑制IL-17,因为除了Th17细胞外,还有其他细胞有可能产生IL-17。图1. 多种细胞因子在银屑病发病机制中的作用及其上下游关系[1] 图2. 靶向IL-23/IL-17通路的银屑病药物[2]主要银屑病上市药物 整理自科睿维安数据库这些上市药物中,不乏销售额亮眼的药物。其中,Ustekinumab单抗是第一款靶向IL-23的上市药,在获批银屑病后不断扩大适应症范围,销售额2019年已经达到66亿美元,全球排名第12,增速非常快。Secukinumab是第一款靶向IL-17的药物,全球销售额从2017年的21亿美元增长至2020年的40亿美元。同为IL-17抑制剂,礼来的ixekizumab在2020年的销售额亦增长至18亿美元。 目前,针对这些细胞因子,国内已有多款产品上市或在临床试验阶段,代表公司有恒瑞、智翔金泰、丽珠/康鑫合生、康方生物、君实生物、三生国健、荃信生物、海正药业等。 为了更好的帮助药企和生物技术公司研发银屑病药物,百奥动物研发了多种炎性细胞因子相关的人源化小鼠模型,用于候选药物的临床前体内药效检测。B-hIL17A mice品系名称:C57BL/6-Il17atm1(IL17A)/Bcgen常用名:B-hIL17A mice背景:C57BL/6货号:110053靶点别名:IL17A, CTLA-8, CTLA8, IL-17, IL-17A, IL17, ILA17, interleukin 17A 1. IL17A蛋白的种属特异性表达用ELISA方法检测野生型小鼠 (+/+)和纯合B-hIL17A小鼠(H/H)中的IL17A表达情况。结果显示小鼠IL-17A蛋白仅在野生型小鼠 (+/+)中表达,而人IL-17A蛋白仅在纯合B-hIL17A小鼠(H/H)中表达。2. B-hIL17A银屑病模型可用于抗人IL-17A抗体的体内药效评估 Ixekizumab在B-hIL17A 的IMQ银屑病模型里呈现剂量依赖的药效。10周龄B-hIL17A小鼠(H/H)去毛后,连续8天在后背皮肤上涂抹Imiquimod (IMQ)。同时,每组小鼠(雌性,10周龄,n=5)接受对照或不同剂量的ixekizumab(自制,低剂量为3mg/kg,高剂量为10mg/kg)治疗,每天记录小鼠的体重和皮肤炎症评分。并于实验终点(endpoint)收集皮肤进行分析。(A)药物治疗6天时,小鼠背部皮肤表型;(B)给药期间的小鼠体重变化;(C-E)背部皮肤的红疹评分、鳞屑评分以及综合评分。结果显示,ixekizumab可以减轻小鼠银屑病模型的临床表型。数值为平均值 ± SEM。对实验终点收集的皮肤进行苏木精-伊红染色(H&E),分析。(A)背部皮肤的H&E染色结果示意图;(B)背部皮肤病理评分;(C)小鼠表皮厚度。结果显示,ixekizumab可以减少角质细胞扩增和炎性细胞的浸润,缓解小鼠银屑病模型的皮肤炎症。数值为平均值 ± SEM。Secukinumab在B-hIL17A的IMQ银屑病模型里呈现剂量依赖的药效。B-hIL17A小鼠(H/H)去毛后,连续5天在后背皮肤上涂抹IMQ。同时,每组小鼠(雌性,8周龄,n=6)接受对照或不同剂量的secukinumab(商业化药品,低剂量为10mg/kg,高剂量为30mg/kg)治疗,每天记录小鼠的体重和皮肤炎症评分。并于实验终点收集皮肤进行分析。(A)银屑病造模(B)第0天和5天时,小鼠背部皮肤表型;(C)给药期间的小鼠体重变化;(D-F)背部皮肤的红疹评分、鳞屑评分以及综合评分。结果显示,secukinumab可以减轻小鼠银屑病模型的临床表型。数值为平均值 ± SEM。对实验终点收集的皮肤进行苏木精-伊红染色(H&E),分析。(A)背部皮肤的H&E染色结果示意图;(B)背部皮肤病理评分;(C)小鼠表皮厚度。结果显示,secukinumab可以减少角质细胞扩增和炎性细胞的浸润,缓解小鼠银屑病模型的皮肤炎症。数值为平均值 ± SEM。B-hIL17A/hIL17F mice品系名称:C57BL/6-Il17atm1(IL17A) Il17ftm1(IL17F)/Bcgen常用名:B-hIL17A/hIL17F mice背景:C57BL/6货号:120554靶点别名:IL17A, interleukin 17A, CTLA-8, CTLA8, IL-17, IL-17A, IL17, ILA17; IL17F, interleukin 17F, CANDF6, IL-17F, ML-1, ML1 1. IL17A和IL17F蛋白的种属特异性表达用ELISA方法检测野生型小鼠 (+/+)和纯合B-hIL17A/hIL17F小鼠(H/H)中IL17A和IL17F的表达情况,结果显示小鼠IL17A和IL17F蛋白仅在野生型小鼠 (+/+)中表达,而人IL-17A和IL17F蛋白仅在纯合B-hIL17A/hIL17F小鼠 (H/H)中表达。2. B-hIL17A/hIL17F银屑病模型可用于抗人IL-17A/IL-17F抗体的体内药效评估Bimekizumab在B-hIL17A/hIL17F 的IMQ银屑病模型里呈现剂量依赖的药效。B-hIL17A小鼠(H/H)去毛后,连续8天在后背皮肤上涂抹IMQ。同时,每组小鼠(雌性,10周龄,n=5)接受对照或不同剂量的bimekizumab(自制,低剂量1mg/kg,高剂量3mg/kg)治疗,每天记录小鼠的体重和皮肤炎症评分。并于实验终点收集皮肤进行分析。(A)6天治疗结束后,小鼠背部皮肤表型;(B)给药期间的小鼠体重变化;(C-E)背部皮肤的红疹评分、鳞屑评分以及综合评分。结果显示,bimekizumab可以减轻小鼠银屑病模型的临床表型。数值为平均值 ± SEM。对实验终点收集的皮肤进行苏木精-伊红染色(H&E),分析。(A)背部皮肤的H&E染色结果示意图;(B)背部皮肤病理评分;(C)小鼠表皮厚度。结果显示,bimekizumab可以减少角质细胞扩增和炎性细胞的浸润,缓解小鼠银屑病模型的皮肤炎症。数值为平均值 ± SEM。 B-hIL17RA mice品系名称:C57BL/6-Il17ratm1(IL17RA)/Bcgen常用名:B-hIL17RA mice背景:C57BL/6货号:110054靶点别名:IL17RA, CANDF5, CD217, CDw217, IL-17RA, IL17R, IMD51, hIL-17R, interleukin 17 receptor A1. IL17RA蛋白的种属特异性表达取野生型小鼠 (+/+)和杂合B-hIL17RA小鼠(H/+)的骨髓,用流式方法检测IL17RA的表达。结果显示小鼠IL17RA在野生型小鼠 (+/+)和杂合B-hIL17RA小鼠(H/+)中表达;而人IL17RA仅在杂合B-hIL17RA小鼠(H/+)中表达。 B-hTNFA mice品系名称:C57BL/6-Tnftm1(TNF)/Bcgen常用名:B-hTNFA mice背景:C57BL/6货号:110002靶点别名:TNF (tumor necrosis factor, TNFA)1. TNFα蛋白的种属特异性表达用ELISA方法检测野生型小鼠 (+/+)和纯合B-hTNFA小鼠(H/H)中的TNFα表达情况。结果显示小鼠TNFα蛋白仅在野生型小鼠 (+/+)中表达,而人TNFα蛋白仅在纯合B-hTNFA小鼠(H/H)中表达。B-hTNFA/hIL17A mice品系名称:C57BL/6-Tnftm1(TNF)Il17atm1(IL17A)/Bcgen常用名:B-hTNFA/hIL17A mice背景:C57BL/6货号:120548靶点别名:TNF (tumor necrosis factor, TNFA); IL17A (interleukin 17A) 1. TNFα和IL17A蛋白的种属特异性表达用ELISA方法检测野生型小鼠(+/+)和纯合B-hTNFA/hIL17F小鼠(H/H)中TNFA和IL17A的表达情况,结果显示小鼠的TNFA和IL17A蛋白仅在野生型小鼠(+/+)中表达,而人TNFA和IL17A仅在纯合B-hTNFA/hIL17A小鼠 (H/H)中表达。2. B-hTNFA/hIL17A银屑病模型可用于抗人TNFα x IL17A双抗的体内药效评估TNFα x IL17A双抗在B-hTNFA/hIL17A小鼠的IMQ银屑病模型里呈现剂量依赖的药效。B-hTNFA/hIL17A小鼠(H/H)去毛后,连续6天在后背皮肤上涂抹IMQ。同时,每组(雌性,10周龄,n=5)小鼠接受对照或不同剂量的TNFα x IL17A双抗(自制)治疗,每天记录小鼠的体重和皮肤炎症评分。并于实验终点收集皮肤进行分析。(A)6天治疗结束后,小鼠背部皮肤表型;(B)给药期间的小鼠体重变化;(C-E)背部皮肤的红疹评分、鳞屑评分以及综合评分。结果显示,TNFα x IL17A双抗可以减轻小鼠银屑病模型的临床表型。数值为平均值 ± SEM。对实验终点收集的皮肤进行苏木精-伊红染色(H&E),分析。(A)背部皮肤的H&E染色结果示意图;(B)背部皮肤病理评分;(C)小鼠表皮厚度。结果显示,TNFα x IL17A双抗可以减少角质细胞扩增和炎性细胞的浸润,缓解小鼠银屑病模型的皮肤炎症。数值为平均值 ± SEM。B-hIL23A/hIL12B mice品系名称:C57BL/6-Il23atm1(IL23A)Il12btm1(IL12B)/Bcgen常用名:B-hIL23A/hIL12B mice背景:C57BL/6货号:120553靶点别名:IL23A (interleukin 23 subunit alpha), IL12B (interleukin 12B)1. IL23蛋白的种属特异性表达 用ELISA方法检测野生型小鼠(+/+)和纯合B-hIL23A/hIL12B小鼠(H/H)中IL23A的表达情况,结果显示小鼠IL23A仅在野生型小鼠WT (+/+)中表达,而人IL-23仅在纯合B-hIL23A/hIL12B 小鼠(H/H)中表达。3. B-hIL23A/hIL12B银屑病模型可用于抗人IL-23A抗体的体内药效评估IL23A单抗在B-hIL23A/hIL12B小鼠的IMQ银屑病模型里呈现剂量依赖的药效。B-hIL23A/hIL12B小鼠(H/H)去毛后,连续6天在后背皮肤上涂抹IMQ。同时,每组小鼠接受对照或不同剂量的IL-23A单抗治疗,每天记录小鼠的体重和皮肤炎症评分。 (A)给药期间的小鼠体重变化;(B-D)背部皮肤的红疹评分、鳞屑评分以及综合评分。结果显示,IL-23A单抗可以减轻小鼠银屑病模型的临床表型。数值为平均值 ± SEM。 B-hIL36R mice品系名称:C57BL/6-Il1rl2tm1(IL1RL2)/Bcgen常用名:B-hIL36R mice背景:C57BL/6货号:110084靶点别名:IL1RL2, IL-1Rrp2, IL-36R, IL1R-rp2, IL1RRP2, interleukin 1 receptor like 21. IL36R蛋白表达的免疫组化分析在野生型小鼠 (+/+)和纯合B-hIL36R小鼠(H/H)建立银屑病模型后,取小鼠背部皮肤和小肠,用免疫组化方法分析IL36R的表达。由于IL36R抗体是人鼠交叉识别,所以在野生型小鼠 (+/+)和纯合B-hIL36R小鼠 (H/H)中均可以检测到IL36R的表达。箭头所指为阳性染色细胞。2. B-hIL36R小鼠银屑病模型可用于抗人IL-36R抗体的体内药效评估Spesolimab在B-hIL36R小鼠的IMQ银屑病模型里呈现剂量依赖的药效。B-hIL36R小鼠(H/H)去毛后,连续6天在后背皮肤上涂抹IMQ。同时,每组小鼠(雌性,9周龄,n=6)接受对照或不同剂量的spesolimab(商业化药品,自制,低剂量为1mg/kg,中剂量:3mg/kg,高剂量为10mg/kg)治疗,每天记录小鼠的体重和皮肤炎症评分。并于实验终点收集皮肤进行分析。(A)银屑病造模(B)第0天和6天时,小鼠背部皮肤表型;(C)给药期间的小鼠体重变化;(D-F)背部皮肤的红疹评分、鳞屑评分以及综合评分。结果显示,spesolimab可以减轻小鼠银屑病模型的临床表型。数值为平均值 ± SEM。对实验终点收集的皮肤进行苏木精-伊红染色(H&E),分析。(A)背部皮肤的H&E染色结果示意图;(B)背部皮肤病理评分;(C)小鼠表皮厚度。结果显示,spesolimab可以减少角质细胞扩增和炎性细胞的浸润,缓解小鼠银屑病模型的皮肤炎症。数值为平均值 ± SEM。百奥动物银屑病相关人源化小鼠模型总结除以上产品鼠外,还有B-hIL22/hIL22RA人源化小鼠正在开发中。 参考资料1. 银屑病靶点IL-17A,智翔金泰自免单抗再批临床,bioSeedin柏思荟2. Tsukazaki H, Kaito T. The Role of the IL-23/IL-17 Pathway in the Pathogenesis of Spondyloarthritis. International Journal of Molecular Sciences. 2020; 21(17):6401.3. Uppala, Ranjitha et al. "Autoinflammatory psoriasis"-genetics and biology of pustular psoriasis.” Cellular & molecular immunology vol. 18,2 (2021): 307-317.

经历新冠近四年,疫情仍然以星星之火的态势影响着国内外。近两年来,全球研发企业与投资机构的目标几乎都投向了承担着“事前预防”角色的疫苗企业,但此刻亦有许多医药巨头正在悄然行动,在“事后补救”的抗纤维化赛道上积极布局。其中不乏 Boehringer Ingelheim、Genentech、BMS、Roche(Promedior)这些国际大厂,也有 FibroGen、Pliant Therapeutics、Galecto、Blade Therapeutics 等生物技术公司[1]。医药巨头的关注无疑是对领域未来机会的认可。目前,全球仅上市吡非尼酮(抑制TGF-β1的生成和减少血管因子的合成)和尼达尼布(血管生成因子抑制剂)两款药物,但两款药物因其安全性不佳,并且药效有限,仅仅可以延缓病人的纤维化进展,靶点和机理等药理学内容模糊。因此,以 Pfizer 和 Gilead 为代表的跨国制药巨头,已逐渐将新药开发战略重心转移至抗纤维化药物领域中,以满足巨大的市场需求。不是癌症的癌症--纤维化纤维化(Fibrosis)其实是多种类型组织损伤尤其是在慢性炎症性疾病过程中,组织修复反应失调的结局。纤维化几乎发生在所有器官和组织中,例如心、肝、肺、肾、皮肤等,长期以来,人们一直认为纤维化不可逆,但临床前模型和临床试验均表明,它是一个高度动态变化的过程。当组织受到损伤时,多种来源的肌成纤维细胞可通过重塑细胞外环境来启动伤口愈合反应,以恢复组织完整性并促进实质细胞的替换。通常,当组织愈合时,这个促纤维化程序被关闭。然而,持续的损伤和损害会导致这一过程的失调,导致细胞外基质(ECM )蛋白在病理上的过度沉积,并伴随着肌成纤维细胞活性的上调,造成巨噬细胞和免疫细胞浸润的慢性炎症环境。在这种细胞环境中,细胞因子和生长因子被大量释放,包括转化生长因子-β(TGF-β)家族成员和 Wingless/Int-1(Wnt1),它们是纤维化过程的主要效应子。TGF-β 和 Wnt1 结合其干细胞表面受体,并发起下游信号转导,最终分别导致 Smad2/3 和 CBP/β-Catenin 转录调节物的核易位。这导致靶基因表达上调,其功能进一步增强肌成纤维细胞分化和 ECM 蛋白(包括胶原、层粘连蛋白和纤维连接蛋白)的产生和分泌。随着过多 ECM 沉积的进行,基体的结构发生变化并变硬。细胞通过细胞表面整合素受体(激活 Hippo 信号转导通路及其主要下游效应子 YAP 和 TAZ)的机械传导感受 ECM 张力。在另一个前向循环中,激活的 YAP 和 TAZ 转位到胞核,促进包括 CTGF 和 PDGF 在内的促生长基因的上调,这些基因通过 PI3K/AKT/mTOR 通路促进肌成纤维细胞的增殖和活化。纤维化损伤过程[2]常见的与纤维化有关的疾病有:特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)、肝硬化、慢性肾病、心肌梗死、心力衰竭以及非酒精性脂肪肝炎(NASH)等。纤维化还影响肿瘤侵袭和转移、慢性移植物排斥和许多进行性肌病的发病机制。除器官损伤外,纤维化还与癌症进展有关,因为纤维化 ECM 可刺激细胞增殖并改变细胞极性,从而促进肿瘤发育和生长。抗纤维化的应用领域广泛且机制具有一定的共性,因此专注于抗纤维化药企的平台技术具有通用性,目前各家企业的重心一般集中于抗肺纤维化、肝纤维化、肾纤维化、心血管纤维化以及皮肤、视网膜纤维化等领域,其中,领先企业往往先从IPF以及肝纤维化开始,然后进行延展。由于体外药效无法模拟真实体内纤维化环境,抗纤维化药物筛选只能使用漫长的体内试验来进行,几乎所有的新药筛选捷径,包括人工智能,都无法加快抗纤维化药物的研发进程。因此,临床前动物模型在药物研发过程中显得尤为重要,百奥动物自主研发了相应的肝纤维化和肺纤维化模型,为该领域临床前药效评价提供了稳定有效的工具,助力抗纤维化药物研究。肝纤维化模型四氯化碳(CCl4)诱导的肝纤维化四氯化碳(CCl4)诱导的小鼠肝纤维化是被广泛接受的研究肝纤维化实验模型。它在许多方面反映了与毒性损伤相关的人类疾病模式,如α-SMA表达、星状细胞活化和关键基质成分(包括胶原蛋白-1、基质金属蛋白酶及其抑制剂TIMPs)已在该模型的发病机制中得到证实。CCl4诱导肝纤维化模型的建立及组织学评价四氯化碳 (CCl4) 诱导的肝纤维化模型。8周龄雄性 C57BL/6 小鼠腹腔注射浓度为0.25、0.5和0.75 mL/kg的CCl4,每周2次。4、6和8周后小鼠的体重、肝重/体重和血液生化数据如上图。使用CCl4 诱导6周的肝纤维化模型。(A) H&E染色的代表性图片显示 CCl4 诱导后肝脏炎症增加。比例尺:50 μm。(B) 免疫组化的代表性图片,显示肝巨噬细胞(kupffer cells)标记物F480。(C-D) 天狼星红染色的代表性图片,显示肝纤维化增加。比例尺:200 μm。(E-F) 免疫组织化学的代表性图片显示肝脏中的成纤维细胞标志物α-SMA水平。比例尺:300 μm。 奥贝胆酸(OCA)在小鼠肝纤维化模型中的药效验证奥贝胆酸(OCA)治疗后肝纤维化减轻。(A) 图为经CCl4 诱导和 OCA 处理3周后,天狼星红染色显示肝纤维化的代表性图片。(B) 图表示天狼星红染色统计数据。数值为平均值±SEM。*p < 0.05。胆管结扎诱导的肝纤维化胆管结扎引起肝外胆道梗阻,从而导致胆管扩张和胆汁淤积。当胆管内压力进一步升高时,肝内胆管扩张破裂,肝内血管被扩张的胆管和外渗的胆汁同时压迫,肝细胞缺血坏死,纤维组织增生,围绕肝小叶向肝细胞周围扩散,最终可导致肝纤维化。胆管结扎诱导肝纤维化模型的建立胆管结扎肝纤维化模型。(A) 图表示血清中ALT、AST、ALP、GGT和TBIL水平。 (B) 图表示BDL后4周肝脏代表性外观。数值为平均值±SEM。*p<0.05, ***p<0.001, ****p<0.0001。胆管结扎所致肝纤维化模型的组织学评价胆管结扎4周后H&E和天狼星红染色。(A) 图表示H&E染色代表性病理改变。(B) 图天狼星红染色代表性图片显示肝纤维化增加。(C) 图表示胶原纤维阳性信号区比例。数值为平均值±SEM。* p < 0.05。胆管结扎4周后免疫组化染色。 (A-B) 免疫组化染色的代表性图像显示 F4/80 和阳性信号区比例。(C-D) 免疫组化染色代表性图像显示α-SMA水平和阳性信号区比例。硫代乙酰胺(TAA)诱导的肝纤维化模型硫代乙酰胺 (TAA) 是一种广泛用于模拟肝纤维化发病机制中产生损伤的化合物。TAA 通过其代谢产物硫代乙酰胺二氧化硫 (TASO2) 增加活性氧 (ROS) 的形成,引起严重的氧化应激以及脂质过氧化和蛋白质羰基和 DNA 加合物的生成。产生的ROS,引起肝星状细胞 (HSC) 活化,同时诱导造血干细胞转分化为肌纤维母细胞样细胞,导致 EMC 合成和降解失衡及持续纤维化过程。TAA诱导肝纤维化模型的建立及组织学评价TAA 诱导肝纤维化模型4周。(A-B) 血清中 ALT 和 AST 水平。(C) H&E染色的代表性图片。(D-E) 免疫组化染色的代表性图像显示α-SMA水平和阳性信号区比例。(G-F) 天狼星红染色的代表性图像显示肝纤维化增加。TAA 诱导肝纤维化模型6周。(A-B) 血清中 ALT 和 AST 水平。(C) H&E染色的代表性图片。(D-E) 免疫组化染色代表性图像显示α-SMA水平和阳性信号区比例。(F-G) 天狼星红染色的代表性图片,显示肝纤维化增加。肺纤维化模型博来霉素(BLM)诱导的肺纤维化小鼠模型博来霉素 (BLM) 能够引起与接受化疗患者相似的组织学肺模式,是目前诱导动物肺纤维化应用最广泛的药物之一。BLM 通过裂解DNA、诱导炎症反应和增加上皮凋亡剂量发挥其细胞毒性作用,从而刺激肺损伤并导致纤维化。 肺纤维化小鼠模型的建立及组织学评价博来霉素诱导的肺纤维化。C57BL/6J 小鼠在第0天给予博来霉素,每天记录体重,实验结束时收集肺组织,测定肺内羟脯氨酸 (HYP)。 (A) 博来霉素导致体重减轻。 (B)存活率缩短。 (C) HYP 含量增加。 (D) 病理学检查显示显著肺纤维化。 Pamrevlumab 在肺纤维化模型(B-hCCN2小鼠)中的药效验证Pamrevlumab 对博来霉素诱导的体重减轻的影响。B-hCCN2 小鼠在第0天给予博来霉素,然后每两天注射一次 Pamrevlumab 或溶剂,共7次,每天记录体重。实验结果表明,Pamrevlumab治疗能够改善博来霉素诱导的 B-hCCN2 小鼠体重减轻,并可有效降低博来霉素诱导的死亡率。Pamrevlumab 对博来霉素诱导的肺纤维化的影响。 (A) 博来霉素诱导 HYP 含量增加,Pamrevlumab 治疗降低了肺中 HYP 含量。(B) Masson 染色和H&E染色的代表性图像。(C) 条形图显示了纤维化严重程度的定量平均评分。数值为平均值±SEM,n = 4-8,单因素 ANOVA 和 Dunnett 检验,***P < 0.001,**P < 0.01。Micro-CT在肺部疾病模型的研究应用博来霉素诱导肺纤维化模型—直方图、体积根据不同HU区间进行正常、低通气、不通气区域体积的分割。在第4周,结果显示低通气和不通气区域的比例都很高,然后在第10周和第16周之间明显减少,而在正常通气的区域,则呈现相反的趋势[3]。通过使用Micro-CT对小鼠肺部区域进行扫描重建成像,利用肺部分析算法(Hounsfield单位阈值范围分别为-434至-121HU和-120至121HU)实现对通气不良和非通气不良区域的影像区分,从而实现对肺部区域动态检测,并进行功能和结构的评价。量化的影像数据也能提供纵向研究的信息以减少动物之间的变异性,可以更进一步验证体外数据。百奥动物可以提供的模型及检测指标令人期待的未来突破勃林格殷格翰作为肺纤维化治疗领域的全球市场领导者,在这个存在高度未满足医疗需求的领域成功而大胆迈出的第一步是前文所说的尼达尼布(BI BF1120),而今年2月BI 1015550也已经被美国食品药品监督管理局(FDA)授予突破性治疗认定。勃林格殷格翰未来将启动一项III期临床试验,以进一步研究BI 1015550治疗IPF和进行性肺纤维化(PPF)患者的疗效,并希望能尽快让该药物惠及全球患者[4]。Pliant Therapeutics,Inc.是一家临床阶段的生物制药公司,致力于发现和开发用于治疗纤维化的新型疗法。今年7月,Pliant Therapeutics 也公布了其INTEGRIS-IPF IIa期试验积极结果,其药品PLN-74809在患有特发性肺纤维化(IPF)患者身上达到主要与次要终点,呈现剂量相关疗效,并具有良好的耐受性。2021年2月,北京泰德制药与美国Graviton Bioscience Corporation 签订治疗纤维化创新药TDI01海外授权合作协议,首付款及研发、销售里程碑付款最高可达 5.175亿美元。近年来,随着企业临床及各方面的不断推进、纤维化的细胞和分子机制不断被阐明,且新冠疫情后人们对于抗纤维化重视加深,叠加肿瘤赛道的逐渐拥挤,抗纤维化治疗领域被开发的价值不断体现。我们也期待早日拥有更多创新药物用于改善病患生活质量。参考来源:[1] https://mp.weixin.qq.com/s/L8QVMXsh_8-Kk1-iKbeQVA[2] Nie X , Qian L , Sun R , et al. Multi-organ proteomic landscape of COVID-19 autopsies - ScienceDirect[J]. Cell, 2021.[3] Song Shengren,Fu Zhenli,Guan Ruijuan et al. Intracellular hydroxyproline imprinting following resolution of bleomycin-induced pulmonary fibrosis.[J] .Eur Respir J, 2022.[4] https://mp.weixin.qq.com/s/EwbXZN77rPwapjFYdRexVQ

人类白细胞抗原:HLA,通常称之为MHC分子,是在6号染色体短臂上的一类基因。除同卵双生子以外几乎找不到HLA相同者,每个人的HLA千差万别,是识别人类白细胞的重要的分子标志,是免疫系统区分本身和异体物质的基础,具有非常重要的生物学功能。HLA有不同的基因座,编码两大类MHC蛋白。HLA在医学上的意义主要体现在器官移植,输血,疾病相关性,生理学等方面。人6号染色体HLA基因结构HLA复合体有224个基因座(locus),按其产物的结构、分布与功能分为三群。HLA-I经典I类基因: HLA-A、-B、-C参与递呈内源性抗原。非经典I类基因: HLA-E、-G、-F。HLA-II经典II类基因: HLA-DP 、-DQ、-DR参与递呈外源性抗原。非经典II类基因: LMP、TAP、HLA-DM、HLA-DO 参与抗原的加工和转运。HLA-Ⅲ包括编码补体C4、Bf、C2的基因。编码炎症相关分子TNF、HSP70等基因。HLA基因结构HLA基因功能HLA-I可以提供一般细胞内的一些状况,比如该细胞遭受病毒感染,则将病毒外膜蛋白加工成肽链,通过MHC展示到细胞膜表面,供杀手CD8+ T细胞的识别,以进行扑杀。表达于所有有核细胞表面,例外的仅有神经细胞、胰岛外分泌细胞、心肌细胞和精细胞等。HLA-II可以提供细胞外部的情况,像是组织中有细菌侵入,则巨噬细胞进行吞食后,把细菌蛋白加工成肽链,通过MHC展示给辅助性T细胞,启动体液免疫反应。只位于抗原提呈细胞(APC)表面,例如:B细胞、巨噬细胞、树突状细胞、胸腺上皮细胞和人活化的T细胞等。HLA分子对T细胞在胸腺内的分化成熟过程也起重要作用。体外研究发现:去除胸腺中MHCⅡ类抗原阳性的基质细胞,则CD4+ T细胞的发育受阻,在胸腺培养细胞中加入抗MHCⅡ类抗原的单克隆抗体,也能阻止CD4+ T细胞的发育。目前认为MHC分子在T细胞自身耐受的形成和T细胞库的产生中都起着重要作用。HLA-A2.1分子HLA-A2.1是HLA I 类A基因座,第2复等位基因第1号亚型,备受科学家们的关注。关注HLA-A2.1等位基因的原因有很多,下面将介绍其中的一些原因。T细胞的免疫反应依赖于肽与HLA分子的结合,因此研究者经常研究这些分子与各种抗原的相互作用。由于HLA的高度多态性,有成千上万的HLA分子可供选择,为了获得最大的相关性,研究最常见的表达等位基因是最有意义的。HLA-A2.1的肽结合基序早已为人熟知,HLA多聚体可用于抗原特异性T细胞的染色。甚至有小鼠表达HLA-A2.1等位基因,这使得在更接近人类的生物系统中进行临床前测试成为可能。针对HLA-A2.1分子机制研究的需求,BioMice百奥动物自主研发了B-HLA-A2.1 mice和B-NDG HLA-A2.1 mice,助力HLA-A2.1分子研究,为临床前药效评估提供了优质模型。B-HLA-A2.1 mice基本信息蛋白表达分析流式细胞术检测野生型C57BL/6小鼠(+/+)和纯合型B-HLA-A2.1小鼠(H/H)的脾细胞。野生型C57BL/6小鼠可检测到小鼠B2M和H-2Kb/H-2Db。人B2M和HLA-A2.1只在B-HLA-A2.1纯合小鼠中检测到,而小鼠B2M和H-2Kb/H-2Db在B-HLA-A2.1纯合小鼠中检测不到。 野生C57BL/6 (+/+)小鼠和纯合B-HLA-A2.1小鼠 (H/H)注射抗CD3E抗体后,取脾细胞进行流式细胞术检测。结果显示:野生C57BL/6小鼠可检测到小鼠B2M和H-2Kb/H-2Db。纯合B-HLA-A2.1小鼠中只能检测到人B2M和HLA-A2.1,检测不到小鼠B2M和H-2Kb/H-2Db。脾脏白细胞亚群分析从C57BL/6小鼠和纯合B-HLA-A2.1小鼠(n= 3,8周龄,雌性)中分离脾细胞。流式细胞术分析脾细胞以评估白细胞亚群。结果表明:纯合B-HLA-A2.1小鼠的B细胞、树突状细胞、粒细胞、单核细胞和巨噬细胞的百分率与C57BL/6小鼠相似。CD8+ T细胞百分率显著降低,CD4+ T细胞百分率和NK细胞百分率显著升高,说明hB2M-HLA-A2.1-H-2D替代小鼠B2M可能影响CD8+ T细胞的发育,进而影响脾脏T细胞亚型的比例。数值用平均值±SEM表示。在淋巴结和血液中得到同样的结果。脾脏T细胞亚群分析从C57BL/6和纯合B-HLA-A2.1小鼠(n= 3,8周龄,雌性)中分离脾细胞。流式细胞术分析脾细胞以评估T细胞亚群。结果表明:纯合B-HLA-A2.1小鼠中调节性T细胞的百分率与C57BL/6小鼠相似。CD8+ T细胞百分率显著降低,CD4+ T细胞百分率显著升高,说明hB2M-HLA-A2.1-H-2D替代小鼠B2M可能影响CD8+ T细胞的发育,进而影响脾脏T细胞亚型的比例。数值用平均值±SEM表示。在淋巴结和血液中得到同样的结果。B-NDG HLA-A2.1 mice基本信息蛋白表达分析流式细胞术检测B-NDG小鼠(+/+)和纯合B-NDG HLA-A2.1小鼠(H/H)脾细胞。结果表明:小鼠B2M和H-2Kb/H-2Db在B-NDG小鼠中检测到,但在B-NDG HLA-A2.1小鼠中检测不到。人B2M和HLA-A2.1在纯合B-NDG HLA-A2.1小鼠中检测到,而在B-NDG小鼠中未检测到。脾脏白细胞亚群分析从B-NDG小鼠和B-NDG HLA-A2.1小鼠(n= 3,6周龄,雌性)分离脾细胞。流式细胞术分析脾细胞以评估白细胞亚群。结果表明:纯合B-NDG HLA-A2.1小鼠树突状细胞、粒细胞、单核细胞和巨噬细胞的百分率与B-NDG小鼠相似,表明人源化的B2M和HLA-A2.1不改变这些细胞在脾脏的整体发育、分化和分布。数值用平均值±SEM表示。在骨髓和血液中得到同样的结果。人CD34+HSC免疫重建将人CD34+造血干细胞分别植入经0.8 Gy辐照过的B-NDG HLA-A2.1新生小鼠和B-NDG小鼠。(A) B-NDG HLA-A2.1小鼠存活率略低于B-NDG小鼠,但差异无统计学意义。(B)体重。将人CD34+造血干细胞分别植入经0.8 Gy辐照过的B-NDG HLA-A2.1新生小鼠和B-NDG小鼠。流式细胞术检测人白细胞。结果表明,虽然B-NDG HLA-A2.1小鼠的人CD8+ T细胞比例明显低于B-NDG小鼠,但重建24周内人CD8+ T细胞比例仍维持在18%左右。B-NDG HLA-A2.1小鼠人CD4+ T细胞比例明显高于B-NDG小鼠。B-NDG HLA-A2.1小鼠中其他重组细胞类型的比例与B-NDG小鼠相似。参考资料1、Van Laethem, F., Tikhonova, A.N. & Singer, A. MHC restriction is imposed on a diverse T cell receptor repertoire by CD4 and CD8 co-receptors during thymic selection. Trends in immunology 33, 437-441 (2012).2、Garcia, K.C., Adams, J.J., Feng, D. & Ely, L.K. The molecular basis of TCR germline bias for MHC is surprisingly simple. Nature immunology 10, 143-147 (2009).