
【英文名】Valsartan AHU377【产品简介】LCZ696-ABA is a supramolecular complex which comprises six moieties of 4-{[(1S,3R)-1-([1,1´-biphenyl]-4-ylmethyl)-4-ethoxy-3-methyl-4-oxobutyl]amino}-4-oxobutanoic acid (NEPi molecular moiety, AHU377 free acid) and six moieties of N-pentanoyl-N-{[2´-(1H-tetrazol-5-yl)[1,1´-biphenyl]-4-yl]methyl}-L-valine (ARB molecular moiety, Valsartan) in their anionic forms, 18 sodium cations, and 15 water molecules (refer to Figure 1-1 for the chemical structure of NEPi and ARB moieties)AHU377:CAS: 149709-62-6分子式:C19H18ClN3O5S 分子量:149709-62-6规 格:200mg【注册分类】化药3.1+3.2类 【适应症】慢性心力衰竭和高血压【用法用量】每天两次。【上市信息】国内外均未上市,诺华预计将于2015年初提交LCZ696在欧盟的上市许可申请(MAA)【知识产权】无【药理药效】AHU377和血管紧张素IIAT1受体拮抗剂缬沙坦以1:1的摩尔比组成LCZ696,LCZ696属于血管紧张素II(AT2)受体和脑啡肽酶(Neprilysin)受体双重抑制剂,其降压效果要优于标准降压药物,是一种新型治疗心力衰竭的药物。AHU377是一种前体药物,它可以转换酶乳沟LBQ657乙酯的活动形式。目前该药里程碑III期疗效和安全性超越临床标准药物依那普利。【产品优势】在未来数年,心血管领域将无任何药物能与LCZ696抗衡。一些分析师预测,LCZ696销售峰值高达80亿美元,而德意志银行分析师预计,鉴于LCZ696降低心血管关键风险的优越表现,该药的销售峰值将达到60亿美元。尽管各方数据稍有差异,但毫无疑问的是,LCZ696将成为超级重磅明星,将引领心血管治疗大跨步进入新的时代 Produc No.PR1001Product NameRivaroxabanCAS No.366789-02-8Specificationinner quality standardBrief IntroductionRivaroxaban, a FXa inhibitor, is the active ingredient in Tablets with the chemical name 5-Chloro-N-({(5S)-2-oxo-3-[4-(3-oxo-4-morpholinyl)phenyl]-1,3-oxazolidin-5yl}methyl)-2-thiophenecarboxamide. The molecular formula of rivaroxaban is C19H18ClN3O5S and the molecular weight is 435.89. Each XARELTO tablet contains 10 mg, 15 mg, or 20 mg of rivaroxaban.

【产品简介】商品名:Eliquis(艾乐妥)CAS: 503612-47-3分子式:C25H25N5O4 分子量:459.5 规 格:2.5mg、5mg结构式:【注册分类】化药3+6类 【适应症】抗血栓【用法用量】口服,一次2.5mg,一日两次,或遵医嘱.【上市信息】2011年5月,阿哌沙班在欧盟27国及冰岛、挪威,率先批准用于髋关节或膝关节择期置换手术成人患者静脉血栓症的预防。2012年11月20日,欧盟委员会批准阿哌沙班用于具有一个或多个风险因素的非瓣膜性房颤(NVAF)成人患者卒中和体循环栓塞的预防。随后加拿大药监局、日本、美国FDA批准阿哌沙班用于具有一个或多个风险因素的非瓣膜性房颤(NVAF)成人患者卒中和体循环栓塞的预防。2013年在中国上市。目前被批准用于髋关节或膝关节择期置换术的成年患者,预防静脉血栓栓塞症(VTE)。【知识产权】本品核心化合物专利为施贵宝公司2002年9月17日提交的美国专利申请号2003/0191115,对应中国已授权化合物专利02821537.0(CN1578660),保护期至2022.9.17。【药理药效】阿哌沙班(Apixaban ,ELIQUIS)是一种口服的选择性活化Ⅹ因子抑制剂,由辉瑞与百时美施贵宝联合开发。Apixaban是FXa的一种口服,可逆性,和选择性活性位点抑制剂。对其抗血栓活性不需要抗凝血酶III。Apixaban抑制游离和凝块-结合FXa,和凝血酶原酶活性。Apixaban对血小板聚集没有直接作用,但间接通过凝血酶诱导抑制血小板聚集,通过抑制FXa,apixaban减低凝血酶生成和血栓发展【产品优势】阿哌沙班是继达比加群、利伐沙班之后第三个上市的新型口服抗凝剂。其已在欧洲被批准用来预防接受择期髋关节或膝关节置换手术患者的静脉血栓栓塞性事件。 在欧洲批准的这三种口服抗凝剂中,与目前骨科手术后预防静脉血栓栓塞症的标准治疗方案依诺肝素相比,利伐沙班和阿哌沙班分别在RECORD试验和ADVANCE试验中突显优势。专家表示,把这些试验的结果并排来看,利伐沙班的疗效似乎略好,但出血情况比阿哌沙班严重。专家把这些差异归因于用药时间,在RECORD试验中利伐沙班是在手术后6-8个小时用药,而在ADVANCE试验中阿哌沙班是在手术后18个小时用药,这些药物的用药时间离手术越近,其疗效越好,但出血风险越高。百时美施贵宝/辉瑞公司拿ADVANCE试验中阿哌沙班的用药时间进行宣传,称阿哌沙班是唯一一种术后首次用药窗口期为12-24小时的口服抗凝药,可帮助医师在术后病人开始治疗前对其进行观察并稳定病情。然而,一天一次的新型口服抗凝剂利伐沙班,也有其优势。 另外一种抗凝药达比加群在骨科方面未显示出与上述两种抗凝剂相当的效果,它仅在两项研究中表现出不逊于当前标准治疗方案的疗效,在其他试验中仍较为逊色。但是达比加群是首个获美国FDA批准(2010年10月)可以用于非瓣膜性房颤的新型抗凝剂,即已在美国与加拿大获批用于预防房颤患者出现中风。利伐沙班虽对此适应症也显示出很好结果,但还没有获得批准。

【产品简介】商品名称:Pradaxa泰毕全CAS:872728-81-9 分子量:627.74分子式:C34H41N7O5规格:每粒110mg/150 mg 【注册分类】化药3+6类 【适应症】适用于有非瓣膜性心房颤动患者 中减低中风和全身栓塞的风险。【用法用量】150mg每天2 次【上市信息】由德国勃林格殷格翰公司开发,于2008年4月 在德国和英国率先上市,2010年10月19日,FDA宣布正式批准达比加群酯上市销售,适应症为心房颤动(AF)引发的中风预防。国内2013年2月获进口批准【知识产权】无【药理药效】凝血酶是细胞外胰岛素样丝氨酸蛋白酶,在凝血过程中具有重要作用,一方面,其能使纤维蛋白原裂解成为纤维蛋白,后者参与构成不溶性血栓基质;另一方面,其能诱导血小板活化和聚集,进而引发一系列次级凝血级联反应。达比加群酯为前药,在体内转化为有活性的达比加群,后者通过直接抑制凝血酶而发挥抗凝血效应。体外,达比加群能有效抑制人凝血酶活性[半数抑制浓度(ICs0)为9.3nmol /L],其对凝血酶的选择性[抑制常数(kl)为(4.5± 0.2)nmol/L]高于凝血因子Xa[Ki为(3760±20)nmol /L]、胰蛋白酶[Kl为(50.3±0.3)nmol/L]、纤维蛋白溶酶[K『为(1695±5O)nmol/L]和激活蛋白C [为(20930±1O)nmol/L]等。 【产品优势】达比加群酯是一种新型的合成的直接凝血酶抑制剂,是dabigatran的前体药物,属非肽类的凝血酶抑制剂。口服经胃肠吸收后,在体内转化为具有直接抗凝血活性的dabigatran。dabigatran结合于凝血酶的纤维蛋白特异结合位点,阻止纤维蛋白原裂解为纤维蛋白,从而阻断了凝血瀑布网络的最后步骤及血栓形成。dabigatran可以从纤维蛋白一凝血酶结合体上解离,发挥可逆的抗凝作用。达比加群酯口服用药后经胃肠道迅速吸收,用药后1h起效,2~3h即达血浆峰浓度,如果与食物同服,其血浆达峰时间后移。达比加群酯是直接凝血酶抑制剂,具有可以口服、强效、无需特殊用药监测、药物相互作用少等特点。体外、体内试验和临床各项研究均提示达比加群酯具有良好的疗效及药动学特性,临床应用前景乐观,其成功上市是抗凝血药物研究领域的一项重大突破。AF是常见的心律失常之一,在所有年龄人群中发病率达1%,在80岁以上人群中发病率达10%。它几乎见于所有的器质性心脏病,在非器质性心脏病也可发生。医学界普遍认为,由房颤(AF)导致中风的预防用药有很大的市场机会,据统计2008年全球抗凝血栓药物市场销售额为180亿美元,2009年达到了195亿美元。据医药界普遍预计,达比加群酯胶囊的远景销售目标将达到100亿美元左右,前景广阔。2008 年全球抗血栓药物市场销售额为180 亿美元,同比增长16%,而2009年增长率仅为7.95%,达195 亿美元,同时,抗凝血药物的全球市场容量将从2008年的约60 亿美元增长到2014 年的超过90 亿美元。在全球抗凝药物中,2011 年销售额最高的为赛诺菲的依诺肝素,诺华的依诺肝素以120%的增长率排在第二位;第三位为达比加群酯,2011 年增长率高达964%,说明该品种后劲十足,处于快速增长期;达比加群酯2011 年销售额为8.75 亿美元,与2010 年相比,增长率为964%,呈现了快速的增长态势 。
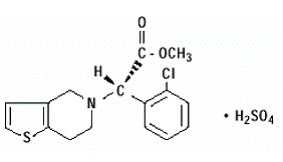
【产品简介】商品名称:波立维PlavixCAS:135046-48-9分子量:419.9分子式:C16H16ClNO2S•H2SO4规格:75mg 【注册分类】化药3+6类 【适应症】预防和治疗因血小板高聚集状态引起的心、脑及其它动脉的循环障碍疾病。【用法用量】波立维的推荐剂量为每天 75mg,与或不与食物同服,对于老年患者不需调整剂量。【上市信息】硫酸氢氯吡格雷是法国赛诺菲圣德拉堡制药公司于1986年研究开发成功的新一代的血小板聚集抑制剂,商品名为波立维。该产品于1998年3月率先在美国上市,随后进入欧洲、北美、澳洲、新加坡等多国市场,并于2001年8月在中国上市。2002年2月28日,基于CURE临床试验的结果之上,FDA正式批准抗血小板聚集药物波立维®的一项新的适应证为,可应用于急性冠脉综合征(不稳定心绞痛和非Q波性心梗)患者。【知识产权】本品不涉及侵犯他人专利的情况。【药理药效】本品为血小板聚集抑制剂,能选择性地抑制ADP与血小板受体的结合,随后抑制激活ADP与糖蛋白GPⅡb/Ⅲa复合物,从而抑制血小板的聚集。本品也可抑制非ADP引起的血小板聚集,不影响磷酸二酯酶的活性。本品通过不可逆地改变血小板ADP受体,使血小板的寿命受到影响。【产品优势】 氯吡格雷(Clopidogrel)是一种具有不可逆抑制血小板聚集的噻吩并吡啶化合物,化学结构与噻氯匹定(Ticlopidine)类似。与阿司匹林等药物不同,它产生抗血小板聚集作用不是通过花生四烯酸代谢途径而是通过抑制ADP对血小板的诱导作用。 氯吡格雷是一种ADP诱导血小板聚集的强抑制剂,大量与阿司匹林比较的III期试验证实它可用于预防动脉粥样硬化引起的缺血性中风、心肌梗塞和血管坏死等疾病。该药的耐受性好,临床疗效优于阿司匹林。

【产品简介】商品名称:Procoralan化学名:3-[3-[[(8S)-3,4-二甲氧基-8-双环[4.2.0]辛-1,3,5-三烯]甲基-甲氨基]丙基]-7,8-二甲氧基-2,5-二氢-1H-3-苯并氮杂卓-4-酮盐酸盐CAS:148849-67-6分子量:505.05分子式:C27H36N2O5.HCl规格:5mg、7.5mg(肠溶片)【注册分类】化药6+6 【适应症】用于禁用或不耐受β受体阻断剂、窦性心律正常的慢性稳定型心绞痛患者。【用法用量】推荐的初始剂量为5mg,一天两次。治疗3-4周后,根据疗效,可增至7.5mg,每天两次。如果在治疗过程中,患者静息心率持续低于50beats/min(bmp)或出现与心动过缓相关的症状,包括眩晕、疲劳或血压过低,则需要逐渐降低剂量,可降至2.5mg,每天两次。如果心率低于50bmp或心动过缓的症状持续,则需停止治疗。每天两次口服片剂,例如,早晚就餐各一次。【上市信息】2005年法国施维雅公司的伊伐布雷定在欧盟获得批准,同时获得了27个欧盟国家的批准,现已在英国和爱尔兰上市,在其他欧盟国家注册。【知识产权】无【药理药效】伊伐布雷定是第一个If电流阻滞剂类药物,If电流是心脏动作电位4期内向电流,内流离子主要是Na+,也有K+参与,是窦房结的主要起搏电流。主要用于禁用或不耐受β受体阻断剂、窦性心律正常的慢性稳定型心绞痛患者的对症治疗。2005年法国施维雅公司的伊伐布雷定在欧盟获得批准,同时获得了27个欧盟国家的批准,现已在英国和爱尔兰上市,在其他欧盟国家注册。伊伐布雷定特异选择性抑制窦房结的If内流,使起搏细胞动作电位舒张期去极延缓,从而减慢心率。只有用到目前伊伐布雷定临床使用剂量(7.5mg,每日2次)相应血浆治疗水平以上140倍浓度时,才可能影响窦房结表达的其他电流,包括Ik、Ica l和Icar,本品对If的高选择性使心率减慢适度,而不会在健康志愿者和冠心病患者身上导致过度心率减慢。 伊伐布雷定通过降低氧耗量恢复缺血心肌的氧供需平衡。并且明显延长舒张期时间和保持运动期间的冠状动脉扩张,提高冠状动脉灌注和对心肌的氧供。这些机制协同作用增强抗缺血效果。本品无负性变力性作用,可安全用于左室功能不全或心力衰竭的患者。不同于β受体阻滞剂,本品保持心脏对运动的适应性,例如冠状动脉扩张和左室收缩增强。在动物模型,恢复顿抑心肌的左室收缩功能不全,本品也优于阿替洛尔。本品无外周血管作用,适用于外周动脉闭塞性疾病或Raynaud综合征合并心绞痛的患者。保持左室的舒张可能用于心力衰竭,尤其舒张功能不全的患者更为有利。 伊伐布雷定与钙拮抗剂的比较:钙拮抗剂作为不能耐受或禁忌使用β受体阻滞剂的替代抗心绞痛药物,临床疗效与β受体阻滞剂类似。1200例稳定心绞痛患者被随机分别接受伊伐布雷定7.5mg每日2次和10mg每日2次,或氨氯地平10mg每日1次。伊伐布雷定与氨氯地平在提高运动耐量和减少心绞痛发作方面与氨氯地平等效。而休息和峰运动时的率-压积(rate-pressure product, RPP)在伊伐布雷定组明显低于氨氯地平组,表明伊伐布雷定更显著地降低了心肌耗氧量。伊伐布雷定没有氨氯地平相关的不良反应(踝部水肿、低血压或负性变力性作用)。【产品优势】盐酸伊伐布雷定是法国施维雅公司研发的一种新分子,是一种心脏起搏点f电流的选择性抑制剂。它对窦房结的特殊作用产生了一种单纯的心率降低作用,而对传导性、收缩性、复极化或血压没有相关的影响,通过降低CAD患者的心率,Ivobradine hydrochloride降低了运动时的心肌耗氧量,有助于氧平衡的恢复,减少了心肌的局部缺血及预防心绞痛的发生。用于治疗具有正常窦性节律、但是禁用或不耐受b受体阻断剂的稳定性心绞痛。于2005年11月获准在欧洲27个国家上市,剂型为片剂,规格有2.5mg、5mg和7.5mg。心绞痛是冠心病中较为常见的类型据报道,美国约有720万人患有心绞痛,并且以每年35万人的速度递增,因本病而死亡的人数高达50余万,占人口死亡总数的1/3-1/2,占心脏病死亡总数的50-75%。在我国,随着人民生活水平的提高,生活方式的改变以及生活节奏的加快,心绞痛的发病率逐年增高。以发病率居全国首位的北京为例,70年代心绞痛的病死率为21.7/10万,80年代为62.0/10万。目前仍呈上升趋势,已接近欧美国家水平。939例稳定型心绞痛患者被随机分为3组,分别接受1)伊伐布雷定5mg每日2次,1个月后增加剂量至7.5mg,每日2次,治疗3个月,再转为安慰剂2周;2)伊伐布雷定5mg每日2次,1个月后增加剂量至10mg,每日2次,3个月,再转为安慰剂;3)阿替洛尔50mg每日1次,增加剂量至100mg每日1次,3个月,再转为安慰剂。在基线与开始用药1和4个月做运动心电图试验。在增加运动耐量和减少心绞痛发作频度方面两药间无显著差异。两药都有明确的量效关系。伊伐布雷定5mg每日2次与增至7.5mg和10mg每日2次剂量时的疗效,分别类似于阿替洛尔50mg和100mg的疗效。心动过缓本品和阿替洛尔组分别为5.1%和5.5%,但严重心动过缓在本品组为0.2%,显著少于阿替洛尔的0.5%。钙拮抗剂作为不能耐受或禁忌使用β受体阻滞剂的替代抗心绞痛药物,临床疗效与β受体阻滞剂类似。1200例稳定心绞痛患者被随机分别接受伊伐布雷定7.5mg每日2次和10mg每日2次,或氨氯地平10mg每日1次。伊伐布雷定与氨氯地平在提高运动耐量和减少心绞痛发作方面与氨氯地平等效。而休息和峰运动时的率-压积(rate-pressure product, RPP)在伊伐布雷定组明显低于氨氯地平组,表明伊伐布雷定更显著地降低了心肌耗氧量。伊伐布雷定没有氨氯地平相关的不良反应(踝部水肿、低血压或负性变力性作用)。伊伐布雷定作为β受体阻滞剂的替代药物,是一种选择性或唯一性的阻滞剂,提供了治疗心绞痛的新的途径。与常用于治疗心绞痛的普通β受体阻滞剂不同,伊伐布雷定可以选择性的降低心率,因此不良反应较低。

【产品简介】商品名称:益适纯Zetia葆至能化学名:(1- (4-氟苯基)-(3R)-[3-(4-氟苯基)-(3S)-羟丙基]-(4S)-(4-羟苯基)-2-氮杂环丁酮)/1-(4-氟苯基)-(3R)-[3-(4-氟苯基)-(3S)-羟基丙基]-(4S)-(4-羟基苯基)-2-丙内酰胺CAS:16322-33-1分子量:409.42分子式C24H21F2N03规格:10mg【注册分类】化药6+6 【适应症】原发性高胆固醇血症:本品作为饮食控制以外的辅助治疗,可单独或与HMG-CoA还原酶抑制剂(他汀类)联合应用于治疗原发性(杂合子家族性或非家族性)高胆固醇血症,可降低总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、载脂蛋白B(ApoB)。【用法用量】患者在接受本品治疗的过程中,应坚持适当的低脂饮食。本品推荐剂量为每天1次,每次10mg,可单独服用或与他汀类联合应用。本品可在1天之内任何时间服用,可空腹或与食物同时服用。老年患者不需要调整剂量。年龄大于等于10岁的儿童及青少年不需要调整剂量。不推荐小于10岁儿童应用本品。轻度肝功能受损患者不需要调整剂量(Child-Pugh评分在5或6)(见药代动力学)。肾功能受损患者不需要调整剂量。与胆酸螯合剂合用:应在服用胆酸螯合剂之前2小时以上或在服用之后4小时以上服用本品。【上市信息】依折麦布由先灵葆雅公司 (2009年先灵葆雅被默克公司并购)研发, 2002年由先灵葆雅最早在美国上市,同年在德 国上市,2003年在英国、澳大利亚、瑞典、瑞 士及香港上市,此后陆续在奥地利、比利时、 法国、西班牙等国上市,2007年日本上市。 依折麦布+辛伐他汀同样由先灵葆雅公司研 发,2004年由先灵葆雅最早在美国上市,此后 陆续在英国、德国、法国、韩国、爱尔兰、澳 大利亚等二十多个国家和地区上市。 我国于2009年批准依折麦布辛伐他汀复方片剂 进口,2011年7月批准单方依折麦布片剂进 口。【知识产权】依折麦布化合物专利 CN1131416至2014年到期。另有制备方法和组 合物专利需注意。本品无行政保护及新药保 护。 我公司已对本品专利进行了全面检索和细致分 析,可保证对他人的专利不构成侵权。 【药理药效】 本品是一种口服、强效的降脂药物其作用机制与其它降脂药物不同(如他汀类胆酸鳌合剂(树脂类)苯氧酸衍生物和植物性固醇南化物)。本品附着于小肠绒毛刷状缘,抑制胆固醇的吸收.从而降低小肠中的胆固醇向肝脏中的转运,使得肝脏胆固醇贮量降低从而增加血液中胆固醇的清除。本品不增加胆汁分泌(如胆酸骜台剂).也不抑制胆固醇在肝脏中的合成(如他汀粪)。与安默剂比较,本品抑制小肠对胆固醇吸收的54%。他汀类减少肝脏合成胆固醇。两种药物合用可以进一步降低胆固醇水平优于两种药物的单独应用。本品选择性抑制胆固醇吸收的同时并不影响小肠对甘油三酯、脂肪酸.胆汁酸,孕酮、乙炔雌二醇及脂溶性维生素A、D的吸收。本品和HMG-CoA还原酶抑制剂联合使用与任何一种药物单独治疗相比能有效改善血清中Tc.LDL-c,ApoB,TG及HDL-c水平,依折麦布单独使用或与HMG-COA还原酶抑制剂联合使用对心血管疾病发病率与死亡率的效果还未建立。

【产品简介】商品名称:立普妥,Lipitor化学名:7-[2-(4-氟苯基)-3-苯基-4-(苯胺基甲酰基)-5-(2-丙基)吡咯-1-基]-3,5-二羟基庚酸钙;[R,(R﹡,R﹡)]-2-(4-氟苯基)-β,α-二羟基-5-(1-甲基乙基)-3-苯基-[(苯胺基)-羟基]-1H-吡咯-1-庚酸钙盐CAS:134523-03-8分子量:1195.42分子式:C66H68CaF2N4O10规格:10mg、20mg、40mg【注册分类】化药6+6 【适应症】本品可治疗其总胆固醇升高,低密度脂蛋白胆固醇升高,载脂蛋白B升高和甘油三酯升高。原发性高胆固醇血症患者,包括家族性高胆固醇血症(杂合子型)或混合性高脂血症(相当于Fredrickson分类法的Ⅱa和Ⅱb型)患者,如果饮食治疗和其他非药物治疗疗效不满意,可应用本品。在纯合子家族性高胆固醇血症患者,阿托伐他汀钙可与其他降脂疗法合用或单独使用(当无其他治疗手段时),以降低总胆固醇和低密度脂蛋白胆固醇。 【用法用量】口服,每日一次,每次1片。病人在接受阿托伐他汀钙治疗前及治疗过程中都要进行标准的低胆固醇饮食。推荐起始剂量为10mg/日,剂量范围10-60mg/日,应用2-4周内监测血脂水平, 剂量根据治疗目标和疗效反应作相应调整。【上市信息】华纳-兰伯特(现并入辉瑞)1997年获FDA批准。目前已在英国、德国等多个国家和地区上市。进口:2000年片剂获准进口(Godecke AG。Berlin)。【知识产权】本品不存在专利及行政保护方面的申报限制 【药理药效】本品为他汀类血脂调节药,属HMG-CoA还原酶抑制剂。本身无活性,口服吸收后的水解产物在体内竞争性地抑制胆固醇合成过程中的限速酶羟甲戊二酰辅酶A还原酶,使胆固醇的合成减少,也使低密度脂蛋白受体合成增加,主要作用部位在肝脏,结果使血胆固醇和低密度脂蛋白胆固醇水平降低,中度降低血清甘油三酯水平和增高血高密度脂蛋白水平。由此对动脉粥样硬化和冠心病的防治产生作用。【产品优势】阿托伐他汀钙片(立普妥,Lipitor)是目前全球处方量最多的降胆固醇药物,原研厂家是华纳-兰伯特(已并入美国辉瑞),自1997年在全球上市以来,销售额节节攀升。2002年销售额达到79.72亿美元,成为全球最畅销药物,2004年销售额突破100亿美元大关,独领风骚。 立普妥于1999年9月30日在中国获得行政保护,并于2007年3月30日到期,2000年片剂首次获得进口批文。国产首家获得阿托伐他汀钙原料和制剂批文的北京嘉林药业股份有限公司于1999年获得文号,商品名:阿乐,刚好抢在了立普妥获得行政保护之前。然而,河南天方另辟了一条新路,关注阿托伐他汀钙胶囊的研发,终于在2005年获得了胶囊的批文,商品名:尤佳,到目前为止,也仅此一家。在国内,2007年立普妥占据了阿托伐他汀钙75%左右的市场份额,优势明显。近年来,阿乐和尤佳的销售额也一直保持增长的势头,抢占了立普妥一部分的市场。 2010年至今,国内先后有五家国产企业取得阿托伐他汀钙原料药的批文,分别是:浙江新东港、石家庄华盛、北京万生、浙江海正、湖南迪诺,而还在申报中和准备申报正在研发的企业也为数不少。进口方面,现只有印度CADILA和美国PFIZER持有原料药的《进口药品注册证》。

【产品简介】商品名称:Crestor/可定化学名:双-(E)-7-[4-(4-氟基苯基)-6-异丙基-2-[甲基(甲磺酰基)氨基]-嘧啶-5-基](3R,5S)-3,5-羟基庚-6-烯酸]钙盐(2:1)CAS:147098-20-2分子量:1001.13分子式:(C22H27FN3O6S)2Ca规格: 5mg、 10mg、20mg【注册分类】化药6+6 【适应症】本品适用于经饮食控制和其它非药物治疗(如:运动治疗、减轻体重)仍不能适当控制血脂异常的原发性高胆固醇血症(Iia型,包括杂合子家族性高胆固醇血症)或混合型血脂异常症(Iib型)。本品也适用于纯合子家族性高胆固醇血症的患者,作为饮食控制和其它降脂措施(如LDL去除疗法)的辅助治疗,或在这些方法不适用时使用。【用法用量】口服。本品常用起始剂量为5mg,一日一次。起始剂量的选择应综合考虑患者个体的胆固醇水平、预期的心血管危险性以及发生不良反应的潜在危险性。对于那些需要更强效地降低低密度脂蛋白胆固醇(LDL-C)的患者可以考虑10mg一日一次作为起始剂量,该剂量能控制大多数患者的血脂水平。如有必要,可在治疗4周后调整剂量至高一级的剂量水平。本品每日最大剂量为20mg。【上市信息】日本盐野义研制开发,1998年转让给阿斯利康,2002年7月首次在荷兰上市,2003年8月在美国上市。 瑞舒伐他汀钙原料:山东新时代、上虞京新药业、济南金达、江苏正大天晴。瑞舒伐他汀钙片:鲁南贝特、上虞京新药业、江苏正大天晴等国产和阿斯利康进口。【知识产权】未有相关专利。【药理药效】瑞舒伐他汀是一种选择性、竞争性的HMG-CoA还原酶抑制剂。HMG-CoA还原酶是3-羟-3-甲戊二酰辅酶A转变成甲羟戊酸过程中的限速酶,甲羟戊酸是胆固醇的前体。动物试验与细胞培养试验结果显示,瑞舒伐他汀被肝脏摄取率高,并具有选择性,肝脏是降低胆固醇的作用靶器官。体内、体外试验结果显示,瑞舒伐他汀能增加细胞表面的肝LDL受体数量,由此增强对LDL的摄取和分解代谢,并抑制肝脏VLDL合成,从而减少VLDL和LDL颗粒的总数量。对于纯合子与杂合子家族性高胆固醇血症患者、非家族性高胆固醇血症患者、混合型血脂异常患者、瑞舒伐他汀能降低总胆固醇、LDL-C、ApoB、非HDL-C水平。瑞舒伐他汀也能降低TG、升高HDL-C水平。对于单纯高甘油三酯血症患者,瑞舒伐他汀有降低总胆固醇、LDL-C、VLDL-C、ApoB、非HDL-C、TG水平,并升高HDL-C水平。尚未确定瑞舒伐他汀对心血管发病率与死亡率的影响。【产品优势】瑞舒伐他汀钙是日本盐野义制药公司于20世纪80年代末合成、筛选得到的一个氨基嘧啶衍生物,其原开发代号为S-4522。除日本等某些亚洲国家之外的世界范围开发、上市和销售权益已于1998年6月转让给了AstraZeneca公司,2002年在荷兰上市,2003年8月在美国正式获准上市。商品名为CrestorTM。目前已在全球近百个国家上市销售,是目前上市降血脂药物中降脂作用最强、调脂功效最全面的他汀类药物,比目前世界公认疗效最好的阿伐他汀具有更好的降低低密度脂蛋白和提高高密度脂蛋白的作用,并且具有更好的耐受性、副作用更低和独特的药代动力特征,半衰期约20h,每天只需服用一次。2004年9月份本品的全球处方量就已经达到1000万张,而且销量额迅速增长,因此被称为世界重磅炸弹式超级他汀。瑞舒伐他汀钙是目前降脂药中降低低密度脂蛋白胆固醇(LDL-C)最为强效的药物,优于其他他汀,被称为“超级他汀”。STELLAR研究显示:瑞舒伐他汀10mg即可降低LDL-C达46%,这一结果相当于40mg阿托伐他汀、80mg辛伐他汀所达到的疗效。而普伐他汀、氟伐他汀则在最大剂量也无法达到该疗效。

【产品简介】商品名称:ZYPREXA(再普乐) 化学名称:2-甲基-10-(4-甲基-1-哌嗪)-4H-噻吩并[2,3-b][1,5] 苯并二氮杂分子式:C17H20N4S 分子量:312.43 CAS号:132539-06-1 规 格:2.5mg,5mg,7.5mg,10mg【注册分类】化药6+6类 详情请点击 奥氮平 href="http://db.yaozh.com/index.php?action=zhuce&search=search&name=奥氮平片&isjing=1&shoulihao_1=&zc_qiyemingcheng=&zc_zhucefenlei=&zc_zhuangtaikaishishijians=&zc_zhuangtaikaishishijiane=&zc_chenbanriqis=&zc_chenbanriqie=&zc_banlizhuangtai=&zc_yaopinleixing=&zc_shenqingleixing=&submit_namess=" 奥氮平片【适应症】奥氮平适用于精神分裂症及其它有严重阳性症状和 /或阴性症状的精神病的急性期和维持期的治疗,也可缓解精神分裂症及相关疾病的继发性情感症状。【用法用量】本品的推荐起始剂量为每日10mg(2片),饭前或饭后服均可。剂量范围为每日5~20mg(1~4片)。每日剂量应根据临床状况而定。超过每日10mg(2片)的常规用药剂量,应先进行适当的临床评估。女性患者、老年患者、严重肾功能损害或中度肝功能损害患者,起始剂量为每日5mg(1片)。低血压患者,奥氮平低代谢率患者(妇女≥65岁,非吸烟者),奥氮平的首服剂量为5mg/d。心血管疾病、脑血管疾病或其他会引起低血压疾病及肝功不良、癫痫患者应慎服奥氮平,服奥氮平后常引起瞌睡,故机械操作及开车时应慎服。【上市信息】1996年奥氮平获准在美国上市。【知识产权】本品不存在专利及行政保护方面的申报限制。【药理药效】奥氮平是一种抗精神病药,对多种受体系统具有药理作用。动物试验表明,奥氮平对 5-HT、多巴胺D、α-肾上腺素、组胺H等多种受体有亲和力。动物行为研究表明,奥氮平具有5-HT、多巴胺和胆碱能拮抗作用,与其受体结合情况相符。奥氮平的体外和体内5-HT 2 受体亲和力大于其与多巴胺D 2 受体的亲和力。电生理研究表明,奥氮平选择性地减少间脑边缘系统(A10)多巴胺能神经元的放电,而对纹状体(A9)的运动功能通路影响很小。奥氮平在低于产生僵住反应的剂量水平时能减少条件性回避反应。与其它抗精神病药不同,奥氮平在抗焦虑测试中能增加反应。对照临床试验结果表明,奥氮平能显著改善阴性及阳性症状。 动物研究表明:大剂量奥氮平对部分动物血液学的部分指标有可逆性的影响,但对骨髓没有毒性作用。【产品优势】本品自从1996年9月获准上市以来,已经在84个国家1600万患者中使用过。是*个获准用于精神分裂症长期治疗的新一代非典型抗精神病药物。同时,本品也是*个获准用于治疗急性双相躁狂症的非典型抗精神病药。与传统的抗精神病药相比,本品在许多方面疗效显著,比如对幻觉、妄想、冷漠、社交障碍等症状的控制。 市场前景 随着社会节奏的加快和压力的增加,精神性疾病的患病人群也在不断的增加。据IMS统计,1999年全球抗精神分裂症药物市场销售总额为50亿美元,而2004年,仅一个治疗精神分裂症的药物再普乐(奥氮平)的销售就达到了43亿美元,其市场增长十分迅猛。预计从2000年到2009年,全球八大抗精神分裂症药物市场年增长率为60%。目前该市场由两个药物主宰:礼来公司的“再普乐”(奥氮平)和强生公司的“维思通”(利培酮),两个药物共占据整个抗精神分裂症药物市场份额的65%。据IMS health,IMS National Sales Perspectives在2006年初的报告,美国医药市场2001-2005年抗精神病药物的总销售额领先的品种依次为奎硫平、奥氮平和利培酮,2005年的销售额分别为25.96亿美元、25.4亿美元和23.10亿美元。全球1%的患病率为抗精神分裂症药物提供了巨大的发展空间。 该药2004年全球销售额为43亿美元,全球已经有1800 万病人使用过该药。2005年该药大约排在全球畅销十大药物的第7位,销售额47亿美元。本品1999年在中国上市,2003年在中国被精神分裂症防治指南列为一线用药,该产品属于国家医保产品。

【产品简介】商品名称:ZYPREXA(再普乐) 化学名称:2-甲基-10-(4-甲基-1-哌嗪)-4H-噻吩并[2,3-b][1,5] 苯并二氮杂分子式:C17H20N4S 分子量:312.43 CAS号:132539-06-1 规 格:2.5mg,5mg,7.5mg,10mg【注册分类】化药6+6类 详情请点击 奥氮平 href="http://db.yaozh.com/index.php?action=zhuce&search=search&name=奥氮平片&isjing=1&shoulihao_1=&zc_qiyemingcheng=&zc_zhucefenlei=&zc_zhuangtaikaishishijians=&zc_zhuangtaikaishishijiane=&zc_chenbanriqis=&zc_chenbanriqie=&zc_banlizhuangtai=&zc_yaopinleixing=&zc_shenqingleixing=&submit_namess=" 奥氮平片【适应症】奥氮平适用于精神分裂症及其它有严重阳性症状和 /或阴性症状的精神病的急性期和维持期的治疗,也可缓解精神分裂症及相关疾病的继发性情感症状。【用法用量】本品的推荐起始剂量为每日10mg(2片),饭前或饭后服均可。剂量范围为每日5~20mg(1~4片)。每日剂量应根据临床状况而定。超过每日10mg(2片)的常规用药剂量,应先进行适当的临床评估。女性患者、老年患者、严重肾功能损害或中度肝功能损害患者,起始剂量为每日5mg(1片)。低血压患者,奥氮平低代谢率患者(妇女≥65岁,非吸烟者),奥氮平的首服剂量为5mg/d。心血管疾病、脑血管疾病或其他会引起低血压疾病及肝功不良、癫痫患者应慎服奥氮平,服奥氮平后常引起瞌睡,故机械操作及开车时应慎服。【上市信息】1996年奥氮平获准在美国上市。【知识产权】本品不存在专利及行政保护方面的申报限制。【药理药效】奥氮平是一种抗精神病药,对多种受体系统具有药理作用。动物试验表明,奥氮平对 5-HT、多巴胺D、α-肾上腺素、组胺H等多种受体有亲和力。动物行为研究表明,奥氮平具有5-HT、多巴胺和胆碱能拮抗作用,与其受体结合情况相符。奥氮平的体外和体内5-HT 2 受体亲和力大于其与多巴胺D 2 受体的亲和力。电生理研究表明,奥氮平选择性地减少间脑边缘系统(A10)多巴胺能神经元的放电,而对纹状体(A9)的运动功能通路影响很小。奥氮平在低于产生僵住反应的剂量水平时能减少条件性回避反应。与其它抗精神病药不同,奥氮平在抗焦虑测试中能增加反应。对照临床试验结果表明,奥氮平能显著改善阴性及阳性症状。 动物研究表明:大剂量奥氮平对部分动物血液学的部分指标有可逆性的影响,但对骨髓没有毒性作用。【产品优势】本品自从1996年9月获准上市以来,已经在84个国家1600万患者中使用过。是*个获准用于精神分裂症长期治疗的新一代非典型抗精神病药物。同时,本品也是*个获准用于治疗急性双相躁狂症的非典型抗精神病药。与传统的抗精神病药相比,本品在许多方面疗效显著,比如对幻觉、妄想、冷漠、社交障碍等症状的控制。 市场前景 随着社会节奏的加快和压力的增加,精神性疾病的患病人群也在不断的增加。据IMS统计,1999年全球抗精神分裂症药物市场销售总额为50亿美元,而2004年,仅一个治疗精神分裂症的药物再普乐(奥氮平)的销售就达到了43亿美元,其市场增长十分迅猛。预计从2000年到2009年,全球八大抗精神分裂症药物市场年增长率为60%。目前该市场由两个药物主宰:礼来公司的“再普乐”(奥氮平)和强生公司的“维思通”(利培酮),两个药物共占据整个抗精神分裂症药物市场份额的65%。据IMS health,IMS National Sales Perspectives在2006年初的报告,美国医药市场2001-2005年抗精神病药物的总销售额领先的品种依次为奎硫平、奥氮平和利培酮,2005年的销售额分别为25.96亿美元、25.4亿美元和23.10亿美元。全球1%的患病率为抗精神分裂症药物提供了巨大的发展空间。 该药2004年全球销售额为43亿美元,全球已经有1800 万病人使用过该药。2005年该药大约排在全球畅销十大药物的第7位,销售额47亿美元。本品1999年在中国上市,2003年在中国被精神分裂症防治指南列为一线用药,该产品属于国家医保产品。

【英文名】sildenafil citrate 【产品简介】商品名:万艾可化学名:1-[4-乙氧基-3-[5-(6,7-二氢-1-甲基-7-氧代-3-丙基-1H-吡唑并[4,3d]嘧啶)]苯磺酰]-4-甲基哌嗪枸橼酸盐分子式:C28H38N6O11S分子量:666.70CAS:171599-83-0【注册分类】化药6+6类 详情请点击 【适应症】适用于治疗阴茎勃起功能障碍(ED)。【用法用量】口服。服用时间:性生活前15min~4h服用均可,最好在性活动前1h服用。大多数人服用后约30min起效。有的15min左右即起效,60min药效达高峰,药物疗效可以维持4~8h。避免高脂肪饮食。空腹服药(饭前2h或饭后3~4h)效果更佳。建议可从每次100mg开始,其后可减量调整。根据疗效及耐受性可以减到每次50mg。每日剂量不宜超过l00mg。每日最多服用1次。【上市信息】美国辉瑞(Pfizer)制药公司研制生产的一种治疗心绞痛的药物。在临床试验中发现其治疗心绞痛的效果一般,而对治疗阳痿却有特殊效果,这一意外发现,促使厂家干脆以治疗阳痿的药物申报。美国食品和药品管理局(FDA)于1997年3月27日正式批准该药作为治疗阳痿的专用药物。【知识产权】未发现与之相关的侵犯他人知识产权的情况。【药理药效】本品是治疗阴茎勃起功能障碍(ED)的口服药。它是西地那非的枸橼酸盐,一种对环磷酸鸟苷(cGMP)特异的5型磷酸二酯酶(PDE5)选择性抑制剂。 作用机制:阴茎勃起的生理机制涉及性刺激过程中阴茎海绵体内一氧化氮(NO)的释放。NO激活鸟苷酸环化酶导致环磷酸鸟苷(cGMP)水平增高,使海绵体内平滑肌松弛,血液充盈。【产品优势】据了解,目前在中国,ED(勃起功能障碍)市场是辉瑞万艾可、礼来希爱力、拜耳艾力达的天下。包括辉瑞旗下“蓝色小药丸”万艾可(通用名:西地那非)、礼来旗下“黄色小药丸”希爱力(通用名:他达拉非)以及拜耳旗下“橘红色小药丸”艾力达(通用名:伐地那非),但最被消费者熟知和接受的仍然是“伟哥”万艾可。成都市内某大型连锁药房的销售数据显示,万艾可零售价为128元/粒,销售份额占ED类药物的65%;希爱力零售价138元/粒,占32.8%;艾力达128元/粒,占2.2%。国信证券研报显示,假设国内约1.4亿的ED患者有30%接受治疗,则接受治疗人数0.42亿人;假设仿制药上市后定价分别为20元/粒,30元/粒,40元/粒,50元/粒,60元/粒,接受治疗的ED患者每年分别使用5次 (粒)、10次(粒)、15次(粒)、20次(粒),中国潜在市场规模达百亿元级别。而目前ED正规治疗药品仅10亿元规模,未来具数十倍潜在增长空间。另外,来自世卫组织的统计显示,全球患有勃起机能障碍的男性约10%。按此计算,其市场容量在600亿~1000亿元。不过,ED(勃起功能障碍)市场并非一潭静水。来自IMS(艾美仕市场研究公司IMS Health)的数据显示,2013年市场份额为:万艾可占据着27个城市中58.8%的市场份额,希爱力为34.6%,艾力达为6.6%;而2012年这一数据分别是:万艾可为62.8%,希爱力为32.1% ,艾力达为5.1%。由此可以看出,2013年希爱力和艾力达的市场份额小幅上升,其中希爱力与万艾可仍相差24.2个百分点,万艾可小幅下降,但仍占据着市场份额的50%以上。来自礼来市场部门的数据显示,礼来中国自2013年年底推出希爱力每日一次5mg小剂量以来,以医院的40个城市和零售的8个重点城市作为起步市场,希爱力每日一次的治疗方案得到中国的男科和泌尿科专家认可,希爱力每日一次已经占医院希爱力销量的15%。面对礼来希爱力等巨头的步步紧逼,辉瑞中国商务及多元化业务事业部总经理肖卫红曾对外表示:“辉瑞并不怕竞争,欢迎竞争对手和我们一起把ED市场做起来。”辉瑞中国企业沟通部总监席庆也表示,目前万艾可在中国ED药物市场的总体份额(药店加医院渠道)仍然占有绝对的领先优势。虽然万艾可的在华专利将于今年6月份到期,但作为第一个在华上市的ED药物,万艾可上市十年来已经在广大患者和医务人员中积累了很高的品牌知名度和信誉度,加上中国的ED药物市场还远没有充分开发,辉瑞对万艾可在华专利到期后的前景仍然持乐观态度。不过,与辉瑞和礼来花大力气营销ED用药不同,几乎与希爱力同期进入中国市场的“德国伟哥”拜耳艾力达则并未参与营销层面的角逐。自2010年以来,拜耳公司将艾力达的营销及销售授权给中国企业去做。这在当年被业内人士解读为“中国市场太大,跨国药企太忙”。不过即便如此,艾力达2013年6.6%的市场份额也轻松取得超过5000万元的销售额。据悉,希爱力计划将零售渠道和医院渠道的发展比例从3:1调整为4:1。在医院、零售两大主要渠道中,礼来采取前期更多发挥医院渠道优势,相对避开辉瑞强大的零售渠道,辉瑞则选择在强势的零售渠道守住优势。渠道无疑是辉瑞手中最重要的“一张牌”。2011年,辉瑞力推中国男性健康相关行动,通过在部分零售门店中开设男性健康中心,整合了原本分散销售的男科处方药和计生器械,由此有效拉动了万艾可当年的销售。据悉,当年万艾可在全国60个城市的5000多家药店中总销量排名第二。资深营销专家袁建军对外资药企营销有着多年的观察。据他了解,辉瑞对于万艾可的营销可谓做到极致,辉瑞很早就深入三四线城市的药店对万艾可进行营销、学术推广活动。甚至许多新药店开张,辉瑞的零售团队都会带着万艾可的海报和药品介绍前去捧场与宣传,基本做到了凡是有正规药店的地方就有“伟哥”。尽管外资药企三巨头中,希爱力与万艾可明争暗斗中国ED市场,不过2014年6月23日之后万艾可专利到期之后的状况,或许是这些巨头们难以推测的。未来中国仿制药企会不会蜂拥而上,最终打破三巨头的价格垄断?事实上,对于类似的局面,辉瑞实施过以降价来开拓市场的策略。在欧洲市场辉瑞公司的万艾可专利保护期于去年6月23日到期,许多药企都立刻推出含西地那非的类似药品。对此辉瑞于去年推出经济版万艾可,其价格从以往的每粒10.30~14.96欧元大幅下降到2.08~6.25欧元。针对中国区是否降价,此次辉瑞也似乎有了松口迹象。而礼来内部人士则表示,希爱力每日一次在国内的最高零售定价为950元/28片,相当于34元/片,5mg每日一次的小剂量剂型作为一种全新的治疗方案,不能直接与按需服用的剂型进行价格比较。“所以即便放开了,竞争对手的降价对我们的影响也很有限。”国家知识产权局检索显示,辉瑞旗下万艾可在中国的专利保护期已于今年5月13日到期,而并非外界盛传的7月1日,这一消息也得到辉瑞方面证实。1994年,辉瑞制药向中国国家知识产权局申请万艾可主要活性成分“枸橼酸西地那非”治疗男性性功能障碍用途的专利。2001年9月,“万艾可”获得了国家知识产权局的专利授权,同时获得国家药品监督管理局批准进入中国市场。可以预见的是,万艾可中国专利保护到期,这一长期被辉瑞把持的巨大市场将会被打破。根据《中国市场研究报告》发布的《2009到2018年中国西地那非市场调查报告》中作出的估测,在国内有5000多万男性正备受勃起功能障碍的困扰。与此同时,随着中国人口的增长,勃起功能障碍的治疗需求预计还将上升。联合国经济与社会事务部曾作出预测称,到2050年时中国60岁以上的人口总数将会达到4.37亿人。据花旗集团公布的研究结果显示,目前中国勃起功能障碍药物市场的价值高达每年人民币17亿元,而到2018年时可能会最高达到人民币50亿元,约合8.1亿美元。该集团预还测称,到那时伟哥的仿制药将占据一半以上的市场份额。目前伟哥在中国市场上的售价为每片人民币90元以上,也就是接近15美元。那么,中国国内的药企都准备好了吗?据投资快报报道,白云山(600332)近期公告称,公司于2014年9月2日取得了国家食品药品监督管理总局核发的“枸橼酸西地那非”(商品名为“金戈”)和“枸橼酸西地那非片”的《药品补充申请批件》。此番广药白云山“伟哥”获批,是“白云山大南药从市场创新向科技创新转型升级的标志”,也加速了抗ED药的行业洗牌。据悉,这是国家药监局下发的首张中国“伟哥”出生证。对于此次“金戈”获批,广药白云山表示,“金戈”就如金蛋一样,将是公司重点打造的强势品种,相信未来也将成为公司新的利润增长点。相关负责人还透露将于近期召开新闻发布会公布“金戈”研发过程、产品包装等内容。而“金戈”最可能的定价区间在每粒30元至50元。值得玩味的是,从上世纪90年代,白云山就已经开始研发“金戈”。2003年,白云山“金戈”于2003年获得“枸橼酸西地那非”原料药及片剂的新药证书,证书编号分别为“国药证字H20030493”和“国药证字H20030494”。但是由于“伟哥”专利问题一直没能获得生产批件。需要指出的是,随着万艾可在全球各国专利的陆续到期,其市场份额也出现逐步下降的态势,从2000年90%的市场占有率降到2012年的47%。万艾可2012年全球销售收入20.51亿美元,主要贡献来自美国,因2012年美国专利到期,仿制药大批量上市,导致其2013年全球收入降至18.81亿美元,下降8%。在韩国,自万艾可的专利保护于2012年5月17日到期翌日,市场上就出现多达28种形态和用量不同的仿制药,大部分售价仅相当于万艾可的1/3,这也造成当月万艾可销售额锐减至原来的43%。同样的情况也出现在了泰国———专利保护到期后,由于仿制药的售价只有万艾可的1/10,迫使辉瑞不得不将价格下调30%。据泰国媒体报道显示,在泰国版“伟哥”上市前,辉瑞万艾可售价为200泰铢/粒(100mg),按2012年当时汇率计算,约合人民币41元/粒(100mg).从目前国内医药现状看来,万艾可的抢仿大战只是国内仿制药市场的冰山一角。公开数据显示,目前专利到期药物是全球医药市场增长最快的领域之一。据IMSHealth咨询公司预测,我国仿制药的年增长速度将超过25%。未来几年,全球将有数百种药的专利相继到期,蕴藏着超过千亿美元的市场。对于超过九成药品均为仿制药的中国市场来说,这将是一个巨大的蛋糕。据北京青年报报道,中国复关及入世谈判的首席谈判代表龙永图在2006年发表的言论称,在中国的大约5000家大型和小型医药公司中,有90%都只能生产仿制药;这些公司的年度销售收入总额仅为不到400亿美元,还比不上辉瑞一家公司的规模。在2013年中,辉瑞的全球销售收入达到了513亿美元。

【英文名】sildenafil citrate 【产品简介】商品名:万艾可化学名:1-[4-乙氧基-3-[5-(6,7-二氢-1-甲基-7-氧代-3-丙基-1H-吡唑并[4,3d]嘧啶)]苯磺酰]-4-甲基哌嗪枸橼酸盐分子式:C28H38N6O11S分子量:666.70CAS:171599-83-0【注册分类】化药6+6类 详情请点击 【适应症】适用于治疗阴茎勃起功能障碍(ED)。【用法用量】口服。服用时间:性生活前15min~4h服用均可,最好在性活动前1h服用。大多数人服用后约30min起效。有的15min左右即起效,60min药效达高峰,药物疗效可以维持4~8h。避免高脂肪饮食。空腹服药(饭前2h或饭后3~4h)效果更佳。建议可从每次100mg开始,其后可减量调整。根据疗效及耐受性可以减到每次50mg。每日剂量不宜超过l00mg。每日最多服用1次。【上市信息】美国辉瑞(Pfizer)制药公司研制生产的一种治疗心绞痛的药物。在临床试验中发现其治疗心绞痛的效果一般,而对治疗阳痿却有特殊效果,这一意外发现,促使厂家干脆以治疗阳痿的药物申报。美国食品和药品管理局(FDA)于1997年3月27日正式批准该药作为治疗阳痿的专用药物。【知识产权】未发现与之相关的侵犯他人知识产权的情况。【药理药效】本品是治疗阴茎勃起功能障碍(ED)的口服药。它是西地那非的枸橼酸盐,一种对环磷酸鸟苷(cGMP)特异的5型磷酸二酯酶(PDE5)选择性抑制剂。 作用机制:阴茎勃起的生理机制涉及性刺激过程中阴茎海绵体内一氧化氮(NO)的释放。NO激活鸟苷酸环化酶导致环磷酸鸟苷(cGMP)水平增高,使海绵体内平滑肌松弛,血液充盈。【产品优势】据了解,目前在中国,ED(勃起功能障碍)市场是辉瑞万艾可、礼来希爱力、拜耳艾力达的天下。包括辉瑞旗下“蓝色小药丸”万艾可(通用名:西地那非)、礼来旗下“黄色小药丸”希爱力(通用名:他达拉非)以及拜耳旗下“橘红色小药丸”艾力达(通用名:伐地那非),但最被消费者熟知和接受的仍然是“伟哥”万艾可。成都市内某大型连锁药房的销售数据显示,万艾可零售价为128元/粒,销售份额占ED类药物的65%;希爱力零售价138元/粒,占32.8%;艾力达128元/粒,占2.2%。国信证券研报显示,假设国内约1.4亿的ED患者有30%接受治疗,则接受治疗人数0.42亿人;假设仿制药上市后定价分别为20元/粒,30元/粒,40元/粒,50元/粒,60元/粒,接受治疗的ED患者每年分别使用5次 (粒)、10次(粒)、15次(粒)、20次(粒),中国潜在市场规模达百亿元级别。而目前ED正规治疗药品仅10亿元规模,未来具数十倍潜在增长空间。另外,来自世卫组织的统计显示,全球患有勃起机能障碍的男性约10%。按此计算,其市场容量在600亿~1000亿元。不过,ED(勃起功能障碍)市场并非一潭静水。来自IMS(艾美仕市场研究公司IMS Health)的数据显示,2013年市场份额为:万艾可占据着27个城市中58.8%的市场份额,希爱力为34.6%,艾力达为6.6%;而2012年这一数据分别是:万艾可为62.8%,希爱力为32.1% ,艾力达为5.1%。由此可以看出,2013年希爱力和艾力达的市场份额小幅上升,其中希爱力与万艾可仍相差24.2个百分点,万艾可小幅下降,但仍占据着市场份额的50%以上。来自礼来市场部门的数据显示,礼来中国自2013年年底推出希爱力每日一次5mg小剂量以来,以医院的40个城市和零售的8个重点城市作为起步市场,希爱力每日一次的治疗方案得到中国的男科和泌尿科专家认可,希爱力每日一次已经占医院希爱力销量的15%。面对礼来希爱力等巨头的步步紧逼,辉瑞中国商务及多元化业务事业部总经理肖卫红曾对外表示:“辉瑞并不怕竞争,欢迎竞争对手和我们一起把ED市场做起来。”辉瑞中国企业沟通部总监席庆也表示,目前万艾可在中国ED药物市场的总体份额(药店加医院渠道)仍然占有绝对的领先优势。虽然万艾可的在华专利将于今年6月份到期,但作为第一个在华上市的ED药物,万艾可上市十年来已经在广大患者和医务人员中积累了很高的品牌知名度和信誉度,加上中国的ED药物市场还远没有充分开发,辉瑞对万艾可在华专利到期后的前景仍然持乐观态度。不过,与辉瑞和礼来花大力气营销ED用药不同,几乎与希爱力同期进入中国市场的“德国伟哥”拜耳艾力达则并未参与营销层面的角逐。自2010年以来,拜耳公司将艾力达的营销及销售授权给中国企业去做。这在当年被业内人士解读为“中国市场太大,跨国药企太忙”。不过即便如此,艾力达2013年6.6%的市场份额也轻松取得超过5000万元的销售额。据悉,希爱力计划将零售渠道和医院渠道的发展比例从3:1调整为4:1。在医院、零售两大主要渠道中,礼来采取前期更多发挥医院渠道优势,相对避开辉瑞强大的零售渠道,辉瑞则选择在强势的零售渠道守住优势。渠道无疑是辉瑞手中最重要的“一张牌”。2011年,辉瑞力推中国男性健康相关行动,通过在部分零售门店中开设男性健康中心,整合了原本分散销售的男科处方药和计生器械,由此有效拉动了万艾可当年的销售。据悉,当年万艾可在全国60个城市的5000多家药店中总销量排名第二。资深营销专家袁建军对外资药企营销有着多年的观察。据他了解,辉瑞对于万艾可的营销可谓做到极致,辉瑞很早就深入三四线城市的药店对万艾可进行营销、学术推广活动。甚至许多新药店开张,辉瑞的零售团队都会带着万艾可的海报和药品介绍前去捧场与宣传,基本做到了凡是有正规药店的地方就有“伟哥”。尽管外资药企三巨头中,希爱力与万艾可明争暗斗中国ED市场,不过2014年6月23日之后万艾可专利到期之后的状况,或许是这些巨头们难以推测的。未来中国仿制药企会不会蜂拥而上,最终打破三巨头的价格垄断?事实上,对于类似的局面,辉瑞实施过以降价来开拓市场的策略。在欧洲市场辉瑞公司的万艾可专利保护期于去年6月23日到期,许多药企都立刻推出含西地那非的类似药品。对此辉瑞于去年推出经济版万艾可,其价格从以往的每粒10.30~14.96欧元大幅下降到2.08~6.25欧元。针对中国区是否降价,此次辉瑞也似乎有了松口迹象。而礼来内部人士则表示,希爱力每日一次在国内的最高零售定价为950元/28片,相当于34元/片,5mg每日一次的小剂量剂型作为一种全新的治疗方案,不能直接与按需服用的剂型进行价格比较。“所以即便放开了,竞争对手的降价对我们的影响也很有限。”国家知识产权局检索显示,辉瑞旗下万艾可在中国的专利保护期已于今年5月13日到期,而并非外界盛传的7月1日,这一消息也得到辉瑞方面证实。1994年,辉瑞制药向中国国家知识产权局申请万艾可主要活性成分“枸橼酸西地那非”治疗男性性功能障碍用途的专利。2001年9月,“万艾可”获得了国家知识产权局的专利授权,同时获得国家药品监督管理局批准进入中国市场。可以预见的是,万艾可中国专利保护到期,这一长期被辉瑞把持的巨大市场将会被打破。根据《中国市场研究报告》发布的《2009到2018年中国西地那非市场调查报告》中作出的估测,在国内有5000多万男性正备受勃起功能障碍的困扰。与此同时,随着中国人口的增长,勃起功能障碍的治疗需求预计还将上升。联合国经济与社会事务部曾作出预测称,到2050年时中国60岁以上的人口总数将会达到4.37亿人。据花旗集团公布的研究结果显示,目前中国勃起功能障碍药物市场的价值高达每年人民币17亿元,而到2018年时可能会最高达到人民币50亿元,约合8.1亿美元。该集团预还测称,到那时伟哥的仿制药将占据一半以上的市场份额。目前伟哥在中国市场上的售价为每片人民币90元以上,也就是接近15美元。那么,中国国内的药企都准备好了吗?据投资快报报道,白云山(600332)近期公告称,公司于2014年9月2日取得了国家食品药品监督管理总局核发的“枸橼酸西地那非”(商品名为“金戈”)和“枸橼酸西地那非片”的《药品补充申请批件》。此番广药白云山“伟哥”获批,是“白云山大南药从市场创新向科技创新转型升级的标志”,也加速了抗ED药的行业洗牌。据悉,这是国家药监局下发的首张中国“伟哥”出生证。对于此次“金戈”获批,广药白云山表示,“金戈”就如金蛋一样,将是公司重点打造的强势品种,相信未来也将成为公司新的利润增长点。相关负责人还透露将于近期召开新闻发布会公布“金戈”研发过程、产品包装等内容。而“金戈”最可能的定价区间在每粒30元至50元。值得玩味的是,从上世纪90年代,白云山就已经开始研发“金戈”。2003年,白云山“金戈”于2003年获得“枸橼酸西地那非”原料药及片剂的新药证书,证书编号分别为“国药证字H20030493”和“国药证字H20030494”。但是由于“伟哥”专利问题一直没能获得生产批件。需要指出的是,随着万艾可在全球各国专利的陆续到期,其市场份额也出现逐步下降的态势,从2000年90%的市场占有率降到2012年的47%。万艾可2012年全球销售收入20.51亿美元,主要贡献来自美国,因2012年美国专利到期,仿制药大批量上市,导致其2013年全球收入降至18.81亿美元,下降8%。在韩国,自万艾可的专利保护于2012年5月17日到期翌日,市场上就出现多达28种形态和用量不同的仿制药,大部分售价仅相当于万艾可的1/3,这也造成当月万艾可销售额锐减至原来的43%。同样的情况也出现在了泰国———专利保护到期后,由于仿制药的售价只有万艾可的1/10,迫使辉瑞不得不将价格下调30%。据泰国媒体报道显示,在泰国版“伟哥”上市前,辉瑞万艾可售价为200泰铢/粒(100mg),按2012年当时汇率计算,约合人民币41元/粒(100mg).从目前国内医药现状看来,万艾可的抢仿大战只是国内仿制药市场的冰山一角。公开数据显示,目前专利到期药物是全球医药市场增长最快的领域之一。据IMSHealth咨询公司预测,我国仿制药的年增长速度将超过25%。未来几年,全球将有数百种药的专利相继到期,蕴藏着超过千亿美元的市场。对于超过九成药品均为仿制药的中国市场来说,这将是一个巨大的蛋糕。据北京青年报报道,中国复关及入世谈判的首席谈判代表龙永图在2006年发表的言论称,在中国的大约5000家大型和小型医药公司中,有90%都只能生产仿制药;这些公司的年度销售收入总额仅为不到400亿美元,还比不上辉瑞一家公司的规模。在2013年中,辉瑞的全球销售收入达到了513亿美元。

【产品简介】商品名称:拜瑞妥 化学名称:5-氯-N-(((5S)-2-氧代-3-(4-(3-氧代吗啉-4-基)苯基)-1,3-恶唑啉-5-基)甲基)噻吩-2-甲酰胺 分子式:C19H18ClN3O5S 分子量:435.88规 格:10mg【注册分类】化药3+6类 详情请点击 【适应症】用于择期髋关节或膝关节置换手术成年患者,以预防静脉血栓形成(VTE)【用法用量】一次10mg,1日1次。【上市信息】拜瑞妥是拜耳公司历经10年研发的新型抗凝药物,是全球第一个直接Xa因子抑制剂,为化学合成的小分子化合物。自2008年9月起,拜瑞妥已在全球50多个国家上市,并于2009年6月在中国正式上市,2011年07月01日在美国上市。【知识产权】化合物专利2019.12.14到期;晶型专利2026.9.22到期.【药理药效】利伐沙班是一种高选择性,直接抑制因子Xa的口服药物。通过抑制因子Xa可以中断凝血瀑布的内源性和外源性途径,抑制凝血酶的产生和血栓形成。利伐沙班并不抑制凝血酶(活化因子II),也并未证明其对于血小板有影响。 在人体中观察到了利伐沙班对因子Xa活性呈剂量依赖性抑制的作用。利伐沙班对凝血酶原时间(PT)的影响具有量效关系,若用NeopLastin进行含量测定,则与血浆浓度密切相关(相关系数为0.98)。使用其它试剂会出现不同的结果。读取PT应在数秒内完成,因为国际标准化比率(INR)仅对香豆素类进行了校准和验证,不能用于其它抗凝药。在接受骨科大手术的患者中,服用片剂后2-4小时(作用最强时),5/95(百分位数)的PT为(NeopLastin)13-25秒(手术前的基线值为12-15秒)。 活化的部分凝血激酶时间(aPTT)和HepTest延长也具有剂量依赖性;但不推荐将其用于评估利伐沙班的药效。利伐沙班对抗因子Xa活性也有影响,然而,目前尚无校准的标准。 利伐沙班是一种高选择性,直接抑制因子Xa的口服药物。通过抑制因子Xa可以中断凝血瀑布的内源性和外源性途径,抑制凝血酶的产生和血栓形成。利伐沙班并不抑制凝血酶(活化因子II),也并未证明其对于血小板有影响。 在人体中观察到了利伐沙班对因子Xa活性呈剂量依赖性抑制的作用。利伐沙班对凝血酶原时间(PT)的影响具有量效关系,若用NeopLastin进行含量测定,则与血浆浓度密切相关(相关系数为0.98)。使用其它试剂会出现不同的结果。读取PT应在数秒内完成,因为国际标准化比率(INR)仅对香豆素类进行了校准和验证,不能用于其它抗凝药。在接受骨科大手术的患者中,服用片剂后2-4小时(作用最强时),5/95(百分位数)的PT为(NeopLastin)13-25秒(手术前的基线值为12-15秒)。 活化的部分凝血激酶时间(aPTT)和HepTest延长也具有剂量依赖性;但不推荐将其用于评估利伐沙班的药效。利伐沙班对抗因子Xa活性也有影响,然而,目前尚无校准的标准。 【药代动力学】 吸收:10mg的利伐沙班的绝对生物利用度较高(80-100%)。利伐沙班吸收迅速,服用后2-4小时达到最大浓度(Cmax)。进食对利伐沙班10mg片剂的AUC或Cmax无明显影响,因此服用利伐沙班10mg片剂的时间不受就餐时间的限制。利伐沙班的药代动力学基本呈线性,直至达到约每日1次15mg剂量。更高剂量时,利伐沙班显示出溶出限制性吸 三、产品优势: 利伐沙班(Rivaroxaban)是一种新型的口服的直接Ⅹa因子抑制剂。与传统抗凝药相比,利伐沙班的优势非常明显,它是一种疗效确切、不需要不断监测、安全性良好、使用方便的新型抗凝药物。目前利伐沙班用以防治各种急、慢性血栓栓塞性疾病,主要包括骨科术后静脉血栓形成的预防、静脉血栓栓塞(venous thromboembolism,VTE)的治疗,心房颤动患者脑卒中的预防、急性冠状动脉综合征二级预防、内科住院患者VTE的预防。的绝对生物利用度较高(80-100%)。利伐沙班吸收迅速,服用后2-4小时达到最大浓度(Cmax)。进食对利伐沙班10mg片剂的AUC或Cmax无明显影响,因此服用利伐沙班10mg片剂的时间不受就餐时间的限制。利伐沙班的药代动力学基本呈线性,直至达到约每日1次15mg剂量。更高剂量时,利伐沙班显示出溶出限制性吸 三、产品优势: 利伐沙班(Rivaroxaban)是一种新型的口服的直接Ⅹa因子抑制剂。与传统抗凝药相比,利伐沙班的优势非常明显,它是一种疗效确切、不需要不断监测、安全性良好、使用方便的新型抗凝药物。目前利伐沙班用以防治各种急、慢性血栓栓塞性疾病,主要包括骨科术后静脉血栓形成的预防、静脉血栓栓塞(venous thromboembolism,VTE)的治疗,心房颤动患者脑卒中的预防、急性冠状动脉综合征二级预防、内科住院患者VTE的预防。【产品优势】利伐沙班有望成为继氯吡格雷之后心血管领域新的重磅炸弹,Business Insights公司预测,该药年销量具有达到30亿美元的潜力。荷兰国际银行金融市场预测2015年全球销售额将达68亿美元。Decision Resources研究咨询机构指出,不需要进行剂量调整或监测的口服剂的推出(尤其是利伐沙班进入市场)将使抗凝药市场规模到2016年增长一倍以上,2016年增加到74亿美元。 Produc No.PR1001Product NameRivaroxabanCAS No.366789-02-8Specificationinner quality standardBrief IntroductionRivaroxaban, a FXa inhibitor, is the active ingredient in Tablets with the chemical name 5-Chloro-N-({(5S)-2-oxo-3-[4-(3-oxo-4-morpholinyl)phenyl]-1,3-oxazolidin-5yl}methyl)-2-thiophenecarboxamide. The molecular formula of rivaroxaban is C19H18ClN3O5S and the molecular weight is 435.89. Each XARELTO tablet contains 10 mg, 15 mg, or 20 mg of rivaroxaban.IndicationReduction Of Risk Of Stroke And Systemic Embolism In Nonvalvular Atrial FibrillationTreatment Of Deep Vein ThrombosisTreatment Of Pulmonary EmbolismReduction In The Risk Of Recurrence Of Deep Vein Thrombosis And Of Pulmonary EmbolismProphylaxis Of Deep Vein Thrombosis Following Hip Or Knee Replacement Surgery

【通用名】他达拉非、他达拉非片【英文名】Tadalafil、Tadalafil Tablets【产品信息】1.商品名:犀利士、西力士、希爱力(Cialis)2.主成分化学名:(6R-12aR)-6-(1,3-苯并二恶茂-5-基)-2-甲基-2,3,6,7,12,12a-六氢化吡嗪并[1',2'-1,6]-吡啶并[3,4-b]吲哚-1,4-二酮3.主成分分子式:C22H19N3O44.主成分分子量:389.415.主成分cas登记号:171596-29-56.规格:2.5mg、5mg、10mg、20mg【注册分类】他达拉非:化药3.1类他达拉非片:化药6类(ED)化药3.4类(BPH)化药3.1类(PAH)点击获取更多该产品的注册信息【适应症】勃起功能障碍(ED);良性前列腺增生(BPH Benign Prostate Hyperplasia);肺动脉高压(PAH pulmonary arterial hypertension)。【用法用量】本品的推荐剂量为10mg,在进行性生活之前服用,不受进食的影响.如果服用10mg效果不显著,可以服用20mg.可至少在性生活前30分钟服用.最大服药频率为每日一次【上市信息】目前国内仅批准了美国礼来公司的他达拉非片进口,规格为10mg、20mg。【知识产权】本品专利涉及化合物、组合物、用途、制备方法,化合物专利2015年1月到期,性功能障碍(ED)用途专利2020年4月到期,另外尚有晶型专利在审。【品种简介】他达拉非是环磷酸鸟苷(cGMP)特异性磷酸二酯酶5(PDE5)的选择性、可逆性抑制剂。最早由美国礼来公司研制开发,作为治疗男性勃起障碍(ED)的药物,商品名为“CIALIS”(希爱力),2009年进入中国。2009年FDA批准了他达拉非作为治疗肺动脉高压(PAH)的药物,礼来公司首先进行了此适应症的制剂申报并获得FDA批准,商品名为“ADCIRCA”,此产品未进入中国。2011年礼来公司又申请了“CIALIS”的治疗良性前列腺增生(BPH)的适应症,并获得FDA批准。目前进入中国的“CIALIS”只批准治疗ED的适应症。中国现在没有仿制药上市,国内无批准的原料药。体外研究表明他达拉非是一种选择性PDE5抑制剂,PDE5存在于海绵体平滑肌、前列腺、膀胱、血管、内脏平滑肌、骨骼肌、血小板、肾、肺、小脑和胰脏中。他达拉非与PDE5的作用要强于其它磷酸二酯酶。他达拉非于口服后快速吸收,服药后中位时间2小时达到平均最大观测血浆浓度(Cmax)。口服本品后的绝对生物利用度尚未明确。他达拉非的吸收率和程度不受食物的影响,所以本品可以与或不与食物同服。服药时间(早晨或晚上)对吸收率和程度没有临床意义的影响。【产品优势】他达拉非药理作用特点:他达拉非口服经胃肠道吸收后,能在30分钟内起效,且疗效持续36小时,是目前仅有的三种ED药物中起效快,药效持续时间最长,且唯一不受高脂饮食和酒精摄入影响的药物。西地那非和伐地那非药效持续时间不超过4小时,酒精和高脂饮食均影响药效的发挥。凭借这些明显的药效优势,他达那非在上市首年销量即已超过2亿美元,IMS数据显示,2010和2011全球年均销量超过17亿美元,已轻松跻身重量级药物行列。美国礼来公司希爱力国内零售价为: 20mgX1片的:138元/盒; 20mgX2片的:272元/盒 Produc No.PR4001Product NameTadalafil TabletsCAS No.171596-29-5Specificationinner quality standardBrief Introductiontadalafil is a selective inhibitor of cyclic guanosine monophosphate (cGMP)-specific phosphodiesterase type 5 (PDE5). Tadalafil has the empirical formula C22H19N3O4 representing a molecular weight of 389.41.tadalafil Structural Formula Illustration.The chemical designation is pyrazino[1',2':1,6]pyrido[3,4-b]indole-1,4-dione, 6-(1,3-benzodioxol-5-yl)2,3,6,7,12,12a-hexahydro-2-methyl-, (6R,12aR)-. It is a crystalline solid that is practically insoluble in water and very slightly soluble in ethanol.Tadalafil Tablet is available as almond-shaped tablets for oral administration. Each tablet contains 2.5, 5, 10, or 20 mg of tadalafil.Indicationthe treatment of ED and the signs and symptoms of BPH, pulmonary arterial hypertension

托拉塞米是新一代高效髓袢利尿剂,于1993年在德国上市,次年在美国上市。2004年我国SFDA批准生产国内第一个托拉塞米水针制剂(特苏尼),填补了该药在国内临床中的空白。多年临床应用证实,托拉塞米适应证广,利尿作用迅速强大且持久,不良反应发生率低,更符合药物经济学要求,是临床上值得推广的一类高效利尿剂。 适应证广泛:适用于治疗发生于多种组织多种原因所致的中重度水肿、急慢性心力衰竭,防治急慢性肾衰,治疗肝硬化腹水、脑水肿以及急性毒物和(或)药物中毒,以及抢救原发性高血压危象和多器官功能衰竭等急重症。 安全性和耐受性好:通过肝肾双通道代谢,80%经肝脏代谢,20%以原形经肾脏排泄,有效减轻了肾脏负担和药物蓄积。其独特的醛固酮拮抗作用,使K+等电解质排泄量明显减少,临床上对Mg2+、尿酸、糖和脂类无明显影响。长期应用不易产生利尿抵抗,患者耐受性好。 托拉塞米:顽固性心衰的一线用药 托拉塞米可以通过以下机制有效对抗心力衰竭:①快速利尿,减轻心脏前负荷;②抑制前列腺素分解酶活性,增加血浆中前列腺素E2(PGE2)和PGI2浓度,拮抗血栓素A2(TXA2)和TXB2的缩血管作用,降低心脏后负荷;③阻止醛固酮与其受体结合,防治心衰进展;④钾排泄量较速尿少,可防止低钾对心脏的不良影响 1.增加排尿量:意大利研究者观察到,托拉塞米具有强大利尿作用,慢性心衰(CHF)患者服药后第3天尿量增加38%,第28天增加75%,尿钠排泄量也增加。同时不良反应发生率低,患者能很好地耐受,对需要高效利尿剂治疗的CHF患者具有明确疗效。我国上海中山医院、瑞金医院和华山医院进行的多中心、随机、双盲及平行对照临床研究表明,心衰患者使用托拉塞米(特苏尼)注射液后,尿量明显增加,体重减轻,与呋塞米相比差异显著。 2.降低死亡率,改善心功能:托拉塞米在充血性心力衰竭患者中应用的TORIC研究中,1377例纽约心脏协会心功能分级(NYHA)为Ⅱ~Ⅲ级的充血性心力衰竭患者在接受标准CHF治疗后12个月随机接受托拉塞米(40mg/d)或其他利尿剂治疗。结果显示,托拉塞米组的死亡率明显低于呋塞米或其他利尿剂组(2.2%对4.5%)。托拉塞米组更多患者心功能得到了改善。而且托拉塞米组患者很少出现异常低血钾。证实了托拉塞米对CHF的疗效和安全性,患者耐受性良好。 3.缩短住院时间,提高生活质量-----瑞士Spannheimer等对222例长期接受托拉塞米或呋塞米治疗的CHF患者进行了比较。结果显示,长期接受托拉塞米治疗的患者住院率明显低于接受呋塞米治疗者(3.6%对5.4%)。表明托拉塞米对长期接受利尿剂治疗的CHF患者有潜在临床益处 4.减少住院费用,提高经济效益------Young等在综述中提到,托拉塞米的药物经济学评估集中在其缩短住院时间、减少住院费用方面。托拉塞米治疗11.2个月,CHF患者的住院费用降低了86%。Spannheimer等的研究也显示,与呋塞米治疗者相比,托拉塞米治疗者的经济负担减半。 托拉塞米:适合急慢性肾衰治疗 1.促尿钠排泄作用强-----德国Kutsch等分析了托拉塞米和呋塞米单剂量治疗严重肾衰的疗效。90例慢性肾衰患者分别注射100mg和200mg托拉塞米或呋塞米,监测4组患者体液和电解质排泄情况。结果显示,托拉塞米在第二个6小时和第三个6小时中尿钠排泄量明显高于呋塞米。表明托拉塞米具有长效和强效促尿钠排泄作用。 2.改善肾衰患者的临床症状-----德国Trier等研究了44例严重慢性肾衰患者,结果显示,200mg托拉塞米单次或多次静注对患者的利尿作用均显著。并且患者体重相应减轻,以前存在的外周水肿等临床症状也得到明显改善。研究还发现,托拉塞米对透析患者也有疗效 3.药代动力学不受肾功能影响------德国研究者观察了托拉塞米在慢性肾衰患者中的药代动力学特点,发现药物半衰期不受肾功能影响,约为4小时,其非肾脏清除率是肾脏清除率的3倍,活性代谢产物和主要代谢产物不会在慢性肾衰患者体内聚积。肾功能衰竭对托拉塞米的药代动力学无明显影响。 托拉塞米:阻断肝硬化腹水恶性循环 托拉塞米:脑水肿的利尿新选择------德国Staub等研究认为,神经胶质细胞水肿是大脑损伤的主要特征,体外培养的C6神经胶质瘤细胞在pH7.4的控制条件下,托拉塞米不影响细胞体积和存活率。通过在培养基中加入等渗乳酸将pH滴定到6.2,在整个观察过程中,1mM托拉塞米可显著减轻C6神经胶质细胞瘤细胞的肿胀(P<0.01)。 还有研究表明,重型脑损伤患者使用托拉塞米注射液和呋塞米治疗后,托拉塞米组有效及显效率均明显高于呋塞米组。 结论:高剂量托拉塞米可显著减轻脑水肿程度,还能抑制水肿出现,可推荐用于临床。 综上所述,由于托拉塞米具有起效快、利尿作用强及疗效好等优点,且排钾作用弱,对尿钙排泄无明显影响,副作用少,临床上可用于治疗充血性心力衰竭、高血压、肾功能不全、肾性水肿和肝硬化腹水和脑水肿等疾病,是新一代强效袢利尿剂。

【英文名】moxifloxacin 【产品简介】商品名称:Avelox 拜复乐CAS:186826-86-8 分子量:401.44分子式:C21H25ClFN3O4规格:每片0.4g【注册分类】化药6+6类 详情请点击 奥氮平 href="http://db.yaozh.com/index.php?action=zhuce&search=search&name=奥氮平片&isjing=1&shoulihao_1=&zc_qiyemingcheng=&zc_zhucefenlei=&zc_zhuangtaikaishishijians=&zc_zhuangtaikaishishijiane=&zc_chenbanriqis=&zc_chenbanriqie=&zc_banlizhuangtai=&zc_yaopinleixing=&zc_shenqingleixing=&submit_namess=" 奥氮平片【适应症】治疗患有上呼吸道和下呼吸道感染的成人。如急性窦炎、慢性支气管炎急性发作、社区获得性肺炎、以及皮肤和软组织感染。【用法用量】一次0.4mg,1日1次。【上市信息】莫西沙星由德国Bayer公司研制,1999年首次在德国上市,先后在墨西哥,美国,英国等国家应用。中国于2002年由拜耳上市莫西沙星片剂(400mg),2004年上市莫西沙星氯化钠注射液,商品名拜复乐(Avelox)。【知识产权】二环取代-3-喹诺酮羧酸衍生物的药物组合物制备方法,专利号为sdCN94100328.0;98.11.12日,8-甲氧基-喹诺酮羧酸类的制备方法,专利号为sdCN02131962.6 1993.01.09,喹诺酮甲酸和萘啶酮甲酸衍生物,专利号为sdCN98109504.6 以上专利保护为20年,最早得到2012年底到期。99813124.5 拜耳2004.05.19授权片剂采用乳糖00811427.7【药理药效】莫西沙星是广谱和具有抗菌活性的8-甲氧基氟喹诺酮类抗菌药。莫西沙星在体外显示出对革兰阳性细菌,革兰阴性菌,厌氧菌、抗酸菌和非典型微生物如支原体、衣原体和军团菌有广谱抗菌活性。抗菌作用机制为干扰II、IV拓扑异构酶。拓扑异构酶是控制DNA拓扑和在DNA复制、修复和转录中关键的酶。其杀菌曲线表明,莫西沙星是具有浓度依赖性的杀菌活性。最低杀菌浓度和最低抑菌浓度基本一致。莫西沙星对b-内酰胺类和大环内酯类抗生素耐药的细菌亦有效。通过感染的实验动物模型证实,莫西沙星体内活性高。【产品优势】莫西沙星是由德国拜耳公司推出的产品,属于第四代喹诺酮类药物,1999年9月在德国上市,1999年12月10日通过FDA审批,商品名Avelox,目前已在世界许多国家地区用于临床。2003年4月爱尔康公司开发的莫西沙星滴眼剂也获FDA批准上市。许多文献介绍,莫西沙星与克拉霉素、头孢呋辛、左氧氟沙星临床对照,在抗感染方面具有更大的优势。莫西沙星抗革兰阳性菌的活性约比环丙沙星强4倍,具有抗厌氧菌、支原体、衣原体等作用和光敏反应低的特点,且对一些耐药性细菌也有较好的抗首效果,在有效的学术推广下,正在以较快的速度分食抗菌素市场。莫西沙星优良的作用机制,带动了市场销售,尤以呼吸道细菌性感染、慢性支气管炎急性细菌性发作、阻塞性肺病、社区获得性肺炎治疗中表现出显著效果,其强大的细胞组织穿透力得到了医生、患者的认可,2000年获得了1.22亿美元的良好收益,2002年销售额达到3.38亿美元,进入了2002年世界十大畅销抗生素药物,列第8位,已成为全球十分抢眼的药物。2006年的世界市场销售额高达8.22亿美元,在全球畅销处方药排名第129位;2007年世界市场销售额高达10.34亿美元,比上年增长25.8%;2008年为5.75亿美元。 从2003年16城市样本医院用药看,莫西沙星以其良好的效果在许多地区较为畅销,在重庆和济南两个地区进入前200位用药中。该药2004年进入国家医保目录后,连续3年出现惊人的增长率:2003年到2007年的复合增长率为116%,2007年城市样本医院购药金额为2.16亿元,比上年增长了75.1%;2008年上半年为1.62亿元。拜复乐2008全年销售额6.30亿元,2009年全年销售额达到8.20亿元,2010年拜复乐的国内销售额为10亿元。 Produc No.PR4003Product NameMoxifloxacin hydrochloride tabletsCAS No.186826-86-8Specificationinner quality standardBrief IntroductionMoxifloxacin hydrochloride is a synthetic broad spectrum antibacterial agent for oral and intravenous administration. Moxifloxacin, a fluoroquinolone, is available as the monohydrochloride salt of 1-cyclopropyl-7-[(S,S)2,8-diazabicyclo[4.3.0]non-8-yl]-6-fluoro-8-methoxy-1,4-dihydro-4-oxo-3 quinoline carboxylic acid. It is a slightly yellow to yellow crystalline substance with a molecular weight of 437.9. Its empirical formula is C21H24FN3O4*HClAVELOX Tablets are available as film-coated tablets containing moxifloxacin hydrochloride (equivalent to 400 mg moxifloxacin).IndicationAcute Bacterial SinusitisCommunity Acquired PneumoniaUncomplicated Skin and Skin Structure InfectionsComplicated Skin and Skin Structure InfectionsComplicated Intra-Abdominal Infections
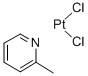
【通用名】 甲啶铂及注射液 【英文名】 Picoplatin 【产品简介】 化学名:顺式-二氯-氨,(2-甲基吡啶)合铂 CAS:181630-15-9 分子量: 359.114 分子式:C6H7N.Cl2Pt 规格:10mg/200ml【注册分类】 拟3+3 【适应症】 治疗小细胞肺癌、结直肠癌、前列腺癌及卵巢癌 【上市信息】 美国AnorMed公司设计了甲啶铂,目前已在全球范围内开展Ⅱ/Ⅲ期临床研究 【知识产权】 在中国没有化合物专利,该化合物专利在美国的专利号US5665771 【产品优势】 甲啶铂(picoplatin)代号为JM473,AMD473,ZD0473等,化学名称是顺式-二氯一氨,(2-甲基***吡啶)合铂(Ⅱ),结构如图1所示,是继顺铂、卡铂与奥沙利铂之后的新一代铂族金属抗肿瘤药物[1,2]。主要用于治疗小细胞肺癌、结直肠癌、前列腺癌及卵巢癌等。目前已在全球范围内开展Ⅱ/Ⅲ期临床研究,表现出优于顺铂、卡铂等已上市的铂类抗癌药物的特性。具有高效、广谱、低毒、可口服给药等优点,克服了传统铂族抗癌药物抗交叉耐药能力的不足。 Picoplatin是新一代铂类化疗物,在设计上能够克服铂类耐药。 临床前的数据显示Picoplatin能克服经铂类为基础化疗药物处理的小细胞肺癌株的耐药。