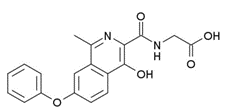
罗沙司他:【剂型/规格】胶囊。20mg,50mg【适应症】 (1) 我国2018-12-18批准的适应症:用于治疗正在接受透析治疗的患者因慢性肾脏病(CKD)引起的贫血(2) 在我国已完成III期临床的适应症:用于治疗未接受透析治疗的患者因慢性肾脏病(CKD)引起的贫血(3) 在我国正在进行II/III期临床的适应症:低危的骨髓增生异常综合征(MDS)导致的贫血【用法用量】口服,每周三次,每次口服1-5粒,根据病人的实际情况进行用药;用药时程:用药最长52周。(待与批准说明书确认)【专利状况】2024年【研发进展】实验室研究中【项目优势】罗沙司他是由FibroGen发现并开发的一种化合物,2018-12-18在我国获批上市,是国内首发的I类创新药。在罗沙司他获批前,肾性贫血的标准治疗方法为促红细胞生成素(EPO激素)替代,这个疗法在使用、疗效和安全性方面具有很大的局限性。罗沙司他的诞生,可以说是该领域革命性品种的出现。同时,罗沙司他同步在美欧中进行肿瘤和化疗相关性贫血的临床研究(中美III期,欧II期),这两个适应症的市场将是非常庞大的,有报道评价为“大杀器”。该产品专利期2024年。公司网址:http://www.vcarepharmatech.com/home_page/
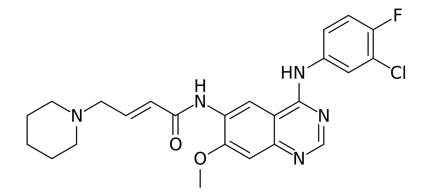
达可替尼:【剂型/规格】片剂。15mg,45mg【适应症】抗肺癌(1) 美国:适用于经FDA批准的检测、发现表皮生长因子受体(EGFR)外显子19缺失或外显子21 L858R替代突变的转移性非小细胞肺癌患者的一线治疗;(2) 日本:EGFR基因突变阳性的不能手术或复发的非小细胞肺癌【用法用量】口服,每日一次,一次45mg【专利情况】2025年【研发进展】实验室研究中【项目优势】达可替尼的新药申请,是基于III期ARCHER-1050临床研究结果。该研究在2018年ASCO以及CSCO大会上被报道。是一项全球性、头对头研究,在携带EGFR激活突变的局部晚期或转移性NSCLC患者中开展,评估了达可替尼VS格非替尼用于一线治疗的疗效和安全性。该药品是一种泛HER抑制剂,入脑效果较好,并且亚裔患者似乎从达可替尼组的治疗中获益更多。公司网址:http://www.vcarepharmatech.com/home_page/
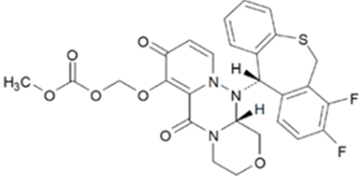
巴洛沙韦片:【剂型规格】片剂:10mg、20mg、40mg;颗粒剂:2%【适应症】甲型流感和乙型流感的治疗【专利状况】在审,如获批,化合物专利至2036年【研发进展】实验室研究中【项目优势】巴洛沙韦由盐野义发现,罗氏与其进行全球开发,罗氏享有除日本及中国台湾以外地区的全球权利。该药已在非临床研究中证实对多种流感病毒有效,包括奥司他韦耐药菌株和禽流感病毒株(H7N9,H5N1)。巴洛沙韦是近20年来第一个治疗流感全新机制的新药,是第一种也是唯一一种批准用于治疗流感的单剂量口服药物;与安慰剂相比,巴洛沙韦显著地缩短流感症状的持续时间。安全性优于现在临床抗病毒用药奥司他韦,奥司他韦主要针对轻症流感患者,而巴洛沙韦适于轻症流感、高危人群的轻症流感,目前在进行全球性的重症流感临床试验,预计今年完成。
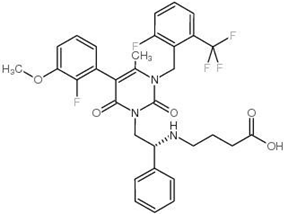
恶拉戈利片:【剂型/规格】150mg/片,200mg/片【适应症】 用于治疗与子宫内膜异位相关的中度至重度疼痛。【用法用量】 口服。正常肝功能或轻度肝功能不全的患者:每天150 mg,持续24个月,或200 mg,每天两次,持续6个月。中度肝功能损害的患者:每天一次150毫克,最多6个月。【专利状况】2024年【研发进展】实验室立项中【项目优势】恶拉戈利是首个也是唯一一个获准专门治疗与子宫内膜异位症相关的中重度疼痛的口服促性腺激素释放激素(GnRH)受体拮抗剂。并且在2019年9月,艾伯维与合作伙伴Neurocrine Biosciences宣布已向美国FDA提交了Elagolix联合低剂量激素治疗女性子宫肌瘤相关的重度月经出血(HMB)的新药申请,在铺开适应症,并且对前列腺癌也会有指导作用。公司网址:http://www.vcarepharmatech.com/home_page/
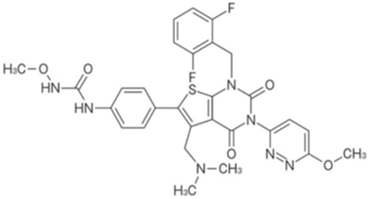
瑞卢戈利片:【剂型/规格】片剂。40mg/片【适应症】 基于子宫肌瘤改善以下症状:月经过多,下腹痛,腰痛,贫血【用法用量】对于成年人通常饭前每天口服40 mg ralgorix。 首剂应在月经周期的第1至5天服用。【专利状况】2024年【研发进展】实验室立项中【项目优势】除用于治疗子宫肌瘤外,该药正在多个国家开展子宫内膜异位症引起的疼痛以及前列腺癌等适应症的临床III期试验。 公司网址:http://www.vcarepharmatech.com/home_page/
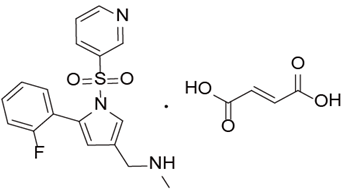
奥贝胆酸:【剂型规格】片剂:5mg、10mg 【适应症】原发性胆汁肝硬化【专利状况】2026年【研发进展】实验室研究中【项目优势】奥贝胆酸是一种治疗原发性胆汁性肝硬化和非酒精性脂肪肝的新型药物,由美国Intercept制药公司研发,2016年5月获得美国FDA批准上市。其机制主要是通过激动法尼醇X受体,调节相关基因,影响胆汁酸的合成、分泌、转运和吸收。奥贝胆酸推荐剂量为每次5mg,每日一次,最大剂量为每日10mg。这是一个潜在大品种,临床研究表明,对熊去氧胆酸不能完全耐受的患者,通过服用奥贝胆酸能够明显改善碱性磷酸酶和血清胆红素的水平,提示奥贝胆酸的临床效果可能优于现有药物熊去氧胆酸。公司网址:http://www.vcarepharmatech.com/home_page/
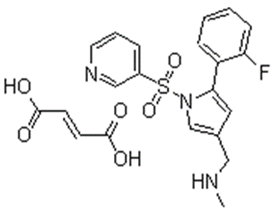
沃诺拉赞:【剂型规格】片剂:10mg、20mg【适应症】抗胃酸【专利状况】2026年【研发进展】实验室研立项中【项目优势】沃诺拉赞与传统的不可逆质子泵抑制剂(如奥美拉唑、埃索美拉唑等)相比,具有以下优点:①起效迅速,第1天给药就会达到最大的抑酸效果;②口服给药,不受胃酸破坏影响,毋需做成肠溶给药形式;③对夜间酸突破现象有一定的改善作用。④与瑞伐拉赞相比,给药剂量低。沃诺拉赞作为质子泵抑制剂,并不主要由CYP2C19代谢,同时对质子泵的抑制作用无需酸的激活,以高浓度进入胃中,首次给药便能产生最大的抑制效应,且可持续24小时。 公司网址:http://www.vcarepharmatech.com/home_page/

江苏威凯尔可提供1类创新药的研发、报批和国内/国际转让。最快曾以一年时间完成临床前开发到IND申请。目前重点在研新药项目6个。主要案例:1. 目前自持1.1类抗血栓新药临床前研究、临床I期、二期研究已结束,预计今年第三季度开展临床III期。2. 2019年1月启动1.1类抗肿瘤新药研发,于今年3月提交IND,整个过程仅耗时1年。3. 受某知名药物研究所委托研究开发的1.1类新药,即将申请Pre-IND会议,预计今年6月申报IND。4. 受某知名药企委托开发其1.1类新药项目,同时达成中间体战略合作。公司网址:http://www.vcarepharmatech.com/home_page/
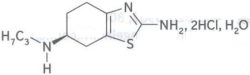
普拉克索片(API+制剂+BE):【剂型规格】片剂:0.25mg、1.0mg【适应症】原发性帕金森病【专利状况】无专利问题【研发进展】实验室研究已完成【项目优势】普拉克索是一种高度选择性多巴胺受体激动剂,通过激动多巴胺能D2受体,改善帕金森病患者临床症状,通过激动D3受体缓解患者抑郁情绪。同时还通过抑制氧化应激反应、减少自由基产生、抑制细胞凋亡和阻断谷氨酸兴奋性毒性作用所介导的多巴胺能神经元变性通路,调节多巴胺转运以及激活神经营养因子活性等机制而产生神经保护作用。原研厂家为勃林格殷格翰(Boehringer Ingelheim)并于2005年12月30日获国家局批准上市。普拉克索对D2受体具有高度选择性和亲和性,早期可单独使用治疗帕金森氏病,晚期可与多巴胺联用。而且普拉克索对多巴胺神经有保护作用,可明显延缓帕金森氏病情发展,保证患者健康,成为国内外治疗帕金森病一线首选药物。
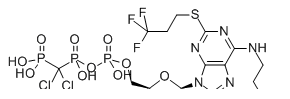
注射用坎格雷洛(API+制剂+临床):【剂型规格】冻干粉针:50mg【适应症】抗血栓【专利状况】无专利问题【研发进展】获得临床批件【项目优势】坎格雷洛为P2Y12血小板受体拮抗剂,临床用于预防及治疗血栓形成。该产品最初由阿斯利康开发,2003年12月The Medicines Company获得坎格雷洛许可权。2015年6月,FDA批准上市,目前国内尚未有该产品获批上市。坎格雷洛是针对急诊PCI治疗而研发的新型抗血小板制剂,结构类似ADP,可与P2Y12受体高亲和力结合。不需代谢转化,静脉给药后立即起效。半衰期较短,抑制作用可逆,停药后20min内抗血小板作用消失,不会增加手术期间出血风险。随着经皮冠状动脉介入治疗(PCI)的广泛应用,坎格雷洛将具有较高临床应用价值。
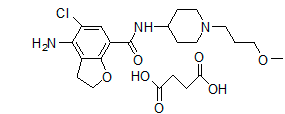
普芦卡必利(API+制剂+BE):【剂型规格】片剂:1mg、2mg【专利状况】无专利问题【研发进展】获得临床批件【项目优势】普卡必利(Prucalopride)由Shire公司开发,2009年EMA批准其用于治疗女性慢性便秘,2018年12月美国FDA批准其上市,我国则于2013年既已批准该药物。其为选择性、高亲和力的5-HT4受体激动剂,体内外研究结果显示,普卡必利具有较强的促肠动力,适用于既往使用轻泻剂无法充分缓解症状的患者。琥珀酸普卡必利对于5-HT4受体具有高度选择性,因此有别于其他5-HT4受体激动剂如替加色罗和西沙必利,其通过作用于其他受体而产生相关不良反应概率较低。从安全、有效的角度出发,普卡必利临床价值优于其他同类化合物。
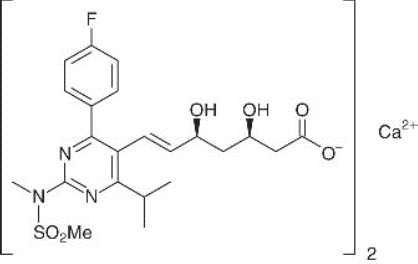
瑞舒伐他汀钙片(API+制剂+BE):【剂型规格】片剂:5mg、10mg、20mg【适应症】原发性高胆固醇血症【专利状况】无专利问题【研发进展】实验室研究中【项目优势】瑞舒伐他汀最先由日本盐野义公司开发。1998年4月转让给英国阿斯利康公司,2002年在荷兰上市。2003年获FDA批准在美国上市。2007年4月10日,阿斯利康公司的瑞舒伐他汀获得中国食药监局批准注册上市,商品名“可定”。他汀类药物主要有瑞舒伐他汀、阿托伐他汀、普伐他汀、匹伐他汀、洛伐他汀、辛伐他汀、氟伐他汀等七种,其中瑞舒伐他汀是降脂效果最强、安全性最高的他汀,是治疗高胆固醇血症和混合型高脂血症的首选药物。
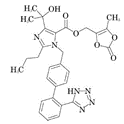
奥美沙坦酯片(制剂+BE):【剂型规格】片剂:20mg、40mg【适应症】抗高血压【专利状况】无专利问题【研发进展】实验室研究已完成【项目优势】年来,随着我国人口老龄化、生活习惯改变等导致慢病患者人数不断增多,尤其是高血压疾病,成为各种慢性疾病患病率之首。庞大患病人群的用药需求,推动了高血压药物市场不断增长。血管紧张素II受体拮抗剂,又简称“沙坦类”,是被推荐的一线用药,其效果及耐受性较普利类相近或更优,且副作用少、药效长,特别适用于高血压并发的糖尿病、肾病患者。
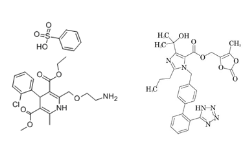
奥美沙坦氨氯地平复方片(制剂+BE):【剂型规格】片剂:奥美沙坦/氨氯地平20/5mg【适应症】抗高血压【专利状况】无专利问题【研发进展】实验室研究中【项目优势】该复方产品为日本第一制药公司(Daiichi Sankyo)原研,可方便地一日1次口服1片,为医生提供了需有效降低血压或用其它药物难以控制血压的高血压患者的治疗新手段。在临床研究中,该产品显著降低高血压患者坐位收缩压和舒张压。作用强的钙通道阻滞剂氨氯地平抑制钙离子进入血管壁,奥美沙坦酯阻断血管紧张素Ⅱ受体,两药联用有协同作用。该产品通过两药的协同作用松弛血管,使血液畅通。该产品突出特点两药联用,疗效协同,并且一日一片,患者依从性好,同时还能用于难以控制的高血压病症。
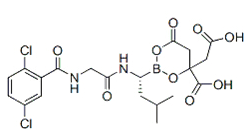
埃沙佐米胶囊(API+制剂+BE):【剂型规格】片剂:4mg、3mg、2.3mg【适应症】多发性骨髓瘤【专利状况】专利期至2027年【研发进展】实验室研究中【项目优势】口服,硼替佐米下一代,口服给药,具有明显优势。埃沙佐米由武田旗下的千年制药研发,2015年11月获得美国FDA批准上市。2011年因治疗多发性骨髓瘤而获得美国FDA的孤儿药资格。作为多发性骨髓瘤的二线治疗药物,该药需联合来那度胺和地塞米松治疗多发性骨髓瘤。
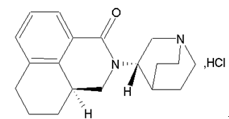
盐酸帕洛诺司琼注射液(API+制剂):【剂型规格】注射剂:0.25mg:5mL、0.075 mg:1.5mL【适应症】止吐【专利状况】无专利问题【研发进展】实验室研究已基本完成,随时可以中试交接【项目优势】从临床优势来说,帕洛诺司琼的重要特性是半衰期长,约有40个小时,与受体的亲合力几乎是其它5-HT3拮抗剂的100倍,并且用量低,其在不良反应及安全性方面与同类药物相比有明显改善,不但能有效控制化疗引起的急性恶心和呕吐,也是第一个能有效控制化疗引起的慢性(延迟性)恶心和呕吐的5HT3受体拮抗剂。同时,帕洛诺司琼克服了昂丹司琼、多拉司琼和格拉司琼需在不同阶段给药的缺点,患者的依从性好。从市场前景来说,止吐药物作为癌症治疗重要的辅助治疗药物,随着癌症发病率的升高,止吐药物市场也水涨船高,不断扩容。
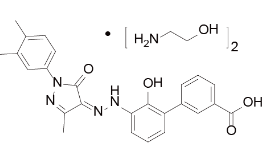
艾曲波帕片(API+制剂+BE):【剂型规格】片剂:12.5mg、25mg、50mg、75mg、100mg【适应症】慢性特发性血小板减少性紫癜患者的血小板减少【专利状况】专利期至2023年【研发进展】实验室研究中【项目优势】艾曲波帕由葛兰素史克开发,2008年11月在美国上市,用于治疗经糖皮质激素类药物、免疫球蛋白治疗无效或脾切除术后慢性特发性血小板减少性紫癜(ITP)患者的血小板减少,后于2010年10月获批在日本上市。2014年8月26日艾曲波帕治疗重症再生障碍性贫血(SAA)患者血细胞减少的适应症获得FDA批准,适应症人群进一步扩大。
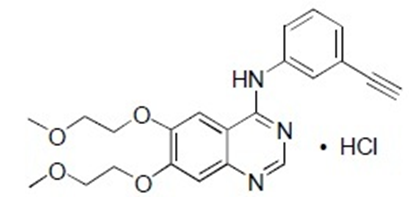
盐酸厄洛替尼片(API+制剂+BE):【剂型规格】片剂:25mg、100mg、150mg【适应症】抗肿瘤【专利状况】无专利问题【研发进展】实验室研究已基本完成,随时可以中试交接【项目优势】肺癌是人类癌症致死的重要原因,非小细胞肺癌占所有肺癌患者的85%。据Globaldata数据库统计,2023年预计将达到543.85亿美元。2016-2023年年复合增长率为18.7%,非小细胞肺癌市场整体上呈增长趋势。厄洛替尼是肺癌靶向治疗药物属于表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),通过抑制肿瘤细胞EGFR的信号传导,达到抑制肿瘤细胞增殖,促进肿瘤细胞调亡的目的。厄洛替尼对化疗失败的晚期NSCLE有一定的治疗作用,在改善患者生存质量和耐受性方面要优于化疗。替尼类药物是近年抗肿瘤领域的热点,全球新药研发和国内仿制药开发纷纷瞄准了这一领域,其市场前景被广泛看好。
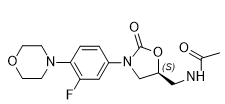
利奈唑胺葡萄糖注射液(API+制剂):【剂型规格】注射剂:300ml:600mg【适应症】抗病毒【专利状况】无专利问题【研发进展】实验室立项中【项目优势】恶唑烷酮类抗菌药是一类新型化学全合成抗菌药。该类药物在化学结构上均有一噁唑烷二酮母核,具有全新的抗菌机制,对革兰阳性球菌,特别是多重耐药的革兰阳性球菌,具有较强的抗菌活性,与其他药物不存在交叉耐药现象。利奈唑胺是由美国Pharmacia&Upjohn 公司开发研制的第一个恶唑烷酮类抗菌药。2000 年4 月18 日被美国FDA 批准上市。与其它药物不同,利奈唑胺不影响肽基转移酶活性,只是作用于翻译系统的起始阶段,抑制mRNA与核糖体连接,阻止70S起始复合物的形成,从而抑制了细菌蛋白质的合成。利奈唑胺的作用部位和方式独特,因此在具有本质性或获得性耐药特征的阳性细菌中,都不易与其它抑制蛋白合成的抗菌药发生交叉耐药,在体外也不易诱导细菌耐药性的产生。由于抗菌机制较为优异,利奈唑胺市场潜力大,疗效优势明显。

恩替卡韦片(制剂+BE):【剂型规格】片剂:0.5mg、1.0mg【适应症】抗病毒【专利状况】无专利问题【研发进展】实验室研究已完成,可即刻交接【项目优势】恩替卡韦,商品名为BARACLUDE(博路定),20世纪90年代由美国BMS公司研制,其最初开发的目的是用来医治单纯疱疹病毒感染,后发现其具有很强的抗HBV效果且毒性相对很低,故开发作为慢性乙型肝炎的医治药物,并于2005年3月29日经美国FDA批准而成功上市,而在我国,中美上海施贵宝制药有限公司同年以“博路定”商品名上市了恩替卡韦片。恩替卡韦作为目前世界卫生组织和各国指南推荐的慢性乙型肝炎患者抗病毒医治的一线药物之一。这个项目威凯尔实验室研究已经完成,可与客户即刻进行中试交接。并且可按包过模式操作。