 该商家已通过实名认证
该商家已通过实名认证
【评价原理】
斑马鱼肾脏的肾小球具有与高等脊椎动物肾脏同样的细胞组成,同样的血液滤过、肾小管重吸收功能,一旦肾功能损伤或缺失,斑马鱼就会因无法调节渗透压而产生严重的水肿,同时可能导致肾小球滤过功能下降。
因此,我们可以用两种方法评价肾脏毒性:1. 肾性水肿发生率。由于斑马鱼通体透明,肾性水肿可以明显的被观察到。2. 肾小球滤过率。我们可以对斑马鱼注射一种荧光标记物,一段时间后,正常斑马鱼可将荧光标记物排出体外,而肾小球滤过功能损伤的斑马鱼则不能,通过荧光标记物排泄的情况可以反应斑马鱼肾脏的功能。
【实验方案】
我们将受测试斑马鱼分成两组,分别是正常对照和服用/注射供试品组(供试品通过溶解到养鱼用水中或注射的方式摄入到斑马鱼体内)。
服用/注射药物一段时间后,我们对斑马鱼表型进行观察评价,统计肾性水肿发生情况
【结果展示】

图1. 斑马鱼肾脏毒性表型图
可以看到,服用/注射供试品组的斑马鱼出现了明显的肾性水肿的表型。

图2. 斑马鱼肾小球滤过率典型图
可以看到,服用/注射供试品组的斑马鱼荧光强度明显强于正常对照组,标记物排泄明显减少,肾小球滤过率下降,肾脏功能受损。
【评价结论】
1.经过每组30尾斑马鱼的对比实验,服用/注射供试品组的斑马鱼有明显的肾性水肿和肾小球滤过率明显下降,与正常对照组存在明显的差别。
2.本实验说明该供试品对斑马鱼有肾脏毒性。
更多项目服务,请拨电话咨询:0571-83782130,项目经理手机 17364531293(微信同号)

【评价原理】
斑马鱼的胃肠道在细胞功能和解剖学方面均与人类相似,由内皮细胞、结缔组织、外纵肌和环状肌组成。胚胎发育至26~126 hpf( hours post fertilization,受精后小时),斑马鱼胃肠道的管腔形成并不断生长,形成有功能的肠道上皮。在未喂食情况下,斑马鱼胚胎受精约72 hpf,肠道首次出现不稳定的自发收缩。伴随着发育的进行,第120~144 hpf,斑马鱼大部分的卵黄囊被吸收,肠道自发的蠕动及摄食能力增强。
我们评价斑马鱼胃肠道毒性有2个指标:1.胃肠道形态的变化;2.肠蠕动功能抑制。
【实验方案】
我们将受测试斑马鱼分成两组,分别是正常对照组和服用供试品组(供试品通过溶解到养鱼用水中的方式摄入到斑马鱼体内)。摄入供试品之前提前给予食物,摄入供试品一段时间后,我们观察斑马鱼肠道表型。
服用一段时间供试品后,我们观察胃肠道形态及内容物的情况。
【结果展示】

图1. 斑马鱼胃肠道形态表型图
可以看到,服用/注射供试品组可见明显肠褶皱缺失、肠腔异常等。

图2. 斑马鱼肠蠕动功能抑制表型图
可以看到,斑马鱼给予食物后,食物充盈肠道。服用/注射供试品组食物明显多于正常对照组,表明肠蠕动功能被抑制。
【评价结论】
1.经过每组30尾斑马鱼的对比实验,服用/注射供试品组的斑马鱼胃肠道形态与正常对照组比较,发生了明显的变化,且肠道蠕动功能被抑制。
2.本实验证实了该供试品对斑马鱼有胃肠道毒性。
更多项目服务,请拨电话咨询:0571-83782130,项目经理手机 17364531293(微信同号)

【评价原理】
免疫毒性是指化合物对机体免疫系统的损伤作用,包括两类,一是免疫抑制,即免疫系统的广泛抑制,可致机体对感染的易感性增加及肿瘤发生率增高;另一是免疫增强,即免疫系统反应性过度增强,可能包括免疫性产生,过敏反应(超敏反应或变态反应)、自身免疫反应以及不良免疫刺激等。
斑马鱼具有先天免疫系统和获得性免疫系统,与果蝇和线虫模型相比,斑马鱼的免疫系统发育的更完整。研究证实斑马鱼与哺乳动物一样,具有T细胞、B细胞、自然杀伤细胞,其免疫系统对于环境中的免疫毒性物质(包括哺乳动物)非常的敏感。
免疫毒性指标有3个:(1)应用转基因中性粒细胞绿色荧光斑马鱼,观察中性粒细胞数量;(2)应用转基因巨噬细胞绿色荧光斑马鱼,观察巨噬细胞数量(荧光强度);(3)注射红色荧光微球,巨噬细胞吞噬微球排出体外,用体内微球的数量反映巨噬细胞吞噬功能。(4)检测T/B相关基因(rag1和rag2)表达。
【实验方案】
我们将受测试斑马鱼分成二组,分别是正常对照和服用/注射供试品组(供试品通过溶解到养鱼用水中或注射的方式摄入到斑马鱼体内)。
服用/注射供试品一段时间后,我们对斑马鱼检测中性粒细胞和巨噬细胞计数、巨噬细胞吞噬功能和T/B相关基因(rag1和rag2)表达。
【结果展示】
(1)中性粒细胞数量

图1. 斑马鱼中性粒细胞表型图
绿色小点为中性粒细胞
可以看到,服用供试品组斑马鱼体内中性粒细胞数量比正常对照组明显减少。
(2)巨噬细胞数量

图2. 斑马鱼巨噬细胞表型图
可以看到,服用供试品组斑马鱼体内巨噬细胞数量比正常对照组明显减少。
(3)巨噬细胞吞噬功能

图3. 斑马鱼巨噬细胞表型图
可以看到,服用供试品组的吞噬颗粒的巨噬细胞数量与正常对照组比较有明显减少,说明巨噬细胞吞噬功能下降。
(4)T/B相关基因表达(rag1和rag2)

图4. 斑马鱼rag1和rag2表达
左图为rag1基因相对表达量,右图为rag2基因相对表达量
可以看到,服用供试品组的rag1和rag2相对表达量与正常对照组比较均有减少。
【评价结论】
1.经过每组30尾斑马鱼的对比实验,服用供试品组的中性粒细胞和巨噬细胞数量与正常对照组比较均有减少,其巨噬细胞吞噬功能有所下降,且rag1和rag2相对表达量减少。
2.本实验证实了该供试品具有免疫毒性。
更多项目服务,请拨电话咨询:0571-83782130,项目经理手机 17364531293(微信同号)

【评价原理】
神经毒性通常指某些药物影响机体的神经传导,导致神经传导中断或减弱,从而影响机体的正常功能。斑马鱼的基因与人类基因的相似度达到87%,神经系统形成过程和发育机制与人类高度相似,在6 hpf(受精后6小时)神经系统开始发育,受精6天后所有神经系统发育完成。斑马鱼在短时间内形成整个神经系统,为神经毒性的评价带来了有利的条件。而且斑马鱼对药物神经毒性的预测准确性高,同时兼具快速、高效、经济的优点。
我们评价斑马鱼神经毒性有3个指标:1.行为学;2.中枢神经凋亡细胞荧光信号强度;3. 外周运动神经长度。
【实验方案】
我们将受测试斑马鱼分成两组,分别是正常对照和服用/注射供试品组(供试品通过溶解到养鱼用水中或注射的方式摄入到斑马鱼体内)。
服用/注射药物一段时间后,我们观察斑马鱼的运动行为,通过荧光染色观察中枢神经凋亡细胞,也可以利用转基因运动神经绿色荧光NBT品系斑马鱼观察外周运动神经长度。
【结果展示】

图1. 斑马鱼神经毒性运动轨迹图
可以看到,服用/注射供试品组斑马鱼运动明显减少。

图2. 斑马鱼光暗刺激下每分钟运动速度表型图
可以看到,服用/注射供试品组斑马鱼对光暗刺激不敏感。

图3. 斑马鱼中枢神经凋亡细胞表型图
黄色虚线框内为中枢神经分析区域,绿色荧光小点为凋亡细胞
可以看到,服用/注射供试品组斑马鱼中枢神经细胞凋亡明显增加。

图4. 斑马鱼外周运动神经表型图
可以看到,服用/注射供试品组斑马鱼外周运动神经明显缩短。
【评价结论】
1.经过每组30尾斑马鱼的对比实验,服用/注射供试品组的斑马鱼运动明显减少且对光暗刺激不敏感,中枢神经细胞凋亡增加且外周运动神经缩短,与正常对照组存在明显的差别。
2.本实验证实了该供试品对斑马鱼有神经毒性。
更多项目服务,请拨电话咨询:0571-83782130,项目经理手机 17364531293(微信同号)

【评价原理】
甲萘醌是一种氧化剂,通过细胞内还原酶系统(微粒体的P450还原酶和线粒体的呼吸链还原酶),产生不稳定的半醌,进入氧化还原循环,产生活性氧族。用甲萘醌可诱导斑马鱼建立氧化应激模型。
经过特异性荧光染色(呈绿色,主要定位于细胞核和线粒体),发生氧化应激反应斑马鱼全身明显比正常斑马鱼绿很多,可以用荧光显微镜下观察到斑马鱼体内的活性氧含量。
【实验方案】
我们将受测试斑马鱼分成三组,分别是正常对照组、模型对照组和抗氧化剂组。其中正常对照组未摄入甲萘醌,模型对照组与抗氧化剂组都摄入了等量的甲萘醌(甲萘醌通过溶解到养鱼用水中的方式摄入到斑马鱼体内)。抗氧化剂组在摄入甲萘醌之后摄入还原型谷胱甘肽之类的抗氧化剂。
服用一定时间抗氧化剂后,我们对斑马鱼整体做活性氧染色,观察整体绿色荧光强度的变化。
【结果展示】

图1. 斑马鱼活性氧表型图
绿色荧光为活性氧
可以看到,抗氧化剂组的荧光强度较正常对照组强,但较模型对照组明显减弱。
【评价结论】
1.经过每组30尾斑马鱼的对比实验,抗氧化剂组的荧光强度比模型对照组弱。
2.本实验证实了还原型谷胱甘肽具有明显抗氧化功效。
更多项目服务,请拨电话咨询:0571-83782130,项目经理手机 17364531293(微信同号)

【评价原理】
目前国际上公认的药物毒性与安全性评估实验方法分为体外与体内实验2种。斑马鱼实验为整体动物研究,能反映化合物吸收、分布、代谢与排泄的过程。而且,斑马鱼与人类基因组的相似度高达87%,有与人类近似的毒性特征和信号传导通路,斑马鱼的各种器官和组织在解剖学、生理学和分子水平上类似于哺乳动物,因此是一种可比性较强的模式生物,可以用于各种类型供试品的急性毒性评价。
【实验方案】
我们将受测试斑马鱼分成两组,分别是正常对照和服用/注射供试品组(供试品通过溶解到养鱼用水中或注射的方式摄入到斑马鱼体内)。
服用/注射药物一段时间后,我们对斑马鱼整体进行观察评价,观察斑马鱼心脏、脑部、耳、下颌、眼、肝脏、肠道、躯干/尾/脊索、肌肉/体节、鳍、体长、身体着色、循环系统、身体水肿和出血等毒性反应情况,统计毒性发生率。
【结果展示】

图1. 斑马鱼胚胎毒性表型图
可以看到,服用/注射供试品组的眼变小、心包水肿、肝脏变性、卵黄囊吸收延迟、肾性水肿、胃肠道发育延迟。
【评价结论】
1.经过每组30尾斑马鱼的对比实验,服用/注射供试品组的组织器官产生明显的急性毒性表型,与正常对照组存在明显的差别。
2.本实验证实了该供试品对斑马鱼有急性毒性。
更多项目服务,请拨电话咨询:0571-83782130,项目经理手机 17364531293(微信同号)

【评价原理】
斑马鱼皮肤结构与功能与人类高度相似,斑马鱼皮肤含有基底层、棘层、颗粒层、透明层和表皮角质细胞层;另外尚有与人皮肤结构相同的固有层、半桥粒、黑色素细胞、血管和皮下脂肪细胞等。斑马鱼皮肤间质结缔组织、胶原及其临近的纤维母细胞及皮肤基因表达亦与人类皮肤相似。
我们评价斑马鱼皮肤肌肉毒性有4个指标:1.皮肤刺激;2.肌肉纹理;3.皮肤凋亡细胞定量;4.皮肤色素变化。
【实验方案】
我们将受测试斑马鱼分成两组,分别是正常对照组和供试品组(供试品通过溶解到养鱼用水中摄入到斑马鱼体内)。
皮肤吸收供试品一段时间后,我们通过中性粒转基因荧光斑马鱼,观察皮肤/肌肉刺激性;通过表型拍照,观察肌肉纹理及皮肤色素变化;通过AO染色凋亡细胞,观察皮肤细胞凋亡情况。
【结果展示】

图1. 斑马鱼皮肤刺激性典型图片
可以看到,供试品组皮肤/肌肉可见明显中性粒细胞聚集。

图2. 斑马鱼皮肤损伤典型图片
可以看到,供试品组可见明显肌肉纹理不清晰。

图3. 斑马鱼凋亡细胞表型图
可以看到,供试品组尾部可见明显凋亡(绿色荧光亮点)。

图4. 斑马鱼皮肤色素异常表型图
可以看到,供试品组躯干可见明显色素异常(黄色虚线区域)。
【评价结论】
1.经过每组30尾斑马鱼的对比实验,供试品组的斑马鱼皮肤肌肉产生明显的毒性表型(包括肌肉纹理异常和色素异常),在斑马鱼尾部可见明显的凋亡细胞,在躯干部可见明显的中性粒细胞聚集。
2.本实验证实了该供试品对斑马鱼有皮肤肌肉毒性。
更多项目服务,请拨电话咨询:0571-83782130,项目经理手机 17364531293(微信同号)

【评价原理】
斑马鱼的基因与人类基因的相似度达到87%,与哺乳动物对外源化学物质的防御机制相当,包括酶的诱导和氧化应激。当生物暴露在环境污染物中,生物可能会发生氧化应激,主要表现为活性氧(ROS)产生和消耗的不平衡。在需氧生物的活细胞中,活性氧被一种由水和脂溶性低分子量自由基清除剂、特异性抗氧化酶组成的抗氧化防御机制解毒。
应用ROS特异性荧光检测试剂,它的水解产物能被ROS氧化为高荧光物质,用多功能酶标仪检测荧光值反映氧化应激的程度。本方法已被授予国家发明专利。
【实验方案】
我们将受测试斑马鱼分成三组,分别是底物对照组、正常对照和服用供试品组(供试品通过溶解到养鱼用水中摄入到斑马鱼体内),并加入ROS特异性荧光检测试剂。
服用供试品一段时间后,我们使用酶标仪对斑马鱼体内ROS进行荧光定量。
【结果展示】

图1. 斑马鱼体内ROS荧光值
可以看到,服用供试品组斑马鱼体内荧光值比正常对照组有明显升高。
【评价结论】
1.经过每组30尾斑马鱼的对比实验,服用供试品组的斑马鱼ROS水平明显高于正常对照组,与正常对照组存在显著性差异。
2.本实验证实了该供试品诱发斑马鱼氧化应激。
更多项目服务,请拨电话咨询:0571-83782130,项目经理手机 17364531293(微信同号)

【评价原理】
铅中毒的器官主要是造血系统、心脏和神经系统。对于儿童的神经系统损伤导致智商降低,注意力缺陷多动障碍以及阅读和学习能力下降,其毒性机制与神经元生长和轴索束变化相关。
通过斑马鱼体内铅含量、轴索荧光强度和运动神经长度检测,铅中毒的斑马鱼体内铅含量明显比正常斑马鱼的高很多,而轴索荧光强度和运动神经长度铅中毒斑马鱼均明显少于正常斑马鱼。由于斑马鱼可被整体免疫荧光染色以及转基因荧光鱼运动神经发荧光的特性,我们可以通过荧光强度观察到明显的轴索细胞和运动神经的变化。
【实验方案】
我们将受测试斑马鱼分成五组,分别是正常对照组、模型对照组和服用促排铅剂组。其中正常对照组未摄入铅,模型对照组与服用促排铅剂组都摄入了等量的铅(铅通过溶解到养鱼用水中的方式摄入到斑马鱼体内)。服用促排铅剂组在摄入铅的同时摄入绿豆肽复方之类的促排铅剂。
服用一段时间促排铅剂后,我们(1)检测体内铅含量;(2)用荧光显微镜采集轴索荧光强度;(3)用荧光显微镜采集运动神经长度。
【结果展示】
(1)体内铅含量:

图1. 斑马鱼体内铅含量
与模型对照组比较,*p < 0.05
可以看到,服用排铅剂组的铅含量与摄入相同铅的模型对照组比较相似明显减少。
(2)轴索荧光强度:

可以看到,服用排铅剂组脑部轴索荧光强度与摄入相同铅的模型对照组比较明显增加。
【评价结论】
1.经过每组30尾斑马鱼的对比实验,服用促排铅剂组的铅含量、轴索荧光强度和运动神经长度与未摄入铅的正常对照组相似,并未出现模型对照组的铅含量升高,轴索荧光强度和运动神经长度减少的情况。
2.本实验证实了绿豆多肽复方具有明显的促排铅功效。
更多项目服务,请拨电话咨询:0571-83782130,项目经理手机 17364531293(微信同号)


斑马鱼系统设备详情如下:
▼ 斑马鱼养殖系统设备 / 定制多层独立养殖鱼架


产品参数(示例):

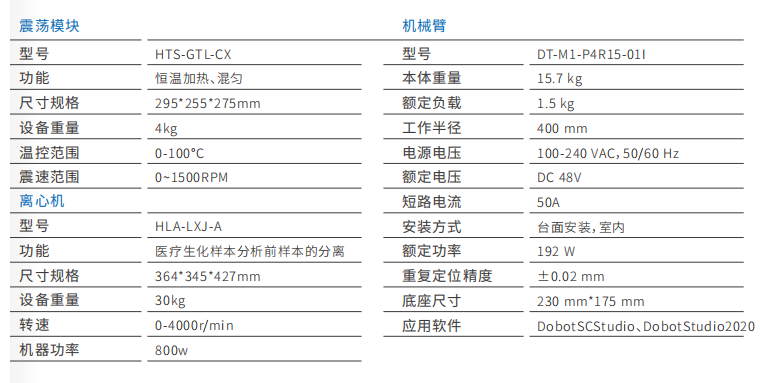
▼ 斑马鱼3D/2D行为分析系统设备 / 运动轨迹追踪系统


产品参数(示例):

▼ 斑马鱼专用成像系统/斑马鱼成像系统设备

产品参数(示例):
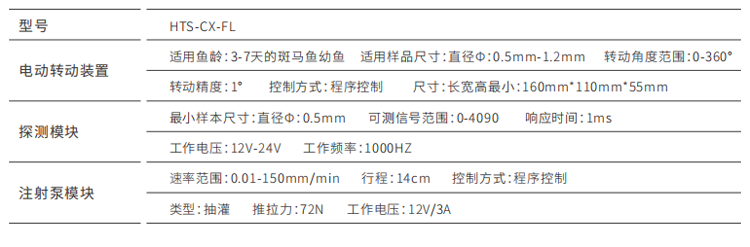
▼ 斑马鱼强迫游泳仪/斑马鱼强迫游泳设备

产品参数(示例):

▼ 斑马鱼培养箱/生化培养箱
产品介绍:
斑马鱼培养箱,用于斑马鱼胚胎常规孵化和培养,可实现精确的温度控制,为斑马鱼培养提供适宜的生存环境,是培养斑马鱼的专用恒温设备。
产品优势:

产品参数(示例):

▼ 斑马鱼臭氧干燥箱/斑马鱼干燥箱
产品介绍:
斑马鱼臭氧干燥箱,适用于斑马鱼鱼房中各类器材配件的消毒,臭氧消毒更加绿色环保,且无残留。双加热器、双风机循环系统,可编程自动控制灭菌与干燥。
产品优势:

产品参数(示例):

▼ 斑马鱼胚胎分装系统/斑马鱼胚胎分装设备系统
产品介绍:
斑马鱼胚胎分装系统,适用于替代人工进行斑马鱼的分装工作,可以快速将斑马鱼自动准确快速的分装到制定培养容器内。
产品优势:

产品参数(示例):
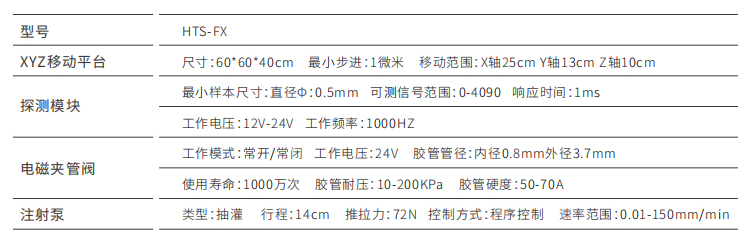
▼ 斑马鱼高通量设备/斑马鱼高通量工作站建设

产品参数(示例):
关于我们
环特一站式斑马鱼实验室建设与运营解决方案,是环特实验室面向医院、疾控中心、海关、科研院所和药物、保健食品和化妆品企业等行业,推出的一项基于斑马鱼实验平台构建与技术应用为目标的整体性技术平台建设服务。
我们以自身近20年斑马鱼技术应用的深厚积累为依托,通过深刻总结斑马鱼从养殖、模型开发、设备配置、资质认可/认证、标准化运营管理,再到成果输出等能力模块的发展需求,从而形成一套专业高效、可信赖的技术解决方案:涵盖实验室规划设计、软硬件能力配置、斑马鱼合规鱼种供应、试剂耗材、人员培训与运维技术咨询等全周期综合服务。
仪器设备,是实验室功能的核心单元。在斑马鱼实验室设备领域,环特自主开发了10余类具备领先竞争力的智能化设备。比如斑马鱼养殖系统、斑马鱼专用成像系统、斑马鱼3D行为分析系统、斑马鱼2D行为分析系统、斑马鱼强迫游泳试验仪、斑马鱼胚胎分装系统、斑马鱼培养箱、斑马鱼臭氧干燥箱和斑马鱼高通量工作站等专用仪器设备,大幅提升实验室运营效率,加速技术成果产出。
环特实验室已通过CNAS、CMA和AAALAC认证,拥有实验动物生产与使用许可证,自有8500m²实验室。
环特实验室在技术研发与应用领域,已牵头起草发布团体标准17项,申请发明专利66项,自主开发斑马鱼模型170多种,发表SCI及核心期刊论文220多篇,已有7个新药项目成功将环特斑马鱼实验数据用于NMPA(国家药监局)的临床试验申报,累计完成项目8000多个,长期合作客户800多家。
服务咨询
斑马鱼系统设备具体参数及价格等事项,请拨电话咨询:0571-83782130,手机 17364531293(微信同号)。
