 该商家已通过实名认证
该商家已通过实名认证● 中国斑马鱼技术产业应用史,就是环特生物发展史。作为斑马鱼技术应用的全球领导者,凭借20年技术积累,环特生物已创建了以斑马鱼+类器官+哺乳动物+人体为核心的“四位一体”的综合性技术服务平台,相继形成了科研及研发服务、智慧实验室建设和精准医疗三大商业模式。可面向药物、营养保健食品、化妆品行业的企业及医院、高校等科研单位,开展原料筛选、新产品开发研究、功效研究和安全评价等技术服务。 ● 知识产权方面,环特生物已牵头起草、发布团体标准11项,申请国家发明专利64项。自主开发斑马鱼模型170多种,发表SCI及核心期刊论文170余篇(最高IF=23.17)、英文专著1部。有7个新药项目,成功将环特生物斑马鱼实验数据用于NMPA(国家药监局)的临床试验申报。1项成果获浙江省科学技术进步奖三等奖,并作为核心技术方承担2022年杭州“亚运果蔬类食品农药残留非靶向快筛斑马鱼模型构建研究”的项目。2项斑马鱼产业化项目成果鉴定,经张伯礼院士和孙宝国院士领衔的技术专家审核,分别被评定为“国内领先水平”和“国际先进水平”。 ● 环特生物已通过国家CNAS实验室认可、CMA资质认定及AAALAC国际实验动物认证、实验动物生产与使用许可证,多项技术成果先后荣获德国纽伦堡,俄罗斯,英国,中国四大国际发明展金奖、农业农村部神农中华农业科技一等奖、中国乳制品工业协会技术发明二等奖等多项权威大奖,被评为国家高新技术企业、院士专家工作站、省级高新技术企业研发中心、浙江省博士后科研工作站等,与中国农科院质标所成立了“农业农村部农产品质量标准研究中心生物评价实验室”的联合创新平台。 ● 目前,环特生物已在杭州、南京、广州、北京、上海和波士顿,布局六大创新实验中心,为各区域客户提供本地化、高效的实验外包服务。已累计完成项目超8000个,长期合作的国内外企业、研发机构和科研院校客户800多家。 ● 部分服务项目:一站式生物评价技术解决方案、产品功效与安全性评价、原料配方筛选验证、药效评价与药物筛选、毒理药理评价、临床前研究、斑马鱼基因编辑、类器官培养与试剂售卖、小鼠实验平台、科研课题研究、斑马鱼实验室建设、斑马鱼养殖系统与技术授权培训等。
[更多详情]

类器官简介
类器官是一种原代组织来源的成体干细胞体外自组装成的3D器官型结构,可分化为多个器官特异性的细胞类型,并能够表现出细胞与细胞之间、细胞与其周围基质之间的相互作用和空间位置形态,在体外重现人体真实器官的一些关键功能和结构,并具有稳定的表型和遗传学特征。
作为新兴的生物学模型,类器官具有细胞系和动物模型所不具有的独特优势,其细胞组成和结构更加类似人体组织,可提供一个高度生理相关的系统,是基础研究的模型。同时,类器官模型相对实验动物更加经济,且时效性更高,可以提高研究效率。
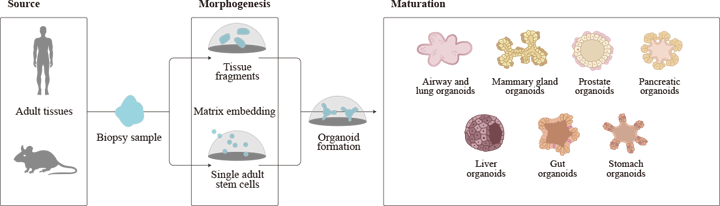
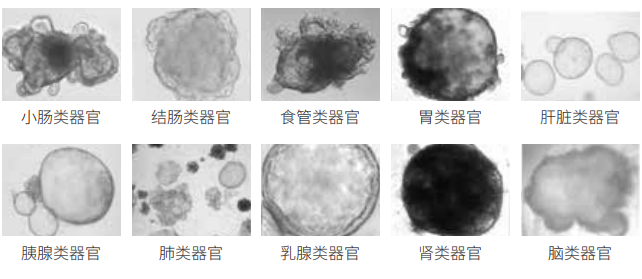
类器官模型的应用


类器官模型的优势
·速度快 ·通量高 ·临床相关性强
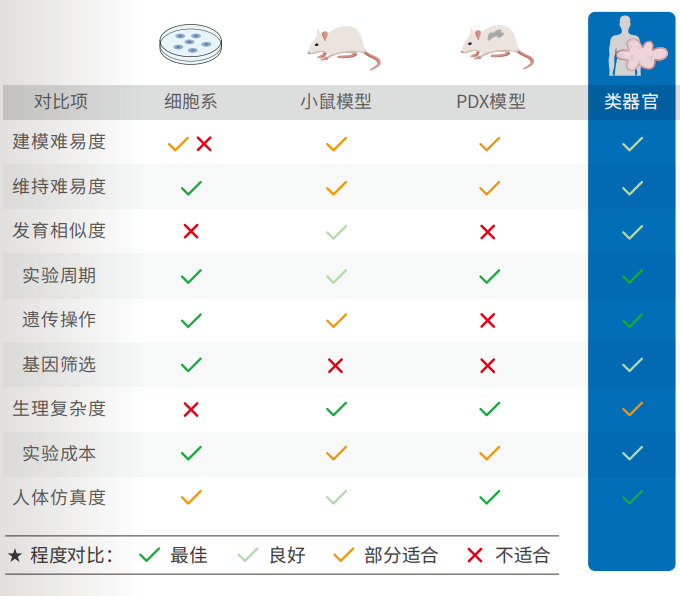
类器官的构建
建立PSC和AdSc类器官的过程
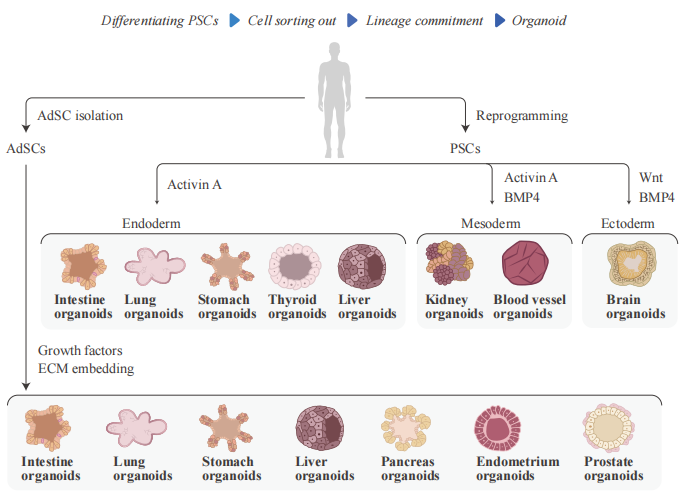
● 以 iPS/ES 或成体干细胞为起点, 在 3D 环境下, 利用细胞因子将干细胞定向分化后建立的, 具有各种器官主要组织细胞类型及组织特征的微型结构。
● 多能干细胞(PSC)来源的类器官是在PSCs定向分化后建立的, 首先是胚层的形成, 随后是诱导和成熟, 通过加入特定的生长和信号因子来获得所需的器官特定细胞类型。
● 成体干细胞(AdSC)衍生的类器官培养需要分离组织特异性干细胞群, 然后将其嵌入细胞外基质中, 并加入明确的组织特异性生长因子, 实现类器官的增殖。
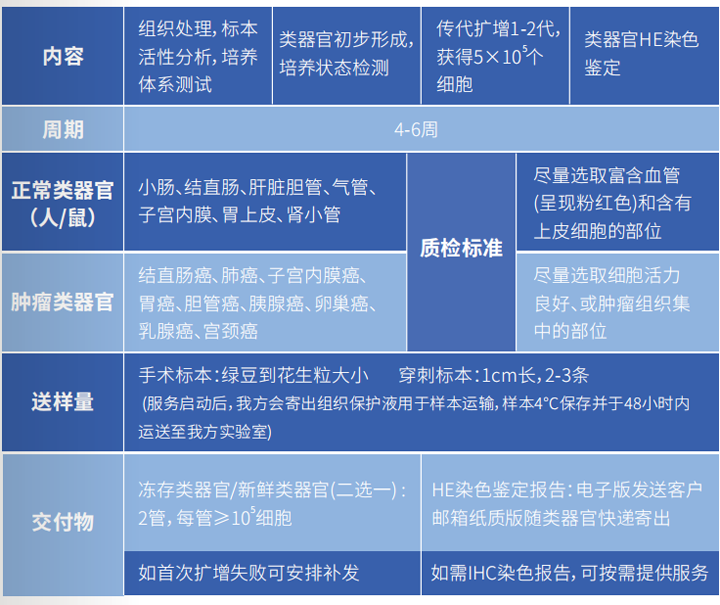
类器官构建委托技术服务
环特生物简介
医-健-美-食产业斑马鱼技术应用服务商
环特生物,已通过CNAS、CMA、ILAC-MRA、AAALAC资质认证。
环特生物,是专注服务于生物医药和大健康美妆产业的一站式功效与安全评价技术提供商。经多年发展,已形成了以斑马鱼平台为核心,以类器官、哺乳动物、人体和微生物平台为特色,兼具生物医药CRO能力和大健康美妆一站式研发检测的产业平台新格局。
作为斑马鱼技术应用服务商,环特生物深度挖掘、创新斑马鱼技术的应用场景,将斑马鱼模型、基因编辑技术和模型,成功应用于药物、保健食品、化妆品、功能食品的原料筛选、配方研发、生产质控、营销背书、新品备案以及斑马鱼实验室的建设运营,为企业提供全产业链条上的功效和安全评价的技术服务。

类器官构建委托技术服务,请拨电话咨询 0571-83782130,项目经理手机 17364531293(微信同号)。

【评价原理】
过高的血尿酸浓度可以引起痛风,并与其他代谢类疾病相关联。斑马鱼具有与嘌呤代谢有关的黄嘌呤脱氢酶,尿酸氧化酶,尿囊素酶和尿囊酸酶。尿酸氧化酶是动物嘌呤代谢过程中一种重要的酶,能催化尿酸氧化生成尿裹素、CO2和H2O2。大多数脊椎动物的肝脏、肾脏和脑髓里均发现有此酶的存在。
经过尿酸荧光试剂盒特异性反应,患有高尿酸的斑马鱼的尿酸荧光信号强度会比正常斑马鱼的尿酸荧光信号强度明显增多。

【实验方案】
我们将受测试斑马鱼分成三组,分别是正常对照组、模型对照组和降尿酸产品组。其中正常对照组未摄入氧嗪酸钾和黄嘌呤,模型对照组与降尿酸产品组都摄入了等量的氧嗪酸钾和黄嘌呤(氧嗪酸钾和黄嘌呤通过溶解到养鱼用水中的方式摄入到斑马鱼体内)。降尿酸产品组在摄入氧嗪酸钾和黄嘌呤的同时摄入鲣鱼胶原肽和蛹虫草之类的降尿酸产品。
服用一段时间降尿酸产品组后,我们用尿酸荧光检测试剂盒检测斑马鱼体内尿酸水平。
【结果展示】


图1. 斑马鱼体内尿酸水平(荧光信号强度)
与模型对照组比较,*** p < 0.001
可以看到,服用降尿酸产品组的斑马鱼体内尿酸水平与未摄入氧嗪酸钾和黄嘌呤的正常对照组相似,没有明显的尿酸升高现象。
更多项目服务,请拨电话咨询:0571-83782130,项目经理手机 17364531293(微信同号)

环特生物,利用斑马鱼模型实验,为客户提供毒性评价、毒理学实验、急毒长毒实验、化妆品,保健食品,药物毒性评价检测、生态水质毒性检测等服务,周期短、费用低、高效专业。
毒性实验-毒理学评价检测
 疾病/病理 毒性评价-安全性评价模型
疾病/病理 毒性评价-安全性评价模型

更多的毒理实验-毒性评价检测及内容,请拨电话咨询:0571-83782130,项目经理手机 17364531293
环特生物公司已通过国家CNAS、CMA资质认定和AAALAC国际认证,自有2000m²斑马鱼生物评价实验室。
环特生物在斑马鱼技术研发与应用领域,已牵头起草发布团体标准10项,申请发明专利64余项,自主开发的主要斑马鱼模型150多种,发表SCI及核心期刊论文120余篇,已有7个新药项目成功将环特生物斑马鱼实验数据用于CFDA的临床试验申报,公司已累计完成项目超5000个,建立长期合作客户600多家。

环特生物可定制的斑马鱼实验模型有数百种,主要应用于化妆品,保健食品,药物功效与安全性评价、药理毒理评价、临床前研究实验、药物高通量筛选、化合物筛选、活性成分筛选、分子生物学实验、斑马鱼行为分析等,周期短、费用低、高效专业。
▼斑马鱼模型实验-CRO实验外包-定制服务项目(部分)

▼药物实验类服务项目(CRO外包委托实验)

▼食品/保健食品功效与毒性安全性评价检测项目(部分)

▼化妆品/原料 评价备案检测项目(部分)

更多更详细的斑马鱼模型实验定制服务项目,请拨电话咨询 0571-83782130,项目经理手机 17364531293。
环特生物公司已通过国家CNAS、CMA资质认定和AAALAC国际认证,自有2000m²斑马鱼生物评价实验室。
环特生物在斑马鱼技术研发与应用领域,已牵头起草发布团体标准10项,申请发明专利64余项,自主开发的主要斑马鱼模型150多种,发表SCI及核心期刊论文120余篇,已有7个新药项目成功将环特生物斑马鱼实验数据用于CFDA的临床试验申报,公司已累计完成项目超5000个,建立长期合作客户600多家。

【评价原理】
斑马鱼作为一种理想的人类血液毒性模型,是以其造血系统与人类造血系统在进化上高度保守性尾前提的。通过与人类造血类似的信号传导通路,斑马鱼形成了以包括红系、髓系、淋系及巨核系为主的造血系统。斑马鱼可建立多种血液系统毒性模型,主要包括红细胞、白细胞、出凝血障碍性毒性三大类,因此主要与斑马鱼中性粒细胞、巨噬细胞、红细胞和血流量相关。由于斑马鱼具有身体积小、实验周期短等优点,可以用作评估血液毒性的一种便捷模型。
转基因中性粒细胞绿色荧光斑马鱼中性粒细胞自身发出荧光,可以直接在荧光显微镜下观察中性粒细胞个数;黑色素等位基因突变斑马鱼通体透明,经过巨噬细胞染色后可以直接在显微镜下观察巨噬细胞数量;利用邻联茴香胺将斑马鱼心脏红细胞染色,在显微镜下可以直接观察红细胞数量(信号强度)。
【实验方案】
我们将受测试斑马鱼分成两组,分别是正常对照组和供试品组(供试品通过溶解到养鱼用水中的方式摄入到斑马鱼体内)。
处理结束后,(1)通过荧光显微镜观察并统计斑马鱼中性粒细胞数量;(2)通过染色斑马鱼巨噬观察巨噬细胞细胞数量;(3)通过邻联茴香胺染色心脏部位红细胞,在显微镜下观察心脏红细胞染色强度。
【结果展示】

图1.斑马鱼中性粒细胞表型图
(绿色小点为中性粒细胞)
可以看到,供试品组中性粒细胞个数较正常对照组明显减少。
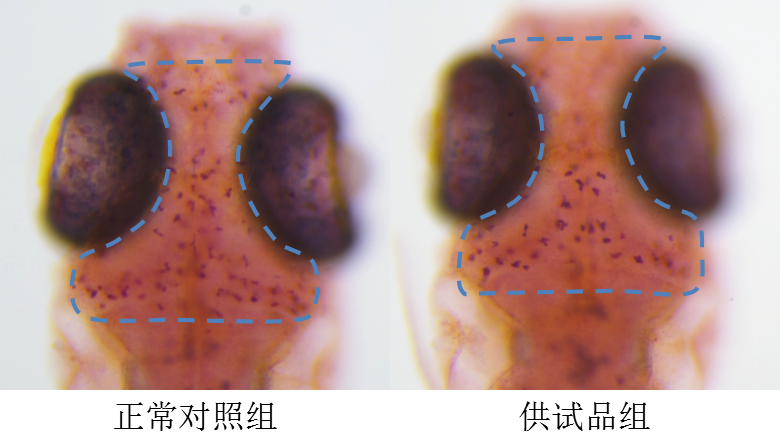
图2.斑马鱼巨噬细胞表型图
(红色小点为巨噬细胞)
可以看到,供试品组巨噬细胞数量较正常对照组明显减少。

图3.斑马鱼红细胞抑制表型图
(蓝色虚线框内为分析区域,分析红细胞染色强度)
可以看到,供试品组心脏红细胞染色强度较正常对照组明显降低。
【评价结论】
1.经过每组30尾斑马鱼的对比实验,供试品组的中性粒细胞数量、巨噬细胞数量明显减少,红细胞染色强度明显降低。
2.本实验证实了此供试品诱发血液毒性。
更多项目服务,请拨电话咨询:0571-83782130,项目经理手机 17364531293(微信同号)
正常组织消化液试剂盒可将正常组织样本温和、快速地消化解离为细胞悬液或细胞团块,可用于后续正常类器官的构建。该组织消化液适用于正常组织标本(如肠、肺、乳腺、子宫内膜等)在体外原代培养的消化解离。

肿瘤组织消化液试剂盒可将肿瘤组织样本温和、快速地消化解离为细胞悬液或细胞团块,可用于后续肿瘤类器官的构建。该组织消化液适用于实体肿瘤(如肠癌、肺癌、乳腺癌、子宫内膜癌等)在体外原代培养的消化解离。

肿瘤组织消化液试剂盒可将肿瘤组织样本温和、快速地消化解离为细胞悬液或细胞团块,可用于后续肿瘤类器官的构建。该组织消化液适用于实体肿瘤(如肠癌、肺癌、乳腺癌、子宫内膜癌等)在体外原代培养的消化解离。