新科医药的LOGO图案整体为鱼的形态,象征着吉祥和自由,同时也是一片七瓣树叶,象征着生命与健康。它表达了企业的崇高使命,那就是不断研发更具临床价值的医药产品和服务,助力人类的生活质量与健康。我们的业务包括新药研发和特殊医学用途配方食品的技术研发和技术转让。秉承“诚信经营、规范管理、安全环保、持续发展”的理念,我们不断完善业务管理流程,优化软硬件配置,强化质量管理体系,为客户提供高性价比的产品和服务。
[更多详情]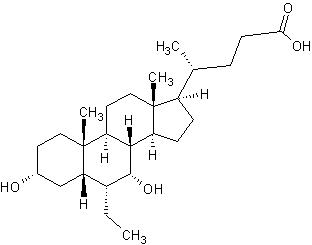
一、项目概况:
1、项目名称:奥贝胆酸(Obeticholic acid)原料药及片剂
2、剂 型:原料药、片剂
3、规 格:10mg、5mg
4、注册分类:化药3+3类
5、原研公司:Intercept,商品名Ocaliva
6、适应症及用法用量:
原发性胆汁性肝硬化,用法用量为每日一次,起始剂量5mg,可视临床反应增加至10mg。
7、国内外批准及上市情况:
2016年5月被美国FDA批准上市。
二、研发进度:
1、原料药合成工艺:
已完成一批公斤级规模工艺放大,结果表明工艺基本可行,产品质量符合要求。
2、制剂工艺:
已完成50000片批量规模工艺,并经多批验证工艺稳定,产品质量符合要求。
3、原研参比制剂剖析:
已采购多批原研公司参比制剂,并对其关键质量指标如杂质谱、溶出度、稳定性等进行的全面研究,并与我公司制备的多批样品进行比对,经评估我公司目前工艺制备的样品与原研制剂具有可比性,符合目前注册申报要求。
三、合作方式:
(1)技术包转让
(2)批件转让
(3)MAH产权合作
一、项目概况:
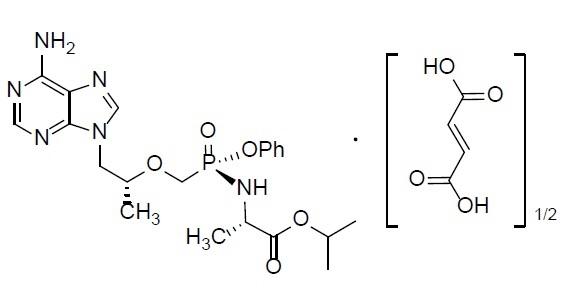
1、项目名称:富马酸替诺福韦艾拉酚胺原料药及片剂
2、剂 型:原料药、片剂
3、规 格:25mg
4、注册分类:化药3+3类
5、原研公司:吉立德
6、适应症及用法用量:
本品是一种核苷酸类逆转录酶抑制剂,用于成人慢性乙肝。每日一次,25mg/次。
7、国内外批准及上市情况:
目前该产品已获包括美国、欧盟、日本等大多数发达国家批准,美国FDA于2016年11月批准,日本于2016年12月批准。原研公司产品已申请进口,目前处于临床研究阶段。
二、研发进度:
1、原料药合成工艺:
已完成公斤级批量规模工艺,并经多批验证工艺稳定,产品质量符合要求,下步将进行公斤级工艺放大研究。
2、制剂工艺:
已完成10000片批量规模工艺,并经多批验证工艺稳定,产品质量符合要求。
3、原研参比制剂剖析:
自制样品与多批原研公司参比制剂的关键质量指标如杂质谱、溶出度等具有可比性,符合目前注册申报要求。
三、合作方式:
1、技术包转让
2、批件转让
3、MAH产权合作
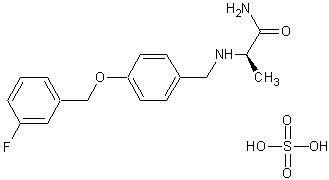
一、项目概况: 1、项目名称:甲磺酸沙芬酰胺(Safinamide methanesulfonate)原料药及片剂 2、剂 型:原料药、片剂 3、规 格:50mg、100mg 4、注册分类:化药3类 5、原研公司:赞邦,商品名Xadago 6、适应症及用法用量: 帕金森综合征,用法用量为每日一次,每次50mg,可以视个体的临床需要增加至100mg。 7、国内外批准及上市情况: 该产品首先于2015年2月被欧盟批准上市,在美国处于NDA审评阶段,原研公司未向中国申请进口。 本产品在国内化合物专利已授权,保护期已于2010年5月届满。 二、研发进度: 1、原料药合成工艺: 已完成一批15公斤规模工艺放大,结果表明工艺基本可行,产品质量符合要求。 2、制剂工艺: 已完成50000片批量规模工艺,并经多批验证工艺稳定,产品质量符合要求。 3、原研参比制剂剖析: 已采购多批原研公司参比制剂,并对其关键质量指标如杂质谱、溶出度、稳定性等进行的全面研究,并与我公司制备的多批样品进行比对,经评估我公司目前工艺制备的样品与原研制剂具有可比性,符合目前注册申报要求。 三、合作方式: (1)技术包转让 (2)批件转让 (3)MAH产权合作
一、项目概况:
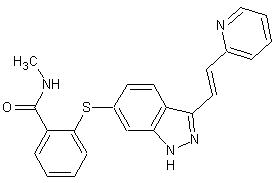
1、项目名称:阿昔替尼(Axitinib)原料药及阿昔替尼片
2、剂 型:原料药、片剂
3、规 格:1mg、5mg
4、注册分类:化药3+4类
6、适应症及用法用量:
既往接受一种酪氨酸激酶抑制剂或细胞因子治疗失败的进展期肾细胞癌的成人患者,用法用量为5mg/天,每日两次。
7、国内外批准及上市情况:
目前该产品已在包括美国、欧盟、日本等大多数发达国家上市,美国FDA于2012年1月批准,欧盟于2012年5月批准,日本于2012年8月批准,适应症为治疗对其它药物没有应答的晚期肾细胞癌。我国与2015年4月进口。
二、研发进度:
1、原料药合成工艺:
已完成公斤级批量规模工艺,并经多批验证工艺稳定,产品质量符合要求,下步将进行公斤级工艺放大研究。
2、制剂工艺:
已完成5000片批量规模工艺,并经多批验证工艺稳定,产品质量符合要求。
3、原研参比制剂剖析:
自制样品与多批原研公司参比制剂的关键质量指标如杂质谱、溶出度等具有可比性,符合目前注册申报要求。
三、合作方式:
1、技术包转让
2、批件转让
3、MAH产权合作

一、项目概况:
1、项目名称:奥贝胆酸(Obeticholic acid)原料药及片剂
2、剂 型:原料药、片剂
3、规 格:10mg、5mg
4、注册分类:化药3+3类
5、原研公司:Intercept,商品名Ocaliva
6、适应症及用法用量:
原发性胆汁性肝硬化,用法用量为每日一次,起始剂量5mg,可视临床反应增加至10mg。
7、国内外批准及上市情况:
2016年5月被美国FDA批准上市。
二、研发进度:
1、原料药合成工艺:
已完成一批公斤级规模工艺放大,结果表明工艺基本可行,产品质量符合要求。
2、制剂工艺:
已完成50000片批量规模工艺,并经多批验证工艺稳定,产品质量符合要求。
3、原研参比制剂剖析:
已采购多批原研公司参比制剂,并对其关键质量指标如杂质谱、溶出度、稳定性等进行的全面研究,并与我公司制备的多批样品进行比对,经评估我公司目前工艺制备的样品与原研制剂具有可比性,符合目前注册申报要求。
三、合作方式:
(1)技术包转让
(2)批件转让
(3)MAH产权合作

一、项目概况:
1、项目名称:富马酸替诺福韦艾拉酚胺原料药及片剂
2、剂 型:原料药、片剂
3、规 格:25mg
4、注册分类:化药3+3类
5、原研公司:吉立德
6、适应症及用法用量:
本品是一种核苷酸类逆转录酶抑制剂,用于成人慢性乙肝。每日一次,25mg/次。
7、国内外批准及上市情况:
目前该产品已获包括美国、欧盟、日本等大多数发达国家批准,美国FDA于2016年11月批准,日本于2016年12月批准。原研公司产品已申请进口,目前处于临床研究阶段。
二、研发进度:
1、原料药合成工艺:
已完成公斤级批量规模工艺,并经多批验证工艺稳定,产品质量符合要求,下步将进行公斤级工艺放大研究。
2、制剂工艺:
已完成10000片批量规模工艺,并经多批验证工艺稳定,产品质量符合要求。
3、原研参比制剂剖析:
自制样品与多批原研公司参比制剂的关键质量指标如杂质谱、溶出度等具有可比性,符合目前注册申报要求。
三、合作方式:
1、技术包转让
2、批件转让
3、MAH产权合作

一、项目概况:
1、项目名称:阿昔替尼(Axitinib)原料药及阿昔替尼片
2、剂 型:原料药、片剂
3、规 格:1mg、5mg
4、注册分类:化药3+4类
6、适应症及用法用量:
既往接受一种酪氨酸激酶抑制剂或细胞因子治疗失败的进展期肾细胞癌的成人患者,用法用量为5mg/天,每日两次。
7、国内外批准及上市情况:
目前该产品已在包括美国、欧盟、日本等大多数发达国家上市,美国FDA于2012年1月批准,欧盟于2012年5月批准,日本于2012年8月批准,适应症为治疗对其它药物没有应答的晚期肾细胞癌。我国与2015年4月进口。
二、研发进度:
1、原料药合成工艺:
已完成公斤级批量规模工艺,并经多批验证工艺稳定,产品质量符合要求,下步将进行公斤级工艺放大研究。
2、制剂工艺:
已完成5000片批量规模工艺,并经多批验证工艺稳定,产品质量符合要求。
3、原研参比制剂剖析:
自制样品与多批原研公司参比制剂的关键质量指标如杂质谱、溶出度等具有可比性,符合目前注册申报要求。
三、合作方式:
1、技术包转让
2、批件转让
3、MAH产权合作

一、项目概况: 1、项目名称:甲磺酸沙芬酰胺(Safinamide methanesulfonate)原料药及片剂 2、剂 型:原料药、片剂 3、规 格:50mg、100mg 4、注册分类:化药3类 5、原研公司:赞邦,商品名Xadago 6、适应症及用法用量: 帕金森综合征,用法用量为每日一次,每次50mg,可以视个体的临床需要增加至100mg。 7、国内外批准及上市情况: 该产品首先于2015年2月被欧盟批准上市,在美国处于NDA审评阶段,原研公司未向中国申请进口。 本产品在国内化合物专利已授权,保护期已于2010年5月届满。 二、研发进度: 1、原料药合成工艺: 已完成一批15公斤规模工艺放大,结果表明工艺基本可行,产品质量符合要求。 2、制剂工艺: 已完成50000片批量规模工艺,并经多批验证工艺稳定,产品质量符合要求。 3、原研参比制剂剖析: 已采购多批原研公司参比制剂,并对其关键质量指标如杂质谱、溶出度、稳定性等进行的全面研究,并与我公司制备的多批样品进行比对,经评估我公司目前工艺制备的样品与原研制剂具有可比性,符合目前注册申报要求。 三、合作方式: (1)技术包转让 (2)批件转让 (3)MAH产权合作