北京爱思益普生物科技股份有限公司2010 年成立,专注于从先导化合物筛选,优化到临床前候选分子阶段基于细胞和生化的药物体外筛选技术和早期药物机理研究,关注肿瘤,免疫,心血管,中枢神经系统等疾病领域的生物学和药理学研究技术,打造创新型CRO+的探索者。爱思益普关注新药研发企业对速度、效率和结果的需求,用专业的技术和高效的沟通帮助客户提高新药研发的效率。爱思益普致力于建立全面的靶点筛选和体外生物学研究平台,建立一系列基于生物学和药理学的研究技术集群,为客户提供涵盖各种靶标和疾病领域的新药研发服务,包括从活性化合物发现,靶标验证,先导化合物优化到临床前候选药物的选择。公司建立了100+离子通道,100+GPCR,800+酶学靶点以及40+核受体筛选细胞系及验证方法,涵盖了大部分成药性靶点,在国内具有领先水平和竞争优势。公司建立了蛋白纯化,生化酶学,肿瘤细胞学,免疫学,电生理学,心脏体外研究,中枢神经系统药理学,药物脱靶效应筛选,药物心脏安全性评价,ADME等平台,全面支持创新药研发的DMTA(设计,合成,测试,分析)一体化服务。爱思益普为国内新药研发机构超过600家以上机构提供服务,得到客户广泛好评。
[更多详情]
肾上腺素受体是目前研究较为清楚的一类G蛋白偶类型受体,目前,已知肾上腺素受体有三类(α1, α2和β)九种亚型(α1A, α1B, α1D, α2A, α2B, α2C, β1, β2和β3)。其中,α1类型受体通过偶联Gq通路,促进Ca2+的产生;α2类型受体通过偶联Gi通路,抑制cAMP的产生;β受体可以偶联Gs通路,促进cAMP的产生。2007年,β2肾上腺素受体是第一个人源G蛋白偶联受体的晶体结构,是G蛋白偶联受体结构解析的重大突破。2011年,β2肾上腺素受体和G蛋白的复合物结构获得解析,该工作获得了2012年诺贝尔化学奖。该受体广泛参与肌肉收缩、外周血液循环及中枢神经系统活动等生理活动。α1受体主要分布于皮肤、黏膜及内脏血管,参与肝糖原代谢、平滑肌收缩及心肌变时变力等;α2受体主要分布于突触前膜,具有调节炎症、抗抑郁的功能。β1受体主要分布于心脏,调节心肌功能与调节血压,与心肌纤维化、心力衰竭、高血压等疾病密切相关。β2受体主要分布于骨骼肌血管、冠状动脉、支气管平滑肌,支气管平滑肌松弛、血管舒张,与支气管哮喘及高血压等有关。β3受体主要分布于棕色和白色脂肪组织,参与了调节糖代谢、脂质代谢、心血管及胃肠道功能等。


北京爱思益普生物科技股份有限公司专注于从靶点发现验证、先导化合物筛选、优化到临床前候选分子阶段的创新药一体化生物学服务平台,覆盖在肿瘤,免疫,心血管,中枢神经系统等疾病领域,整合蛋白科学、酶学、细胞学、体内外药物代谢动力学、药理学等平台,支持创新药物研发项目,支持基础科研与临床转化医学业务

缓激肽是一种血管活性肽,参与炎症、血管舒张以及细胞生长存活过程。在哺乳动物细胞和组织中,缓激肽主要通过两种受体亚型起作用,即缓激肽B1受体(B1R)和缓激肽B2受体(B2R),它们都是跨膜受体,属于视紫红质样G蛋白偶联受体(GPCR)超家族,都可以偶联到G蛋白的Gαq和Gαi家族,导致细胞内Ca2+和磷酸肌醇(PI)释放增加,花生四烯酸释放和NO产生。B1R和B2R在组织中的表达不同,B2R在哺乳动物组织中广泛分布且呈组成型表达,参与血管舒张、渗透调节、平滑肌收缩和痛觉感受器激活。相反,B1R在正常情况下不表达,而是通过组织损伤或炎症介质上调。研究发现,B1R和B2R与炎症性疾病、血管病变、神经病变、肥胖、糖尿病和癌症有关,目前已成为比较重要的治疗靶点。爱思益普团队已开发出B2靶点的相关检测平台,助力新药研发。


北京爱思益普生物科技股份有限公司专注于从靶点发现验证、先导化合物筛选、优化到临床前候选分子阶段的创新药一体化生物学服务平台,覆盖在肿瘤,免疫,心血管,中枢神经系统等疾病领域,整合蛋白科学、酶学、细胞学、体内外药物代谢动力学、药理学等平台,支持创新药物研发项目,支持基础科研与临床转化医学业务

体外药理学分析的主要优势
1,可以在早期阶段识别出脱靶作用,并可以在结构-活性关系(SAR)研究中优化
2,可以预测在体内安全药理学研究,毒理学研究或临床试验中可能遗漏的临床副作 用:例如,与5-羟色胺(5-羟色胺)受体2B(5-HT2B)激动剂引起的瓣膜病
3,可以对包括代谢产物在内的大量化合物进行临床药物不良反应(ADR)相关靶标 的低成本体外测试
4,可以在药物发现的早期阶段对代表性的化学系列进行测试,以寻找最佳先导化合 物和候选药物
5,与体内毒理学研究相比,可以在更短的时间内获得脱靶效应的结果和潜在解释
6,以最少或没有脱靶活性进入研发阶段的化合物,需要进行的体内安全性研究较少, 因此可减少研发延误,减少使用的动物模型并降低成本
功能测定的优势:与功能相关,数据准确性高 • 不论化合物与靶标的任何位置结合,都能够确定最终效应 • 能够区分不同的作用方式(MOA,激动效应,拮抗效应) • 更适合对具有多个结合位点的复杂靶标(例如离子通道) • 能够直接测量激动剂EC50 结合测定 :无法区分功能,阳性结果需要功能验证 • 仅测定在靶标上结合的单个确定的位点 • 无法区分作用方式(即激动剂与拮抗剂或阻断剂) • 对具有多个结合位点(例如离子通道)的复杂靶标需要进行多种测定 • 可能会错过高效,低亲和力的激动剂





我司利用损伤的DNA会激活PARPs酶通过NAD+使核蛋白进行聚腺苷二磷酸核糖基化,从而使组蛋白与DNA分离,通过对底物的生物素标记,检测PARPs的活性,来建立检测体系。
研究内容
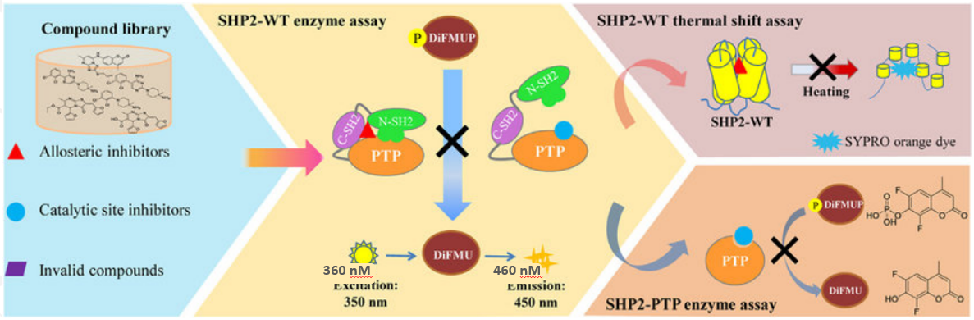
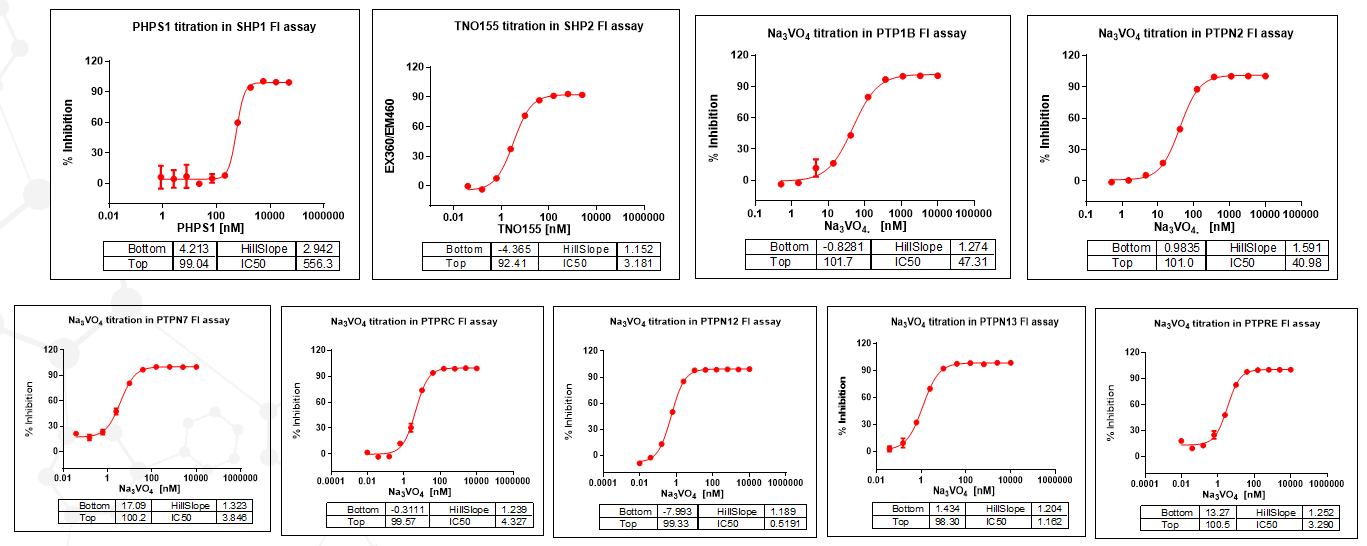
磷酸酶(Protein phosphatases, PPs)是体内存在的一种使蛋白或底物去磷酸化的酶类。蛋白质磷酸酶根据其去磷酸化的特定氨基酸种类,大致分为三类:蛋白质丝氨酸/苏氨酸磷酸酶和蛋白质酪氨酸磷酸酶,还包括双特异性磷酸酶。
磷酸酶在细胞功能调节和信号传导中起着至关重要的作用,参与调控细胞代谢,基因转录,细胞周期和凋亡,细胞骨架重排和细胞运动,以及蛋白质相互作用和蛋白的稳定性等。基于磷酸酶的多种功能,蛋白磷酸酶已经成为疾病治疗药物开发的重要方向,如治疗癌症,炎症,感染,糖尿病,自身免疫病等多种疾病。
在磷酸酶平台构建中,使用DiFMUP作为底物,在磷酸酶的作用下,将磷酸基团水解掉,释放出荧光基团,在360/460处检测荧光值。

γ-氨基丁酸是一种化合物,别名4-氨基丁酸(γ-aminobutyric acid,简称GABA),是一种氨基酸,在人体大脑皮质、海马、丘脑、基底神经节和小脑中起重要作用。据研究发现,GABA是在人脑能量代谢过程中起重要作用的活性氨基酸 ,是脑组织中最重要的神经递质。起作用能促进乙酰胆碱合成、降血氨、抗惊厥、降血压、促进生长激素分泌等多种生理功能。 ICE团队利用液相色谱质联用法对GABA检测进行方法学验证,检测动物模型体内的神经递质含量。对于神经递质检测,与传统的HPLC-ECD检测相比,UPLC-MS或UPLC-MS/MS具有灵敏度高,特异性强,检测时间短的优势。从而为客户提供更全面更细致有关神经递质相关的服务。


北京爱思益普生物科技股份有限公司专注于从靶点发现验证、先导化合物筛选、优化到临床前候选分子阶段的创新药一体化生物学服务平台,覆盖在肿瘤,免疫,心血管,中枢神经系统等疾病领域,整合蛋白科学、酶学、细胞学、体内外药物代谢动力学、药理学等平台,支持创新药物研发项目,支持基础科研与临床转化医学业务。

神经递质是在神经元,肌细胞或感受器间的化学突触中充当信使作用的特殊分子,他们大都是分子量较小的简单分子,是生物学上重要的内源性化学信使,谷氨酸就是其中的一种,谷氨酸属于兴奋性递质与学习,记忆,神经系统发育等某些疾病有关,广泛存在于哺乳动物的中枢神经系统、脑组织和体液中。ICE团队利用液相色谱质联用法对谷氨酸检测进行方法学验证,通过检测动物模型与对照组小鼠体内的神经递质含量,来比较两者含量的差异性,确定谷氨酸的含量变化与某些神经疾病的相关性。


北京爱思益普生物科技股份有限公司专注于从靶点发现验证、先导化合物筛选、优化到临床前候选分子阶段的创新药一体化生物学服务平台,覆盖在肿瘤,免疫,心血管,中枢神经系统等疾病领域,整合蛋白科学、酶学、细胞学、体内外药物代谢动力学、药理学等平台,支持创新药物研发项目,支持基础科研与临床转化医学业务。

在电生理hERG试验中,经常会出现药效减弱的情况。其中一种原因是因为有些药物的稳定性较差,配制完成后静置一段时间就会发生降解而引起了药效变化,不仅导致药效减弱而且会引起药物变质生成有毒物质。影响药物稳定性有很多因素,例如光照,温度,湿度等等都会影响药物的稳定性。所以药物的稳定性对药品的安全性至关重要。
预测药物制剂的有效期,既能减少药物的损耗,也能保障药物的安全有效。我们利用供试品分析考察了某种药物的稳定性,首先配制出三个不同浓度的制剂,仪器分析合格后在室温遮光条件下放置6h后,再次取样检测分析,测得0.30 μM制剂中浓度均值为0.25 μM,准确度偏差为-16.67 %;3.00μM制剂浓度均值为2.57 μM,准确度偏差为-14.22%;30.0 μM 制剂中浓度均值为29.67 μM,准确度偏差为-1.11%;结果表明这种药物低中浓度稳定性均不合格(判定标准为RE%<10%),需现配现用进行试验,供试品分析对药物的稳定性评价,具有至关重要的作用。


北京爱思益普生物科技股份有限公司专注于从靶点发现验证、先导化合物筛选、优化到临床前候选分子阶段的创新药一体化生物学服务平台,覆盖在肿瘤,免疫,心血管,中枢神经系统等疾病领域,整合蛋白科学、酶学、细胞学、体内外药物代谢动力学、药理学等平台,支持创新药物研发项目,支持基础科研与临床转化医学业务。

癫痫是由多种病因导致的脑部神经细胞群高度同步化异常放电所致的慢性脑功能障碍综合症 [1] [2],具有反复性、突发性和暂时性等特点[3]。由于异常放电神经元的位置及波及的范围不同,导致癫痫患者发作形式不同,严重者可表现为突然意识丧失、全身抽搐以及精神异常等[4],往往会给患者的身体带来较大伤害,甚至危及生命,频繁的发作也会给大脑带来较大损害。流行病学资料显示,我国目前约有900万以上癫痫患者,每年新发癫痫患者65~70万,30%左右为难治性癫痫。所以,加强对癫痫疾病的防治和研究,提供抗癫痫药物研发企业完整的早期抗癫痫化合物的筛选一体化服务,针对靶点进一步提高药物研发的临床转化率有着深远意义。
目前抗癫痫药物的作用靶点可分为四大类(图1)[5]:①作用于电压门控离子通道(包括钠、钙和钾通道);②增强GABA受体介导的抑制作用;③抑制谷氨酸受体(NMDA、AMPA)介导的兴奋性;④通过释放机制成分的影响直接调节突触释放(SV2A、电压门控通道α2δ亚基)。通过这些作用机制调控神经元内在兴奋性和抑制性平衡,减少局部神经元同步放电的可能性从而降低癫痫发作的风险。
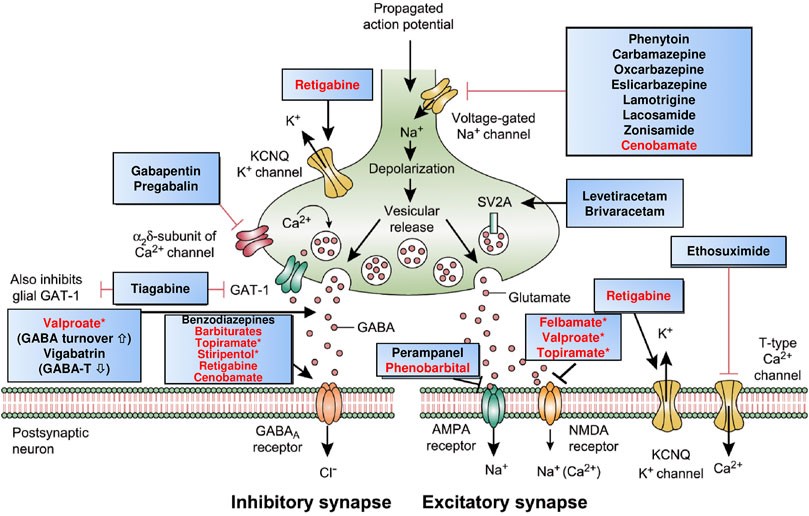
图1. 临床使用的抗癫痫药物作用靶点[5]
癫痫发作的异质性和复杂性、既往药物的应用等,决定了抗癫痫药物的设计与发现中单一靶点成功率低,单一模型成功率低。因此,在预测性和验证性研发抗癫痫药物中,尽量设计多靶点以及不同种属,早期综合性筛选与多种动物模型并用对于判断全部可能治疗潜力是必要的。临床前研究中常使用啮齿动物癫痫模型来评估化合物的抗癫痫效应,常用于筛选药物的动物模型包括:最大电休克(MES)模型、戊四唑(PTZ)诱导的癫痫模型、6 Hz精神运动模型、杏仁核点燃模型。这些模型与人类癫痫发作的关联性如表1所示。

表1 啮齿类癫痫动物模型及其涉及的抗癫痫药机制
爱思益普生物科技公司建立了从靶点选择/验证/筛选、体外模型检测到体内模型评估(动物行为和脑电同步监测)的一整套完整的一体化服务平台,为药物研发企业提供高质量的抗癫痫药物筛选和药效评价服务。
我们以瑞替加滨(钾离子通道开放剂)为例展示从离子通道靶点——体外模型——体内模型药效的一体化检测结果。
图2. 瑞替加滨对KCNQ2/3的激活作用。A.瑞替加滨以浓度依赖性方式激活 KCNQ2/3 通道。B. 增加瑞替加滨的浓度会导致逐渐的超极化转变。C. 浓度效应曲线绘制为标准化的激活电压依赖性的变化,作为瑞替加滨浓度的函数
图3. 瑞替加滨抑制无镁外液诱导的神经元兴奋性。A.原代培养细胞急性无镁条件诱导癫痫模型放电情况,瑞替加滨给药后完全抑制。B.离体脑片急性无镁条件诱导癫痫模型的胞外群峰电位记录,可以记录到典型的癫痫引起的震荡波,瑞替加滨药物处理后完全抑制。
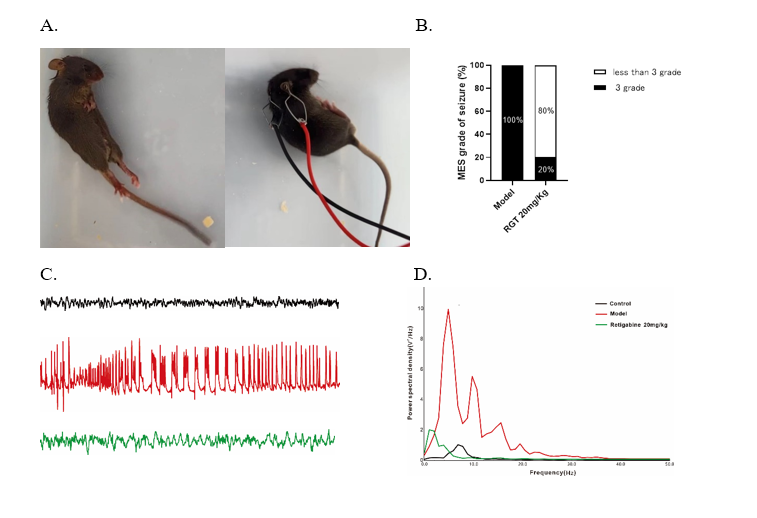
图4. 瑞替加滨抑制MES小鼠的强直痉挛和皮层癫痫样放电。A. MES小鼠的典型行为,溶剂对照组小鼠的后肢出现强直痉挛(左),瑞替加滨给药小鼠后肢未出现强直痉挛(右)。B. 统计图显示瑞替加滨抑制MES小鼠的癫痫样行为。C. 瑞替加滨抑制MES小鼠的皮层癫痫样放电。黑色线条代表正常脑电图(上),红色线条代表MES癫痫发作脑电图(中),绿色线条代表给瑞替加滨给药小鼠的脑电图(下)。D. 瑞替加滨抑制电休克诱导的癫痫样放电功率谱密度值。
参考文献
[1]S. Sanei, J.A. Chambers, EEG Signal Processing, John Wiley & Sons Ltd, Chichester, 2007, 161.
[2] T. Gandhi, B.K. Panigrahi, M. Bhatia, and S. Anand. Expert model for detection of epileptic activity in EEG signature, Expert Systems with Applications, 2010, 37(4):
3513-3520.
[3] E. Niedermeyer, da Silva F. Lopes, Electroencephalography: basic principles, clinical applications, and related fields, 5th Ed. Lippincott Williams & Wilkins, Philadelphia, 2005, 526.
[4] U.K. Misra, J. Kalita, Clinical Electroencephalography, 1st Ed. Elsevier, a division of Reed Elsevier India Private Limited: Noida, 2005, 130.
[5] Löscher W. Single-Target Versus Multi-Target Drugs Versus Combinations of Drugs With Multiple Targets: Preclinical and Clinical Evidence for the Treatment or Prevention of Epilepsy. Front Pharmacol. 2021 Oct 27;12:730257.

肾上腺素受体是目前研究较为清楚的一类G蛋白偶类型受体,目前,已知肾上腺素受体有三类(α1, α2和β)九种亚型(α1A, α1B, α1D, α2A, α2B, α2C, β1, β2和β3)。其中,α1类型受体通过偶联Gq通路,促进Ca2+的产生;α2类型受体通过偶联Gi通路,抑制cAMP的产生;β受体可以偶联Gs通路,促进cAMP的产生。2007年,β2肾上腺素受体是第一个人源G蛋白偶联受体的晶体结构,是G蛋白偶联受体结构解析的重大突破。2011年,β2肾上腺素受体和G蛋白的复合物结构获得解析,该工作获得了2012年诺贝尔化学奖。该受体广泛参与肌肉收缩、外周血液循环及中枢神经系统活动等生理活动。α1受体主要分布于皮肤、黏膜及内脏血管,参与肝糖原代谢、平滑肌收缩及心肌变时变力等;α2受体主要分布于突触前膜,具有调节炎症、抗抑郁的功能。β1受体主要分布于心脏,调节心肌功能与调节血压,与心肌纤维化、心力衰竭、高血压等疾病密切相关。β2受体主要分布于骨骼肌血管、冠状动脉、支气管平滑肌,支气管平滑肌松弛、血管舒张,与支气管哮喘及高血压等有关。β3受体主要分布于棕色和白色脂肪组织,参与了调节糖代谢、脂质代谢、心血管及胃肠道功能等。


北京爱思益普生物科技股份有限公司专注于从靶点发现验证、先导化合物筛选、优化到临床前候选分子阶段的创新药一体化生物学服务平台,覆盖在肿瘤,免疫,心血管,中枢神经系统等疾病领域,整合蛋白科学、酶学、细胞学、体内外药物代谢动力学、药理学等平台,支持创新药物研发项目,支持基础科研与临床转化医学业务