宁波瑞达医药科技有限公司是专业从事EDC开发,为临床研究提供专业服务的CRO公司。瑞达团队从1999年开始在全球知名机构参与全球临床研究数据系统的研发和项目实施,2007年开始在最专业的临床研究数据标准化公司从事CDISC SDTM转化工作。瑞达(Real Data)是中国临床研究电子化的行业先锋和一家能为临床研究提供创新服务的CRO。瑞达有专业的IT和临床研究数据团队;配有高速双线,UPS, VPN, Firewall,环境和头像监控的机房。项目经过全球药企和中国最知名临床研究机构150余个项目验证,具有丰富的BE一致性评价项目经验,被全球五大CRO 之一选为亚太供应商;系统流程获得全球最大的医疗器械公司美国团队认可;多个被CFDA稽查注册项目顺利通过;动态随机系统获得国家科技部项目支持。 自2008年创立以来我们一直把数据的真实和完整性及质量视为企业的生命;通过专业团队的不断创新,推出了完全符合21 CFR Part 11,GCP和行业法规要求的高性价比瑞达系列EDC/CDMS/CTMS/IWRS,IVRS,微信,IPAD离线在线平台和CRC 项目管理系统。为临床研究数据管理、质量控制、项目管理、网上监查、随机化、CDISC标准化和CRC提供现代化的工具和高质量的服务;依托专业团队、高新技术和优化高效流程强化公司在行业内的技术领先地位,把瑞达建设成为最有潜力的专业临床研究服务供应商,为提高临床研究水平和效率作贡献。
[更多详情]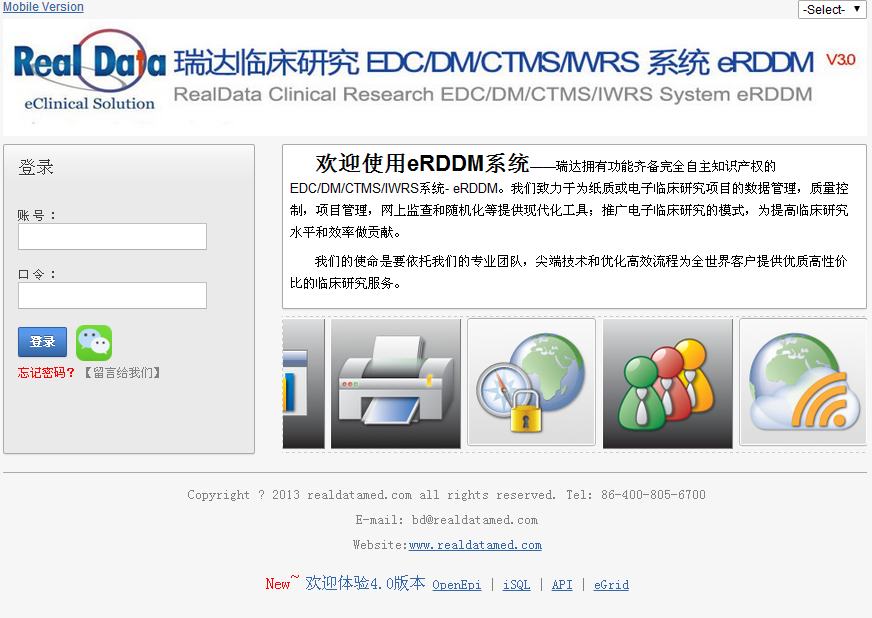

纸张或电子临床研究数据项目系统设置
纸张或电子临床研究数据项目系统运营托管
eRDDM系统实施和培训
定制系统开发和实施

方案设计
样本量计算
随机化和药品重包装
统计分析计划
SAS编程和TLF
生成统计分析报告

CRF设计
数据库设计和建立
数据收集,查看界面的设计和建立
双份录入及比对
电子数据导入
数据逻辑核查编程
不合逻辑的数据管理
质量控制和数据审核
编码及SAE再核对
SDTM的数据转换

研究资料准备
研究中心选择和评估
研究者会议组织
伦理审批资料的准备及递交
受试者招募
试验监查
项目管理
研究药品管理
监查员(CRA)/项目经理(PM)租赁

研究者手册(IB)
撰写临床研究方案撰写
知情同意书(ICF)撰写
病例报告表(CRF)设计
临床研究总结报告撰写(CSR)
发表论文英文编辑和医学文档翻译(中英互译)
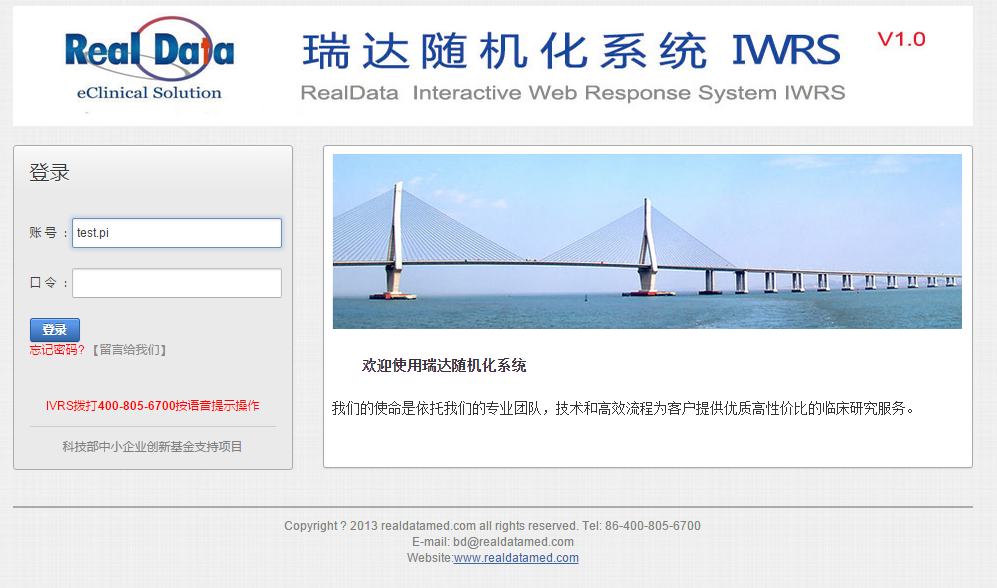

纸张或电子临床研究数据项目系统设置
纸张或电子临床研究数据项目系统运营托管
eRDDM系统实施和培训
定制系统开发和实施

方案设计
样本量计算
随机化和药品重包装
统计分析计划
SAS编程和TLF
生成统计分析报告

CRF设计
数据库设计和建立
数据收集,查看界面的设计和建立
双份录入及比对
电子数据导入
数据逻辑核查编程
不合逻辑的数据管理
质量控制和数据审核
编码及SAE再核对
SDTM的数据转换

研究资料准备
研究中心选择和评估
研究者会议组织
伦理审批资料的准备及递交
受试者招募
试验监查
项目管理
研究药品管理
监查员(CRA)/项目经理(PM)租赁

研究者手册(IB)
撰写临床研究方案撰写
知情同意书(ICF)撰写
病例报告表(CRF)设计
临床研究总结报告撰写(CSR)
发表论文英文编辑和医学文档翻译(中英互译)
IT相关服务
纸张或电子临床研究数据项目系统设置
纸张或电子临床研究数据项目系统运营托管
eRDDM系统实施和培训
定制系统开发和实施
统计分析
方案设计
样本量计算
随机化和药品重包装
统计分析计划
SAS编程和TLF
生成统计分析报告
数据管理
CRF设计
数据库设计和建立
数据收集,查看界面的设计和建立
双份录入及比对
电子数据导入
数据逻辑核查编程
不合逻辑的数据管理
质量控制和数据审核
编码及SAE再核对
SDTM的数据转换
临床试验运营
研究资料准备
研究中心选择和评估
研究者会议组织
伦理审批资料的准备及递交
受试者招募
试验监查
项目管理
研究药品管理
监查员(CRA)/项目经理(PM)租赁
翻译,英文编辑和医学写作
研究者手册(IB)
撰写临床研究方案撰写
知情同意书(ICF)撰写
病例报告表(CRF)设计
临床研究总结报告撰写(CSR)
发表论文英文编辑和医学文档翻译(中英互译)
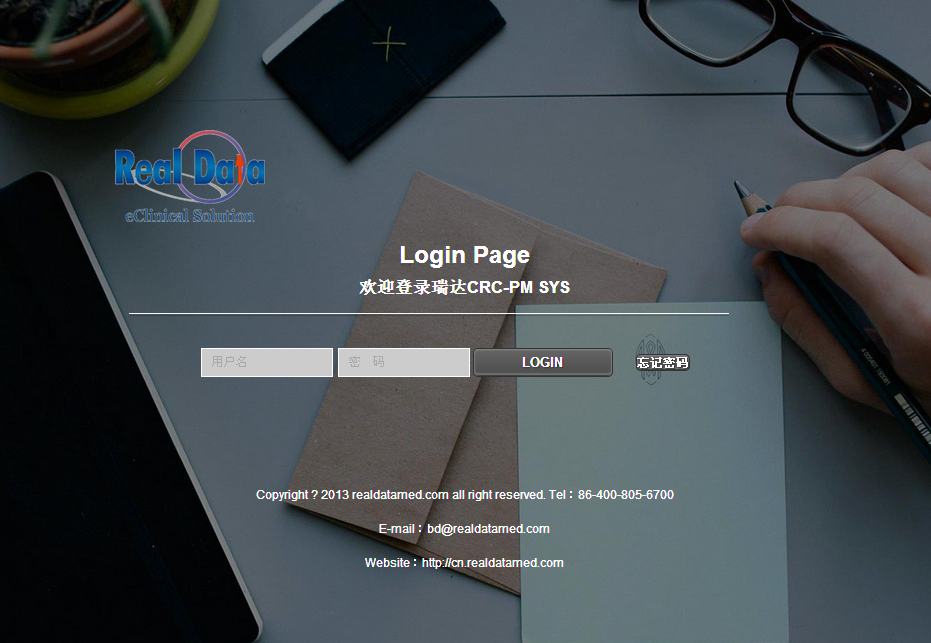

纸张或电子临床研究数据项目系统设置
纸张或电子临床研究数据项目系统运营托管
eRDDM系统实施和培训
定制系统开发和实施

方案设计
样本量计算
随机化和药品重包装
统计分析计划
SAS编程和TLF
生成统计分析报告

CRF设计
数据库设计和建立
数据收集,查看界面的设计和建立
双份录入及比对
电子数据导入
数据逻辑核查编程
不合逻辑的数据管理
质量控制和数据审核
编码及SAE再核对
SDTM的数据转换

研究资料准备
研究中心选择和评估
研究者会议组织
伦理审批资料的准备及递交
受试者招募
试验监查
项目管理
研究药品管理
监查员(CRA)/项目经理(PM)租赁

研究者手册(IB)
撰写临床研究方案撰写
知情同意书(ICF)撰写
病例报告表(CRF)设计
临床研究总结报告撰写(CSR)
发表论文英文编辑和医学文档翻译(中英互译)


纸张或电子临床研究数据项目系统设置
纸张或电子临床研究数据项目系统运营托管
eRDDM系统实施和培训
定制系统开发和实施

方案设计
样本量计算
随机化和药品重包装
统计分析计划
SAS编程和TLF
生成统计分析报告

CRF设计
数据库设计和建立
数据收集,查看界面的设计和建立
双份录入及比对
电子数据导入
数据逻辑核查编程
不合逻辑的数据管理
质量控制和数据审核
编码及SAE再核对
SDTM的数据转换

研究资料准备
研究中心选择和评估
研究者会议组织
伦理审批资料的准备及递交
受试者招募
试验监查
项目管理
研究药品管理
监查员(CRA)/项目经理(PM)租赁

研究者手册(IB)
撰写临床研究方案撰写
知情同意书(ICF)撰写
病例报告表(CRF)设计
临床研究总结报告撰写(CSR)
发表论文英文编辑和医学文档翻译(中英互译)

IT相关服务
纸张或电子临床研究数据项目系统设置
纸张或电子临床研究数据项目系统运营托管
eRDDM系统实施和培训
定制系统开发和实施
统计分析
方案设计
样本量计算
随机化和药品重包装
统计分析计划
SAS编程和TLF
生成统计分析报告
数据管理
CRF设计
数据库设计和建立
数据收集,查看界面的设计和建立
双份录入及比对
电子数据导入
数据逻辑核查编程
不合逻辑的数据管理
质量控制和数据审核
编码及SAE再核对
SDTM的数据转换
临床试验运营
研究资料准备
研究中心选择和评估
研究者会议组织
伦理审批资料的准备及递交
受试者招募
试验监查
项目管理
研究药品管理
监查员(CRA)/项目经理(PM)租赁
翻译,英文编辑和医学写作
研究者手册(IB)
撰写临床研究方案撰写
知情同意书(ICF)撰写
病例报告表(CRF)设计
临床研究总结报告撰写(CSR)
发表论文英文编辑和医学文档翻译(中英互译)


纸张或电子临床研究数据项目系统设置
纸张或电子临床研究数据项目系统运营托管
eRDDM系统实施和培训
定制系统开发和实施

方案设计
样本量计算
随机化和药品重包装
统计分析计划
SAS编程和TLF
生成统计分析报告

CRF设计
数据库设计和建立
数据收集,查看界面的设计和建立
双份录入及比对
电子数据导入
数据逻辑核查编程
不合逻辑的数据管理
质量控制和数据审核
编码及SAE再核对
SDTM的数据转换

研究资料准备
研究中心选择和评估
研究者会议组织
伦理审批资料的准备及递交
受试者招募
试验监查
项目管理
研究药品管理
监查员(CRA)/项目经理(PM)租赁

研究者手册(IB)
撰写临床研究方案撰写
知情同意书(ICF)撰写
病例报告表(CRF)设计
临床研究总结报告撰写(CSR)
发表论文英文编辑和医学文档翻译(中英互译)


纸张或电子临床研究数据项目系统设置
纸张或电子临床研究数据项目系统运营托管
eRDDM系统实施和培训
定制系统开发和实施

方案设计
样本量计算
随机化和药品重包装
统计分析计划
SAS编程和TLF
生成统计分析报告

CRF设计
数据库设计和建立
数据收集,查看界面的设计和建立
双份录入及比对
电子数据导入
数据逻辑核查编程
不合逻辑的数据管理
质量控制和数据审核
编码及SAE再核对
SDTM的数据转换

研究资料准备
研究中心选择和评估
研究者会议组织
伦理审批资料的准备及递交
受试者招募
试验监查
项目管理
研究药品管理
监查员(CRA)/项目经理(PM)租赁

研究者手册(IB)
撰写临床研究方案撰写
知情同意书(ICF)撰写
病例报告表(CRF)设计
临床研究总结报告撰写(CSR)
发表论文英文编辑和医学文档翻译(中英互译)


纸张或电子临床研究数据项目系统设置
纸张或电子临床研究数据项目系统运营托管
eRDDM系统实施和培训
定制系统开发和实施

方案设计
样本量计算
随机化和药品重包装
统计分析计划
SAS编程和TLF
生成统计分析报告

CRF设计
数据库设计和建立
数据收集,查看界面的设计和建立
双份录入及比对
电子数据导入
数据逻辑核查编程
不合逻辑的数据管理
质量控制和数据审核
编码及SAE再核对
SDTM的数据转换

研究资料准备
研究中心选择和评估
研究者会议组织
伦理审批资料的准备及递交
受试者招募
试验监查
项目管理
研究药品管理
监查员(CRA)/项目经理(PM)租赁

研究者手册(IB)
撰写临床研究方案撰写
知情同意书(ICF)撰写
病例报告表(CRF)设计
临床研究总结报告撰写(CSR)
发表论文英文编辑和医学文档翻译(中英互译)


纸张或电子临床研究数据项目系统设置
纸张或电子临床研究数据项目系统运营托管
eRDDM系统实施和培训
定制系统开发和实施

方案设计
样本量计算
随机化和药品重包装
统计分析计划
SAS编程和TLF
生成统计分析报告

CRF设计
数据库设计和建立
数据收集,查看界面的设计和建立
双份录入及比对
电子数据导入
数据逻辑核查编程
不合逻辑的数据管理
质量控制和数据审核
编码及SAE再核对
SDTM的数据转换

研究资料准备
研究中心选择和评估
研究者会议组织
伦理审批资料的准备及递交
受试者招募
试验监查
项目管理
研究药品管理
监查员(CRA)/项目经理(PM)租赁

研究者手册(IB)
撰写临床研究方案撰写
知情同意书(ICF)撰写
病例报告表(CRF)设计
临床研究总结报告撰写(CSR)
发表论文英文编辑和医学文档翻译(中英互译)