
细胞培养技术也叫细胞克隆技术,在生物学中的正规名词为细胞培养技术。细胞培养,既包括微生物细胞的培养,细胞培养技术可以由一个细胞经过大量培养成为简单的单细胞或极少分化的多细胞,这是克隆技术必不可少的环节,而且细胞培养本身就是细胞的克隆。通过细胞培养得到大量的细胞或其代谢产物。因为生物产品都是从细胞得来,所以可以说细胞培养技术是生物技术中最核心、最基础的技术。细胞的生长需要营养环境,用于维持细胞生长的营养基质称为培养基。细胞培养泛指所有体外培养,其含义是指从动物活体体内取出组织,于模拟体内生理环境等特定的体内条件下,进行孵育培养,使之生存并生长。细胞培养工作现已广泛应用于生物学、医学、新药研发等各个领域,成为最重要的基础科学之一。优点1、能长期传代,保持活性,便于监控检测结构功能和生命活动。2、培养条件可以人为的控制便于研究细胞代谢、物理、化学、生物因素的影响3、可用于各种观察和检测手段研究活细胞的变化(变异、分化)。可从细胞水平开展亚细胞结构和代谢分子的表达。4、研究范围和细胞来源广泛,选择性广。5、不同代次细胞可长期保存,既可开展同代次不同条件和方法研究,又可观察不同代次的动态变化。6、耗资少、经济、成本低、可大量培养,利于生物制品的生产。实验热线:19931682702(同微信)

简介:蛋白免疫印迹( Western Blot) 是将电泳分离后的细胞或组织总蛋白质从凝胶转移到固相支持物NC膜或PVDF 膜上,然后用特异性抗体检测某特定抗原的一种蛋白质检测技术,现己广泛应用于基因在蛋白水平的表达研究、抗体活性检测和疾病早期诊断等多个方面。原理:Western Blot法采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。经过PAGE(聚丙烯酰胺凝胶电泳)分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。该技术也广泛应用于检测蛋白水平的表达。Western Blot显色的方法主要有以下几种:i. 放射自显影ii. 底物化学发光ECLiii. 底物荧光ECFiv. 底物DAB呈色现常用的有底物化学发光ECL和底物DAB呈色,体同水平和实验条件的是用第一种方法,发表文章通常是用底物化学发光ECL。只要买现成的试剂盒就行,操作也比较简单,原理如下(二抗用HRP标记):反应底物为过氧化物+鲁米诺,如遇到HRP,即发光,可使胶片曝光,就可洗出条带。实验热线:19931682702(同微信)
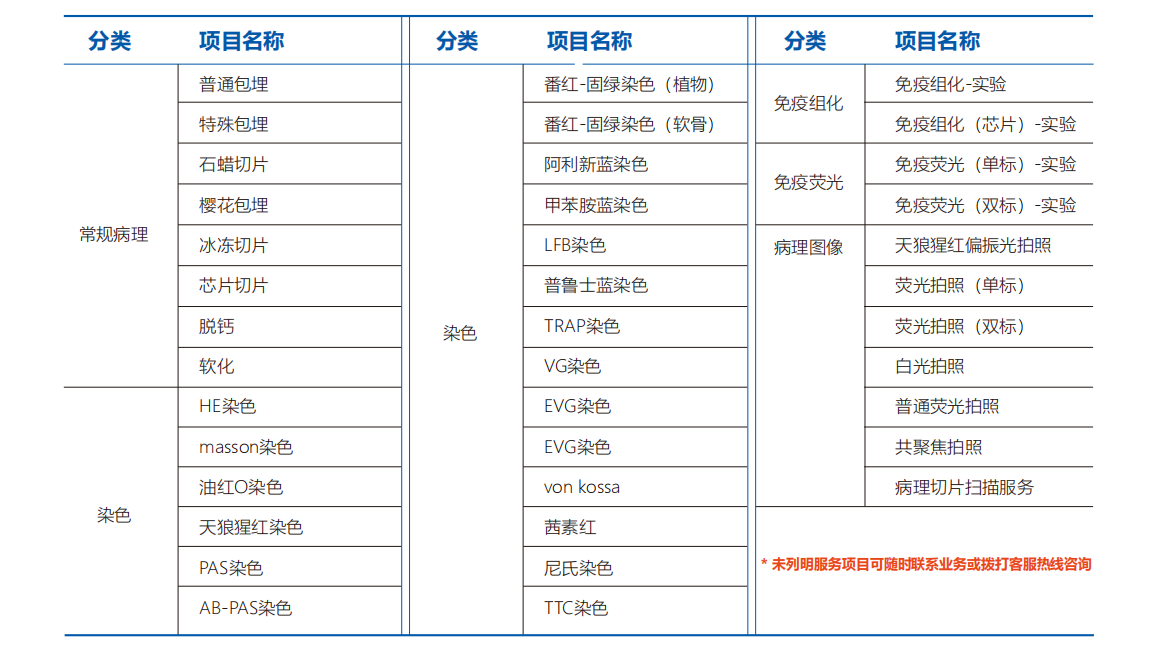
一.固定、脱水、包埋取组织放入4%多聚甲醛里面固定3-4小时,时间根据标本大小适当调整。取适当大小组织放入包埋盒中,进行脱水。每个染缸液体体积约200ml,每次脱水可以装20个包埋盒。依次进入:75%酒精1.5小时、95%酒精1.5小时、95%酒精1小时、无水乙醇1.5小时、无水乙醇1小时、二甲苯一号0.5小时、二甲苯二号0.5小时。打开包埋机,分别开启冷台,冷点,石蜡槽,组织槽进行工作。然后用铁饭盒承装石蜡块并放入包埋机组织槽中加热溶解。将脱水后的组织连同包埋盒依次放入机器组织槽中,然后再放入石蜡饭盒一号进行第二遍浸蜡,然后石蜡饭盒二号,进行三次浸蜡。选大小符合的模具,先调整机器滴蜡的速度,不宜过快防止有气泡。然后在模具中滴入液体石蜡,然后从饭盒二号中拿出浸后的包埋盒,打开用镊子取出组织放入模具中。然后用包埋盒的另一半盖住模具,再滴入少许石蜡后放到冷台上冷却。按上述步骤继续包埋下一个蜡块。二.切片、制片打开切片机,固定蜡块(可提前4度冰箱预冷一下),调整刀片和蜡块的距离。然后调整切片厚度,先粗切,看到完整的蜡片并且有组织后切换厚度,调整到自己想要切的厚度。用力均匀,右手摇动切片,左手用毛笔接片。如片子打卷,可以用毛笔按着蜡片的边缘再缓慢切,这样可以得到相对平整的片子。用毛笔和镊子将片子或者带状片子托起,放入水槽中展片,水温在40度左右。然后用防脱片载玻片轻轻捞起,载玻片的边缘尽量不要触碰水槽底部,防止底部气泡上浮残留在片子上。然后标注切片编号放到烤片机上烤片30分钟。三.组织化学染色室温脱蜡、水化:二甲苯一号10分钟、二甲苯二号8分钟、二甲苯三号8分钟、无水乙醇5分钟、90%乙醇3分钟、80%乙醇3分钟、70%乙醇3分钟。蒸馏水3分钟*3次,PBS3分钟*3次。热抗原修复,换新的切片架,放入水化后的切片。配置抗原修复液(一包柠檬酸钠粉末配置2升PBS溶液),用铁饭盒或者锅加热煮沸。温度控制在96-98度。然后将切片放入热锅中15分钟,最后自然冷却室温。PBS五分钟*2次,蒸馏水3分钟*2次。免疫组化笔画圈:取出组织,甩干水分,可用吸水纸吸干水珠。用组化笔画圈围住组织,圆圈完整。灭活内源酶活性:将切片放入湿盒中,盒中加入少量蒸馏水,滴加3%过氧化氢(二抗试剂盒中A一滴或者50微升,剂量详见二抗说明书),室温孵育10分钟。PBS三分钟*3次,蒸馏水水洗三分钟。封闭非特异性位点:甩干水分,吸干水珠,加山羊血清封闭液(二抗试剂盒B一滴或者50微升),放入湿盒内,室温10分钟。甩掉封闭液,滴加一抗盖住组织,然后放入湿盒内4摄氏度过夜。(一抗浓度见抗体说明书,提前稀释后分装,并在负二十度冰箱保存。每张片子一抗剂量不定,看组织面积大小,xxxxx癌组织一张20微升左右。第二天,4度冰箱取出湿盒,室温复温30分钟,PBS三分钟*三次,蒸馏水洗涤三分钟。甩干水分,吸干水珠,滴加二抗(二抗试剂盒C)一滴或者50微升,室温孵育10分钟。PBS三分钟*三次,蒸馏水水洗三分钟。每张片子滴加一滴或者50微升链霉菌抗生物素-过氧化物酶溶液(二抗试剂盒D),室温孵育10分钟,PBS三分钟*三次,蒸馏水水洗三分钟。每张片子滴加两滴或者100微升DAB溶液,显微镜下观察3-10分钟。染色合适即可终止染色,自来水冲洗。苏木素复染,1-2分钟,细胞核变蓝色即可终止,自来水或者PBS冲洗反蓝(可用0.5%氨水反蓝)。1%盐酸酒精分化3秒,自来水冲洗三分钟。脱水:70%酒精1分钟、80%酒精1分钟、95%酒精2分钟、无水乙醇4分钟、二甲苯一号3分钟、二甲苯二号3分钟。凉干片子后滴加适量中性树胶封片,盖上盖玻片,小心气泡。晾干半天即可。显微镜/全景扫描下拍照实验热线:19931682702(同微信)

模型制作方法 新西兰白兔,体重2-2.5kg,雌雄兼用。参照图开胸冠状动脉左室支结扎/开放为心肌缺血再灌注模型的分法予以改进。实验前禁食12小时,耳缘静脉麻醉,将其仰卧固定预实验台上。沿颈部正中剪开,实施气管插管。沿胸骨左缘逐层切开胸壁软组织,剪断2-4肋骨,扩开切口,暴露心脏,剪开心包膜,用自制拉钩将心包膜对称、均匀牵拉并固定,在冠状动脉左室支离主动脉根部约8-10mm处,用眼科圆形弯针穿1根2-0丝线以备结扎。观察45min以上,使血液动力学各项指标稳定,收紧结扎线是动脉左室支缺血40min,然后放松结扎线,在灌注120min。观察160min.观测指标与分析1、心肌中INOS反转录PCR测定;2、心肌iNOS蛋白表达水平的检测;3、心肌细胞中iNOSmRNA原位杂交观察。实验专线:19931682702(同微信)
脑胶质瘤模型制作:1、常规术前大鼠禁食禁水,腹腔注射麻醉后(10%水合氯醛按300mg/kg),将大鼠取俯卧位固定于脑立体定向仪(江湾Ⅱ型)上。2、剪去头顶部眼裂至外耳道之间的毛发,常规消毒铺敷后,于右顶叶处(矢状缝旁开3mm,冠状缝前1mm)用直径1mm的牙科钻小心钻穿颅骨,以20μl微量进样器抽取配好的细胞悬液10μl,缓慢垂直颅骨板进针6mm,回退1mm,缓慢(约2μl/min)注入4μl细胞悬液。3、留针5min后缓慢拔针。用骨蜡封闭骨孔,生理盐水冲洗术野,缝合头皮,常规饲养。

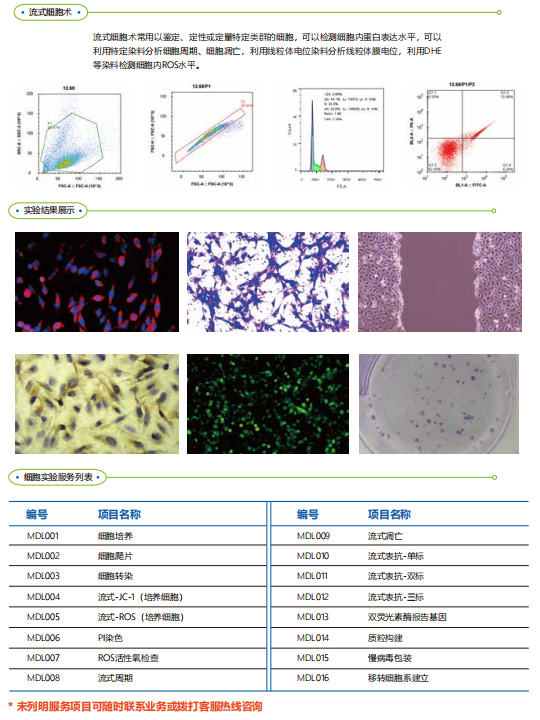
细胞划痕愈合法是测定细胞迁移运动与愈合能力的方法,类似体外伤口愈合模型,在体外培养皿或平板培养的单层贴壁细胞上,用微量枪头或其它硬物在细胞生长的中央区域划线,去除中央部分的细胞,然后继续培养细胞至实验设定的时间,取出细胞培养板,观察周边细胞是否生长(修复)至中央划痕区,以此判断细胞的生长迁移及修复能力。特点: 1. 在一定程度上模拟了体内细胞迁移的过程。2. 非常适合研究细胞与胞外基质(ECM),细胞与细胞之间相互作用引起的细胞 迁移。3. 与包括活细胞成像在内的显微镜系统兼容,可用于分析细胞间的相互作用。4. 研究细胞迁移的体外实验中最简单的方法。传统实验方法 实验步骤: 1. 培养板接种细胞之前先用marker笔在12孔板背面画横线标记(方便拍照时定位同一 个视野)。2. 细胞消化后接入12孔板,数量以贴壁后铺满板底为宜(数量少时可培养一段时间至铺满板底)。3. 细胞铺满板底后,用1 ml枪头垂直于孔板制造细胞划痕,尽量保证各个划痕宽度一致。(人工枪头制造划痕难以保证划痕宽度的一致性,影响实验结果,这也是该方法最大的缺陷。)4. 吸去细胞培养液,用PBS冲洗孔板三次,洗去划痕产生的细胞碎片。 5. 加入无血清培养基,拍照记录。6. 将培养板放入培养箱培养,每隔4-6小时取出拍照。7. 根据收集图片数据分析实验结果。
研究某个基因的功能最常用的手段是在宿主细胞中过量表达或者通过RNA干扰的方法knock-down该基因,常规手段有瞬时转染和筛选稳定细胞系。筛选出该基因的过表达或者RNA干扰的稳定细胞系会给您的实验带来极大的便利。有了稳定细胞系,后期的Co-IP或者Pull-Down实验会非常便利;稳定表达重组荧光蛋白的细胞系可以让您动态的观察分子在细胞中的运动。 构建稳定细胞系的基本原理是将外源DNA克隆到具有某种抗性的载体上,载体被转染到宿主细胞并整合到宿主染色体中,用载体中所含的抗性标志进行筛选。最常用的真核表达载体的抗性筛选标志物有新霉素(neomycin)、潮霉素(hygromycin)和嘌呤霉素(puromycin),常用G418来代替新霉素进行选择性筛选,筛选得到可稳定表达目的蛋白,或者稳定表达沉默特定基因的细胞株。筛选稳定细胞系的方法1)转染质粒后,单克隆方法筛选稳定细胞系2)慢病毒感染筛选稳定细胞系慢病毒感染方法较质粒转染筛选单克隆方法更方便和高效,是目前主流的稳定细胞系筛选方法。慢病毒几乎可以感染所有种类的细胞,并且在感染后可以整合到受感染细胞的基因组,进行长时间的稳定表达,因此,慢病毒常用于制备稳定表达/沉默特定基因的单克隆细胞株。实验专线:19931682702

模型制作方法:SD大鼠,7日龄,体重12-16g,雌雄兼用。模型组动物麻醉,结扎左侧颈总动脉,缝合切口,放回原饲养环境中回复2小时,置动物于2000ml密闭容器中,通入含有8%氧气的混合气体,流量为3l/min。2小时后恢复正常供氧。制成左侧大脑半球缺氧动物模型。观测指标与分析:(1)脑组织病理学检查;(2)脑组织细胞凋亡检测;(3)脑组织缺氧诱导因子(HIF)-1amRNA表达水平检测;(4)脑组织半胱天冬酶表达水平的检测;(5)脑组织碱性成纤维细胞生长因子mRNA表达的检测;(6)脑神经干细胞的检测;(7)脑组织胶原纤维酸性蛋白检测;(8)脑组织c-fos基因表达水平;(9)学习、记忆功能检查;(10)脑组织单胺类神经递质含量测定;(11)脑组织MDA和SOD水平测定;(12)脑纹状体组织Par-4蛋白表达水平检测;(13)脑组织钙离子含量测定;(14)热休克蛋白70表达水平检测;(15)脑组织白介素-1β含量测定;(16)脑组织一氧化氮含量测定。实验专线:19931682702(同微信)
将动物机体的各种组织从机体中取出,采用酶消化、机械法等途径使其分散成单细胞,并置于合适的培养基中培养。细胞得以存活、生长、繁殖。原代细胞相比较细胞系更能反应机体原有的特性,用于科学研究时更具有针对性和说服力。原代动物细胞分离培养包括上皮来源(表皮、乳腺上皮、子宫颈上皮、肝、胃上皮、胰腺、肾小管上皮、气管及支气管上皮、前列腺、口腔上皮、内皮等)细胞分离培养。结缔组织来源(成纤维、巨噬、脂肪组织、软骨、骨、破骨、血液等)细胞分离培养。神经组织来源及肌肉组织来源(骨骼肌、肌肉)细胞分离培养。实验热线:19931682702(同微信)
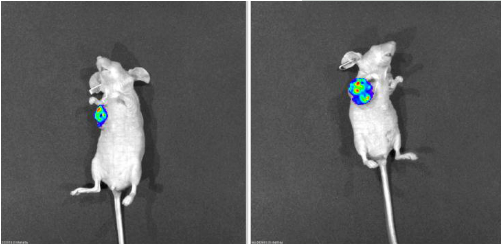
细胞株移植瘤模型(cell derived xenograft, CDX),即将体外传代培养的肿瘤细胞接种至免疫缺陷小鼠,也就是我们平时所说的裸鼠成瘤。裸鼠成瘤实验,即在裸鼠皮下注入肿瘤细胞,观察肿瘤的形成、发展及抗肿瘤药物的效果。动物选择一般选择4-6周龄Nude裸鼠,需要提前到SPF环境中适应1周。接种部位与接种细胞量接种部位常为皮下,静脉或原位;细胞量一般是5*106个/200ul,但是不同的细胞系的接种量略有差别。成瘤时间皮下接种的细胞一般会在1-2周成瘤,一般不会超过1个月;尾静脉和腹腔接种的细胞一般也是1周左右,需要密切观察动物的体重与状态进行判断。为什么肿瘤不长?如果细胞接种后超过预期的观察时间仍未成瘤,需要从以下方面进行排查原因:一是细胞活力,细胞活力是影响肿瘤形成的重要原因,活力不够不能成瘤,因此细胞消化下来PBS清洗后要尽快接种;二是动物选择,选择的裸鼠周龄不宜过大,否则也会增大成瘤难度(如果还未成瘤建议更换缺陷程度更高的Nod-scid小鼠,NOG小鼠);三是饲养环境,环境影响动物状态,状态差的鼠容易发生死亡,不易成瘤。为什么瘤子长起来又消失?很可能开始我们观察到的肿瘤是炎症反应,到后来肿瘤细胞被小鼠自身吸收,需要继续观察肿瘤细胞吸收之后是否还能长出来,长不出来建议分析上述原因重新实验。需要观察什么?在肿瘤长出后,需要密切观察动物的状态,体重和瘤体积。瘤体积的测量一般采用公式V=ab2/2进行计算。动物体重的增加活着减少量,直接反应着动物的整体状态,评估肿瘤是否出现转移等。如何判断肿瘤是否出现了转移?小动物活体成像。如果接种的肿瘤细胞带有荧光标签或者荧光素酶,可以借助小动物活体成像仪进行观察瘤细胞的大小和转移情况。小动物核磁。小动物核磁技术可以更明细的观察到肿瘤细胞在肝脏,肺脏或者其他器官的转移情况。实验热线:19931682702(同微信)

模型制作方法: SD大鼠,7日龄,体重11-17g。新生大鼠清醒局部麻醉状态下,行右侧颈总动脉结扎术,再将动物置于恒温密闭玻璃容器中,通以8%O2+92%N2的混合气体,2h后取出,造成幼鼠窒息脑瘫模型。 观察指标与分析: 症状观察; 头部血流量测定; 脑组织水含量测定; 脑组织中NO含量测定; 脑组织中丙二醛含量测定。实验专线:19931682702(同微信)

6-OHDA损毁MFB造成的大鼠PD模型有两个明显的弊端:一是神经元急性死亡。6-OHDA注入后15分钟即可检测到DA含量的下降,在第30-60分钟时更加明显,3-5天内绝大多数神经元死亡。二是损伤严重。经APO诱发旋转7圈/分以上者,黑质内多巴胺能神经元的死亡率已经超过90%。可见这种模型对于研究多巴胺能神经元慢性进行性病变的全过程不甚理想。但由此得到启发,人们发现机械损伤MFB同样可以造成黑质内的多巴胺能神经元变性坏死,并且这种变化呈现慢性、进行性过程。已经建立的造模方法有MFB轴突切断术(medial forebrain bundle axotomy)和中脑半切术(hemitransection of midbrain)。(一)大鼠MFB切断术: 1.操作步骤 Wistar大鼠,雌性,体重185-210g。常规注射水合氯醛麻醉后,置于Kopf立体定位仪上固定。切开皮肤,暴露颅骨前囟。选择部位在前囟后3.8mm,中线旁开2.4mm处打孔。将Kopf公司(Kopf Instruments,Tuyunga,CA,USA)生产的可伸缩电线刀(retractable wire knife)垂直伸入孔内达颅骨平面下8mm处,固定外套管,将电线刀的刀刃由外套管中推出2.0-3.0mm。上提电线刀约2.5mm,然后下放回原处。再重复一次,以保证MFB充分切断。然后回收刀刃,退出电线刀。缝合皮肤(Lapchak PA等,1993)。2.模型检测(1)旋转行为学检测:术后4周,将大鼠腹腔内注射AMPH(5mg/kg)诱发大鼠旋转。计数90分钟内的旋转次数。(2)其它检测:病理和生化检测与6-OHDA损毁模型同。(二)中脑半切术(hemitransection of midbrain)1.操作步骤SD大鼠,雌雄不限,体重200-250g。常规方法麻醉,立体定位仪上固定和暴露颅骨前后囟。在前囟后1mm,中线旁开0.5mm处打孔。将以特制的4mm宽的刀,沿与颅骨成68度角的方向,斜插入9mm,然后将刀退出。缝合皮肤。(Toffano G等,1984)2.模型检测(3)旋转行为学检测:术后8周,皮下注射APO(0.25mg/kg),诱发大鼠向健侧旋转。(4)其它检测:病理和生化检测与6-OHDA损毁模型相似。实验专线:19931682702(同微信)

肽链的设计多肽是复杂的大分子,每条序列在物理和化学特性上都是独特的,研究人员设计多肽时应考虑到合成,纯化以及溶解等过程中的难度,从而能够使用该多肽达到自己的实验目的。以下是设计过程中的一些建议:如何降低肽链合成的难度1、减少序列长度2、减少疏水性残基数3、减少困难残基如何增强肽链的可溶性1、改变N端或C端2、缩短或加长序列3、加入可溶性残基4、通过置换一个或多个残基改变序列5、通过选用不同框架来改变序列多肽保存1、冻干多肽可在-20度保存或室温保存 2、溶液肽远比冻干形式不稳定,溶液应为中性PH(5-7)-20度保存。 3、为避免样品的反复冻融,最好分成小样存放。多肽的溶解大多数多肽的首选溶剂是超纯抽气水,稀乙酸或氨水分别对碱性或酸性多肽的溶解也有帮助。如果这些方法用过后还不溶解的多肽,建议用DMF,脲,guanidiniam,chloride,acetonitnle来溶解。多肽的用途主要用于抗体的制备,多肽疫苗,多肽微注射剂对基因结构与功能关系的研究。本公司提供不同纯度的多肽,多粗提产物到98%的医药级别,客户可根据需求进行选择。>80% :免疫学应用,多克隆抗体制备>90%:SAR研究,生物测定>95%:NMR,结晶化,体外生物测定>98%:NMR,结晶化,敏感的生物测定实验热线:19931682702(同微信)

模型制作方法:SD大鼠,7日龄,体重11-17g。新生大鼠清醒局部麻醉状态下,行右侧颈总动脉结扎术,再将动物置于恒温密闭玻璃容器中,通以8%O2+92%N2的混合气体,2h后取出,造成幼鼠窒息脑瘫模型。观察指标与分析:症状观察;头部血流量测定;脑组织水含量测定;脑组织中NO含量测定;脑组织中丙二醛含量测定。实验热线:19931682702