
随着生活水平的提高以及医疗技术的不断发展,人类预期寿命在逐步延长,这导致全球老年人口的空前增长,与此同时,与年龄相关的疾病负担也呈指数级增长[1]。有研究指出,在健康状况没有得到改善的情况下单纯延长寿命,是没有意义的[2]。基于此,世界卫生组织在2015年提出了《老龄化与健康全球战略和行动计划》,旨在实现健康老龄化的目标[3]。为了实现这一目标,需要对生物体、器官和细胞水平的衰老及疾病过程有透彻的了解,并针对衰老相关的分子途径开发预防和治疗衰老相关疾病的策略[4]。我国65岁以上人口占总人口比重及预测[5]大多数自发肿瘤、代谢性疾病以及神经退行性疾病的发病率和流行率随年龄增长而增加,其主要原因可以归咎于老年人免疫系统失调。免疫系统可以抵御病原体和杀伤癌细胞。老年人的免疫系统老化,使得免疫反应性急剧下降并且功能失调,这一现象被称为免疫衰老。研究表明,免疫治疗干预在幼小动物身上可能是有效的,但同样的治疗方法在老年动物身上却并不一定有效。考虑到大多数的癌症患者是老年人,癌症的发病率随着老龄化而增加,因此理解免疫系统失调对于免疫治疗的影响,可以更好的干预老年人的癌症治疗进程。为了最优地激发老年人的抗肿瘤免疫反应,需要识别和了解老年人免疫系统的内在缺陷,并使用自身耐受和衰老同时存在的相关模型。[6]小鼠凭借其易于饲养和处理并且寿命较短(~2.5年)的特性,成为衰老及其相关疾病研究中有吸引力的哺乳动物模式生物。[7]百奥动物提供优质老龄鼠(目前最大可提供15月龄,即60周龄的小鼠,陆续可提供最大20-22月龄小鼠),可用于衰老及其相关疾病的研究。可提供品系如下:老龄鼠百奥动物老龄鼠优势① 不同周龄小鼠现货提供;② 高标准的饲养环境;③ 非生产退役种鼠;④ 严格的遗传稳定性监测。C57BL/6J老龄鼠C57BL/6J是使用最为广泛的近交品系之一,也是第一个完成基因组测序,特征分析最全面的小鼠品系。有研究人员对C57BL/6J的生存曲线进行分析,并提供了可比较的对应的人类年龄。衰老是个连续的动态过程,大多数研究将生命阶段简单的分为成年、中年和老年。小鼠月龄和人类年龄对照关系及特点① 小鼠的3-6月龄对应成年人(20-30岁);发育完成尚未受到衰老影响。② 小鼠的10-15月龄对应中年人(38-47岁);可以检测到部分衰老生物标志物(非全部)的衰老变化。③ 小鼠的18-24月龄对应老年人(56-69岁);可以检测到几乎全部衰老标志物的衰老变化[8]。老龄鼠常见表型及病理随着小鼠生长发育,外观会逐渐改变。一些常见的衰老表型有:眼周脱毛、嘴鼻部被理毛、背侧产生脱毛区及灰毛区等。C57BL/6J老龄鼠的部分正常衰老表型[9]同时随着年龄增长,与年龄相关的各项疾病也随之而来,产生一些和疾病相关的表型。例如:自发肿瘤、眼周病变、皮炎脱毛等。非近亲繁殖小鼠长期研究(2年或更长时间)的常见疾病[10]a、Findings from multiple studies are summarized for each line or group. and original terminology.b、4-way crossc、(Af _ C57BL/6)F1d、UM HET3 from (BALB/cByJ _ C57BL/6J)F1 _ (C3H/HeJ _ DBA/2J)F1 老龄鼠应用研究① 健康生命周期的基础生物学研究② 骨质、肌肉、身体组成相关研究③ 饮食、运动、认知与行为研究④ 心血管、内分泌、代谢等疾病研究⑤ 免疫学、肿瘤学、神经退行性疾病研究⑥ 年龄相关的视力、听力障碍研究百奥动物自主研发人源化小鼠模型、疾病模型、老龄鼠等上千种小鼠模型,欢迎来电咨询~参考文献:[1] Olshansky, S.J. From Lifespan to Healthspan. Jama 320, 1323-1324 (2018).[2] Rivera-Tavarez, C.E. Can We Increase Our Health Span? Physical medicine and rehabilitation clinics of North America 28, 681-692 (2017).[3] Beard, J.R. et al. The World report on ageing and health: a policy framework for healthy ageing. Lancet (London, England) 387, 2145-2154 (2016). [4] Barzilai, N., Cuervo, A.M. & Austad, S. Aging as a Biological Target for Prevention and Therapy. Jama 320, 1321-1322 (2018).[5]http://news.youth.cn/jsxw/202103/t20210310_12758403.htm[6] J. Lustgarten.Cancer, aging and immunotherapy: lessons learned from animal models.Cancer Immunol Immunother 58:1979–1989(2009) .[7] Mitchell, S.J., Scheibye-Knudsen, M., Longo, D.L. & de Cabo, R. Animal models of aging research: implications for human aging and age-related diseases. Annual review of animal biosciences 3, 283-303 (2015). [8] Flurkey, K., M. Currer, J. & Harrison, D.E. Chapter 20 - Mouse Models in Aging Research. In: Fox, J.G. et al. (eds). The Mouse in Biomedical Research (Second Edition). Academic Press: Burlington pp 637-672(2007).[9] https:// e. dxy. cn/ broadcast/ live/ id/ 22788/ ? source= wechat& sim= 1& sim_ token= jo3ALEk4m RZ9tfoghOHA rih1tV 6kp0IQvMAdhr7vws7ey9YqHi8uJxdmTk9vElaf[10] C. F. Brayton, P. M. Treuting, and J. M. Ward.Pathobiology of Aging Mice and GEM: Background Strains and Experimental Design.Veterinary Pathology 49(1) 85-105(2012).
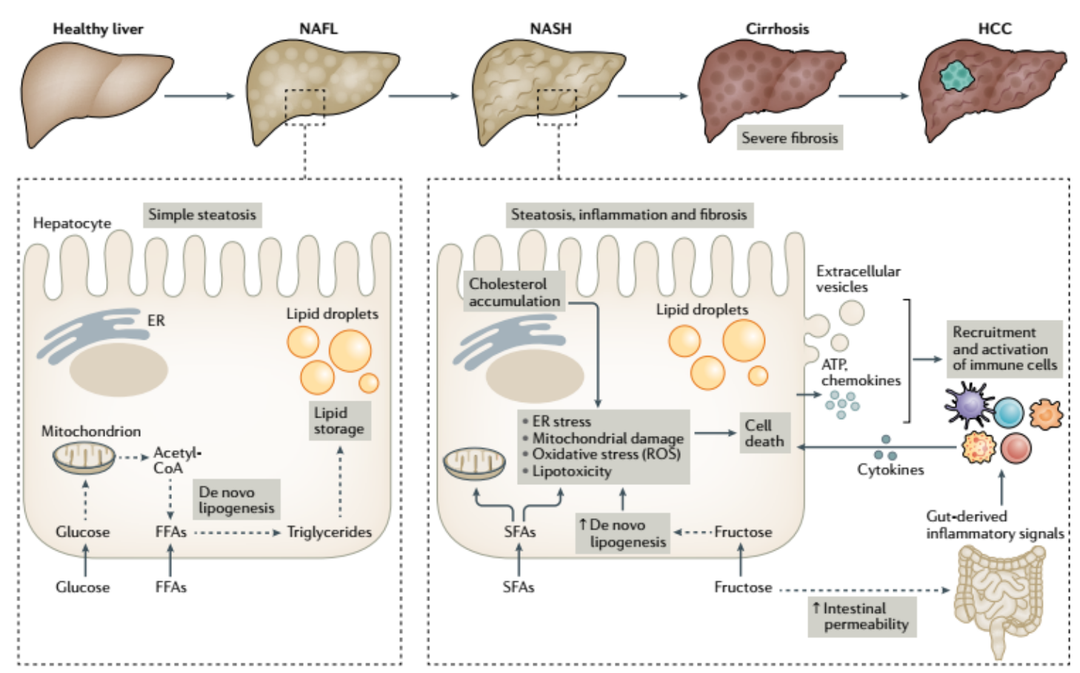
乙型(HBV)、丙型(HCV)肝炎病毒和非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD),是引起肝硬化(cirrhosis)和肝癌(hepatocellular carcinoma, HCC)的主要驱动因素。近些年,广泛的HBV疫苗接种和针对HBC、HCV的高效抗病毒治疗手段的开发使得乙肝和丙肝有所好转。但世界范围内,肥胖症和2型糖尿病越来越流行,使得NAFLD及其进展性疾病非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)的患病率成比例上升,并逐步取代病毒性肝炎,成为全球肝硬化和肝癌的发病率和死亡率上升的主要驱动因素。流行病学显示,NAFLD在一般人群中的患病率约为25%,全球NASH患病率则在1.5%-6.5%之间[1]。NASH好发于中年男性,特别是超重肥胖或患有2型糖尿病的个体。同时NASH患者常常并发肥胖、糖尿病和心血管疾病等。因为这种疾病症状雷同于酒精性脂肪肝炎,但患者无酗酒史,故将其命名为非酒精性脂肪性肝炎(NASH)。从病理角度,NASH最早起源于肝细胞中增加的脂肪合成,机体摄入的葡萄糖和游离脂肪酸是脂肪合成的原料。脂肪过载的肝细胞容易出现应激反应(stress),包括内质网应激、线粒体受损、氧化应激(活性氧ROS的产生)和脂毒性等,出现肝细胞损伤和炎症反应,进一步有可能恶化成肝硬化甚至是肝癌(图1)。图1. NAFLD演变成NASH的过程以及NASH的病理特征[2]对应的,治疗NASH的方法主要是抗脂肪化(减脂减重),抗炎和抗纤维化[3]。可以联合应用作用机制不同的药物进行治疗。目前用于NASH治疗的药物主要包括[4]:❶ 法尼酯X受体(FXR)激动剂,如奥贝胆酸(Obeticholic acid , OCA)(Intercept公司), Tropifexor和 Cilofexor;❷ 成纤维细胞生长因子(FGF)变体:Efruxifermin, Aalafermin;❸过氧化物酶体增殖物激活受体(PPAR)激动剂:Elafibranor, Lanifibranor;成纤维细胞生长因子(FGF)变体:Efruxifermin, Aalafermin;❹ 胰高血糖素样肽-1(GLP-1)激动剂:Semaglutide;❺ C-C基序趋化因子受体(CCR2/5)抑制剂:Cenicriviroc(CVC)等。尽管关于NASH发病机制的研究已取得了大量进展,但在关键3期临床研究中,奥贝胆酸是唯一一种具有显著疗效的药物。至今仍没有欧美药监局获批的NASH治疗药物。通过改变饮食、增强锻炼甚至是手术来减肥仍然是改善NASH的主要方式。未来十年,NAFLD治疗领域仍需深耕。对疾病机制的深入研究、评估新药药效等都离不开疾病动物模型。目前NASH疾病动物模型主要可以分为3类:饮食诱导、化学诱导和基因编辑动物模型。在这三种方法的基础上,也可以进行组合应用。今天,我们就来着重介绍百奥动物已经建立的3种NASH疾病模型。NASH小鼠模型西方饮食(western diet, WD)诱导的NASH小鼠模型用西方饮食饲料,也就是高糖、高脂,高胆固醇配方的饲料诱导小鼠造模,可以看到明显的体重增加,血糖的升高,糖耐受能力的受损,以及肝脏转氨酶的升高,和血脂的升高。图2. 西方饮食诱导的NASH小鼠模型。(A) NASH模型建立:喂养标准饮食(standard diet, STD)或WD(含有21%的脂肪,50%的碳水化合物和1.5%的胆固醇)给8周龄C57BL/6雄性小鼠共22周;与STD相比,WD组小鼠(B)体重升高;(C)饥饿血糖升高;(D, E)葡萄糖耐受受损;(F)肝重上升;(G)肝重体重比;(H)血清谷丙转氨酶(ALT)水平升高;(I)血胆固醇升高;(J)肝脂肪变H&E染色示例;(K)NAS(NAFLD acticity score)评分升高。Data are means ±SEM; n=8-9 mice/group. *P <0.05, **P <0.01, ***P <0.001.高脂肪蛋氨酸胆碱缺乏饮食(high fat methionine-choline deficient diet, HFMCD)诱导的NASH小鼠模型HFMCD成分中含有60 kcal%脂肪,蛋氨酸、胆碱缺乏,该饮食诱导的NASH模型显示出肝损伤、肝脂肪变性和纤维化增加,伴随NAS评分增加。图3. HFMCD诱导的NASH模型。(A) NASH模型建立:喂养标准饮食(standard diet, STD)或HFMCD给8周龄C57BL/6雄性小鼠共4-6周;与STD相比,HFMCD组小鼠(B)体重无显著差异;(C, D)肝重和肝重体重比上升;(E, F)谷丙转氨酶(ALT)和谷草转氨酶(AST)水平升高;(G)肝脂肪变和炎症H&E染色示例及(H)NAS(NAFLD acticity score)评分升高;(I)肝纤维化天狼星红染色示例及(J)统计分析。*P <0.05, ***P <0.001, ****P <0.0001.药效学研究表明,雷公藤红素(celastrol)可以减轻HFMCD引发的NASH。图4. 雷公藤红素(celastrol)可以减轻MCD引发的NASH。(A)H&E染色示例雷公藤红素处理后肝脂肪变和炎症减少;(B)ALT,AST,NAS评分在雷公藤红素治疗后均有好转。四氯化碳(CCl4)诱导的NASH小鼠模型四氯化碳(CCl4)注射诱导模型,引起明显的肝脏炎症和纤维化。图5. CCl4诱导的NASH小鼠模型。(A) NASH模型建立:8周龄的雄性C57BL/6小鼠腹腔注射CCl4,浓度分别为:0.25、0.5和0.75 mL/kg,每周2次。分别诱导4周、6周和8周后进行血生化及组织学染色分析。(B)体重;(C, D)肝重和肝重体重比。图6. 对CCl4诱导的NASH小鼠模型的肝损伤相关表型分析。图7. H&E染色示例CCl4诱导后肝炎症增加。Scale bar: 50 um.图8. 天狼星红染色及其统计分析表明CCl4诱导后肝纤维化加重。图9. 天狼星红染色及其统计分析表明奥贝胆酸(Obeticholic acid , OCA)治疗后肝纤维化减轻。综上所述,三种NASH小鼠模型的特征总结如下NASH疾病模型的检测指标百奥动物能够提供的关于NASH疾病模型的检测指标包括更多信息,请访问百奥动物官网或扫描下方二维码。参考资料:[1] 诺和诺德医学资讯:https://mp.weixin.qq.com/s/bj9u_NSQOUWNgCYEi2qTsg[2] Huby, T., Gautier, E.L. Immune cell-mediated features of non-alcoholic steatohepatitis. Nat Rev Immunol (2021). https://doi.org/10.1038/s41577-021-00639-3[3] Dufour J, Caussy C, Loomba R. Combination therapy for non-alcoholic steatohepatitis: rationale, opportunities and challenges. Gut 2020; 69:1877-1884.[4] 药明康德:首款NASH疗法再度延后,患者何时才能迎来第一缕曙光?http://www.ii77.com/yangsheng/292978.html百奥动物立足全球生物医药行业,从技术创新出发,百奥赛图建立“BioMice百奥动物”子品牌。百奥动物集创新动物模型研发制备、生产供应和实验服务为一体,拥有2500余个独特基因编辑动物/细胞系模型,覆盖肿瘤,自免,代谢等多个疾病领域,包括重度免疫缺陷B-NDG及系列小鼠、靶点人源化小鼠和全人抗体RenMice三大系列产品,结合优质的药理药效评价服务,以高标准的3大动物中心为支撑,极大的满足了全球科学研究和药物开发需求。创新的动物模型、高标准的质量管理、多元化的服务平台,助推生物医药创新产业的快速发展。

随着人口老龄化的加深,中枢神经系统退行性疾病已变成现代社会严重的医学问题。目前,大量研究表明多种中枢神经系统(CNS)疾病,例如帕金森病、阿尔兹海默症、脑肿瘤和多发性硬化等疾病的发生、发展与治疗,都与血脑屏障(blood brain barrier, BBB)关系密切。 如今,虽然抗体类药物凭借其靶向的高度特异性已经在多种疾病的治疗中获得成功,但在CNS相关疾病的治疗中却遇到了瓶颈,实现跨血脑屏障进行药物递送成为一重大挑战。如何在维持血脑屏障结构功能完整性的前提下提高药物递送效率,改善相关疾病的治疗,是今后研究CNS相关疾病的重要方向。血脑屏障的结构与功能1913年,Goldman 直接将染料注射进了动物的蛛网膜下腔,得到了脑组织着色,其他部分不着色的结果,此结果在1900年 Lewandowsky 正式提出了血脑屏障这一概念的基础上进一步证实了其存在。血脑屏障(BBB)是一种大脑血管、细胞以及其它组成大脑组织之间的保护性屏障,主要由周细胞、脑毛细管内皮细胞、基膜、星形胶质细胞足突和脑血管内皮细胞间的紧密连接组成,能为大脑提供一种防御机制来抵御血液中的外来病原体和毒素等(图1)。BBB通过严格控制特定营养物质,以及限制有害异生物质分子的通过,来维持CNS 稳态;但另一方面在开发CNS生物药时,由于BBB的存在,导致生物药在大脑中的含量仅相当于血浆的 0.01-0.1%,为实现跨血脑屏障进行药物递送带来了巨大的难度。图1. 血脑屏障示意图[1]脑部药物递送手段--受体介导的胞吞作用(RMT)大脑中生物药物递送技术包括侵入式和非侵入式技术,利用非侵入式技术跨BBB主要是利用内源性胞吞的过程,例如吸附介导的胞吞作用, 载体介导的胞吞作用(CMT)和受体介导的胞吞作用(RMT)(图2)。在这些过程中,RMT 已成为BBB递送研究最广泛的过程。图2. 穿越BBB的生物转运机制[1]为了通过RMT过程达到最优的治疗药物递送效率,靶受体蛋白应在脑血管的内皮细胞中高表达,同时在外周血管中最低限度表达。遵循这一思路,过去几十年大多数研究都集中于已知在血脑屏障细胞上高表达的靶点,例如转铁蛋白受体(TFR),胰岛素受体(IGF1R),CD98重链(CD98HC)等,针对这些靶点正在进行的药物临床试验(图3)将表明基于RMT的技术是否可安全有效地将治疗相关药物剂量递送至CNS,同时将外周和/或脱靶毒性作用降至最低。 图3. 部分基于RMT进行的临床研究[1]转铁蛋白受体(TFR1)转铁蛋白(TF)结合铁是通过与其受体,即 Transferrin Receptor 1(TFR1)相互作用而实现的。TF 与 Fe3+相互作用形成全铁 -TF,并与 TFR1 受体结合,在细胞内吞作用下进入核内体。在偏酸性核内体的环境中,Fe3+ 与Tf分离,同时STEAP3将 Fe3+ 还原为 Fe2+ ,并被二价金属离子转运蛋白1(DMT1)转运到细胞质中,然后释放了Fe3+ 的TF与TFR1组成 TF/TFR1 复合物,通过胞吐作用回游到细胞表面。在细胞表面,转铁蛋白(TF)与受体TFR1分离,成为脱铁 -TF,然后再与Fe3+重新结合参与铁循环。整个过程完成后TF和TFR1被循环利用,进入细胞摄取铁的下一个周期中。图4. 转铁蛋白循环机制[2]转铁蛋白受体(TFR1)是用于基于RMT的大脑递送方法中研究最广泛的靶蛋白,TFR1在血脑屏障上高表达,识别携带铁的转铁蛋白将其转运到细胞内,从而介导铁的脑内转运。多项研究证明能够使用转铁蛋白或者 TFR1为靶点来转运药物到脑内,并在动物模型中得到验证。针对TFR1靶点机制研究和新药开发的需求,BioMice 百奥动物自主研发的 B-hTFR1 mice 是评估蛋白治疗药物对CNS的有效递送的优质临床前实验动物模型。B-hTFR1 mice 验证数据红细胞蛋白表达分析流式细胞术分析纯合B-hTFR1小鼠中TFR1表达采集野生型小鼠和纯合 B-hTFR1小鼠的骨髓,采用种特异性抗TFR1抗体进行流式分析。小鼠TFR1在野生型小鼠中检测到。人TFR1仅在纯合B-hTFR1小鼠中检测到,而在野生型小鼠中检测不到。TFR1抗体的体内PK评价抗人TFR1双特异性抗体(BsAbs)的体内药代动力学(PK)评价如图所示,抗人TFR1 BsAbs在剂量后表现出更高的血清清除率和增强的脑暴露。研究结果证实,B-hTFR1小鼠的大脑能够摄取静脉注射的抗人TFR1 BsAbs。平均值±SEM。 溶质载体转运蛋白 -CD98 重链(CD98HC)溶质载体转运蛋白:CD98HC在小鼠大脑毛细血管和微血管中高度富集,并且位于脑内皮细胞的管腔和离腔表面。最近使用能够识别CD98HC和 β‑分泌酶 1(BACE1)的双特异性抗体进行的一项研究表明,将这些抗体静脉注射到小鼠体内可实现药物的大脑递送,并伴随着Aβ产生显着减少。CD98HC/BACE1双特异性抗体在大脑递送中的效率比TfR/BACE1双特异性抗体高 80‑90%,表明靶向CD98HC可能更有效[3]。针对CD98HC靶点,BioMice 百奥动物自主研发的B-hCD98HC mice助力CNS相关疾病的临床前药物评价。B-hCD98HC mice 验证数据蛋白表达分析流式细胞术分析 B-hCD98HC 纯合小鼠 CD98 的表达取野生型小鼠和纯合 B-hCD98HC小鼠脾细胞,用种特异性抗CD98抗体进行流式细胞术分析。野生型小鼠中检测到小鼠CD98。人CD98在 B-hCD98HC纯合小鼠中检测到,而在野生型小鼠中未检出。胰岛素样生长因子 1 受体(IGF1R)胰岛素样生长因子 1 受体(IGF1R)在大脑和脑血管中表达。因此,不干扰IGF1结合的抗体与IGF1R的结合可能是在BBB中提供生物治疗剂的一种有前景的策略。在最近的一项研究中,产生了针对IGF1R且远离IGF1结合位点的结构域的新型骆驼单域抗体(VhHs),体外模型中显示与非靶向VhH相比,大鼠的脑和脑脊液暴露量更高。BioMice 百奥动物针对IGF1R靶点机制研究自主研发的B-hIGF1R mice,是评估蛋白治疗药物对CNS的有效递送的优质临床前实验动物模型。除以上部分受体介导的胞吞作用外,越来越多的技术已经开始被用于探索增强生物类药物递送到脑部,如外泌体技术,基于腺相关病毒(AAV)的基因递送技术等。随着研究的深入,打破血脑屏障,攻克脑部药物递送的难题指日可待!参考资料:[1]Terstappen, G.C., Meyer, A.H., Bell, R.D. et al. Strategies for delivering therapeutics across the blood–brain barrier. Nat Rev Drug Discov 20, 362–383 (2021). https://doi.org/10.1038/s41573-021-00139-y[2] Li H , Sun H , Qian Z . The role of the transferrin-transferrin-receptor system in drug delivery and targeting.[J]. Trends in Pharmacological ences, 2002, 23(5):206-209.[3] https://mp.weixin.qq.com/s/5AW3VfVa_xQzHeAVDVPU7A百奥动物立足全球生物医药行业,从技术创新出发,百奥赛图建立“BioMice百奥动物”子品牌。百奥动物集创新动物模型研发制备、生产供应和实验服务为一体,拥有2500余个独特基因编辑动物/细胞系模型,覆盖肿瘤,自免,代谢等多个疾病领域,包括重度免疫缺陷B-NDG及系列小鼠、靶点人源化小鼠和全人抗体RenMice三大系列产品,结合优质的药理药效评价服务,以高标准的3大动物中心为支撑,极大的满足了全球科学研究和药物开发需求。创新的动物模型、高标准的质量管理、多元化的服务平台,助推生物医药创新产业的快速发展。

自然杀伤(NK)细胞源于骨髓造血干细胞,主要分布于骨髓、外周血、肝、脾、肺和淋巴结。属于先天免疫系统的核心细胞,它们在免疫监视中扮演着非常重要的角色,随着对NK细胞的分子特征和功能的进一步探索,开发以NK细胞为基础的靶向免疫治疗可能引发肿瘤免疫治疗的新突破。图1. NK细胞在癌症中的作用机制[1]虽然近年来基于T细胞免疫检查点,如PD-1/PD-L1和CTLA-4在临床抗肿瘤取得了较大的进展,但免疫治疗并不能对所有患者起到良好效果,目前的很多研究也表明T细胞免疫疗法具有一定的局限性。NK细胞作为重要的天然免疫细胞之一,表达多种激活受体,包括CD16、NKG2D、SLAM家族成员和自然细胞毒性受体NKp30、NKp44和NKp46。NK细胞不需预先致敏就可以杀伤靶细胞,在抗肿瘤、抗病毒感染和免疫调节等方面具有重要作用,是抗癌效果良好的一种免疫细胞。因此目前基于NK细胞的肿瘤免疫疗法逐渐受到关注,如通过单克隆抗体靶向NK细胞免疫检查点治疗。针对NK细胞免疫检查点机制研究和新药开发的需求,BioMice 百奥动物自主研发了相关的实验动物模型。NK细胞免疫检查点01、NKp46NKp46自然细胞毒性激动型受体(NCR)家族中的一员,NCR受体家族的另外两个成员是NKp30和NKp44,与其他两个成员只表达在人NK细胞上不同,NKp46同时表达在人和小鼠的NK细胞上。NKp46主要表达在NK细胞上,也表达在一些亚型T细胞和ILCs上。NKp46配体和信号机制目前还不清楚,目前在研疗法有10项,有抗体药物和细胞疗法,抗体药物有单抗,双抗及多抗,开发机构有大学和Innate Pharma等企业。据文献报道,NK细胞衔接器可同时靶向肿瘤抗原,NKp46和CD16的多功能抗体。目前的药物都处于早期生物测试研发阶段和临床前阶段。图2. 多功能NK细胞衔接器[2]B-hNKP46 mice基本信息:蛋白表达分析:图3. 流式细胞术分析 B-hNKp46纯合小鼠NKp46的表达通过流式细胞术分析野生型C57BL/6和B-hNKp46纯合小鼠中NKP46的特异性表达。收集野生型C57BL/6和纯合B-hNKP46小鼠的脾细胞,结果显示:用属种特异性NKP46抗体进行流式细胞术分析。在野生型C57BL/6小鼠细胞表面检测到mNKP46,在B-hNKP46纯合小鼠的NK细胞表面检测到hNKP46。02、NKG2ANKG2家族是NK细胞上的一类重要受体,包括NKG2A,NKG2B,NKG2C,NKG2D,NKG2E,NKG2F,NKG2H等成员。NKG2A是NKG2家族中的抑制性成员,NKG2A主要表达在NK细胞表面和部分T细胞(CD8+T细胞、Th2细胞以及NKT细胞)。NKG2A可与CD94形成异源二聚体,与其配体结合后,激活细胞内的抑制性信号通路,抑制NK细胞活性,从而使肿瘤避免被NK细胞杀伤。因此NKG2A抗体可以阻断这一抑制信号,释放NK细胞,起到抗肿瘤的作用。HLA-E是NKG2A的天然配体。HLA-E广泛在所有组织细胞中表达,但表达水平较低,而其在癌细胞中被上调。研究发现, 多种肿瘤细胞高表达HLA-E, 且肿瘤浸润处的NK和CD8+T细胞高表达NKG2A[3], 使肿瘤细胞逃避NK和CD8+T细胞的免疫识别。图4. 肿瘤细胞表面高表达HLA-E进行免疫逃逸[4]B-hNKG2A mice基本信息:NK细胞蛋白表达分析:图5. 流式细胞术分析B-hNKG2A杂合小鼠NKG2A的表达通过流式细胞术分析野生型C57BL/6和B-hNKG2A杂合小鼠中NKG2A蛋白的表达。收集野生型C57BL/6和B-hNKG2A杂合小鼠的脾细胞,用种属特异性抗NKG2A抗体进行流式细胞术分析。结果显示:在C57BL/6小鼠和B-hNKG2A杂合鼠的NK细胞表面检测到mNKG2A,在B-hNKG2A杂合鼠的NK细胞表面检测到hNKG2A。(其中,用来检测human NKG2A的抗体是内部制备的monalizumab)除了NKG2A单人源化小鼠,我们还开发了CD94/NKG2A双人源化小鼠,成为验证CD94/NKG2A靶点药物的有力工具。B-hCD94/hNKG2A mice基本信息:体内药效: 图6.B-hCD94/hNKG2A小鼠药效验证抗人NKG2A抗体Monalizumab(来源合作方)联合PD-L1抗体Tecentriq(来源合作方)在B-hCD94/hNKG2A小鼠中的抗肿瘤药效。(A)纯合B-hCD94/hNKG2A小鼠 (雌性,6-7周龄,n=6) 皮下接种小鼠结肠癌MC38细胞系。当肿瘤体积达到约100 mm3时,将小鼠分组,分组后给与抗人NKG2A和PD-L1抗体进行治疗,结果显示抗人NKG2A和PD-L1抗体能够显著抑制MC38肿瘤细胞的生长。(B) 治疗期间体重变化。如A图所示,抗人NKG2A抗体和PD-L1抗体在B-hCD94/hNKG2A小鼠体内能够有效控制肿瘤生长,表明B-hCD94/hNKG2A小鼠为PD-L1和NKG2A抗体联合治疗的体内评价提供了一个强大的临床前模型。03NKG2DNKG2D为活化性受体,在NK细胞活化过程中起着非常重要的作用。人NKG2D主要表达于NK细胞、CD8+T细胞、γδT细胞以及一些自体反应的CD4+T细胞,发挥着清除损伤、病原体感染等细胞的生理功能,在抗肿瘤免疫应答过程中也发挥着重要作用。NKG2D不与CD94结合,其配体在人类是MICA、MICB和ULBP1,鼠中为Rae-1、H60和MULT1。正常情况下,这些配体表达在细胞表面,与NKG2D结合后可促进其下游的激活通路。这些配体在正常细胞中受到严格调节,而在肿瘤细胞等受损细胞上高表达,与NKG2D结合后直接活化或作为共刺激分子激活效应细胞,发挥免疫监视作用。图7. NKG2D受体及其配体[5]B-hNKG2D mice基本信息:NK细胞蛋白表达分析:图8. 流式细胞术分析B-hNKG2D纯合小鼠NKG2D的表达通过流式细胞术分析野生型C57BL/6和B-hNKG2D纯合小鼠中NKG2D蛋白的表达。收集野生型C57BL/6和纯合B-hNKG2D小鼠的脾细胞,用种属特异性抗NKG2D抗体进行流式细胞术分析。结果显示,在C57BL/6小鼠NK细胞表面检测到mNKG2D。在B-hNKG2D纯合小鼠的NK细胞表面检测到hNKG2D。04、CD16ACD16A主要表达在NK细胞、巨噬细胞和单核细胞表面,胞内有两条免疫受体酪氨酸激活基序(ITAM),和抗原抗体复合物结合后,激活下游信号,从而促进抗体介导的细胞毒性(ADCC)。NK细胞不需要特异性的抗原刺激就可以发挥ADCC作用。在没有共刺激信号的情况下,未致敏的人NK细胞只能通过CD16A触发细胞毒活性[6]。CD16A的在研药物主要是针对肿瘤抗原的抗体药物,通过Fc改造提高对CD16A的亲和力或针对CD16A的双特异性抗体。B-hCD16A mice基本信息:NK细胞蛋白表达分析:图9. 流式细胞术分析B-hCD16A纯合小鼠CD16A的表达用流式细胞术分析野生型C57BL/6小鼠和纯合B-hCD16A小鼠中CD16A的表达。收集野生型C57BL/6小鼠和纯合B-hCD16A小鼠的脾细胞。结果显示,人的CD16A只能在纯合B-hCD16A小鼠的NK细胞中只能检测到,野生型C57BL/6小鼠中未检测到。图10. 流式细胞术分析B-hCD16A纯合小鼠PBMC水平用流式细胞术分析结果显示,人源化小鼠NK细胞hCD16A表达水平与人PBMC相似。以及我们还开发了CB-17 SCID背景的人源化小鼠。B-hCD16A(CB-17SCID) mice基本信息:NK细胞蛋白表达分析:图11. 流式细胞术分析B-hFCGR3A(CB-17 SCID)纯合小鼠FCGR3A的表达用流式细胞术分析野生型CB-17 SCID小鼠和纯合B-hFCGR3A(CB-17 SCID)小鼠中FCGR3A的表达。收集野生型CB-17 SCID小鼠和纯合B-hFCGR3A(CB-17 SCID)小鼠的脾细胞。结果显示,人的FCGR3A只能在纯合B-hFCGR3A小鼠的NK细胞中只能检测到,野生型CB-17 SCID小鼠中未检测到。展望NK细胞因为有着不受MHC限制的细胞毒性、可以产生细胞因子和免疫记忆等功能,从而具有独特的抗肿瘤效应,使其成为先天性和适应性免疫反应系统中的关键角色。T细胞免疫检查点疗法已经在临床肿瘤治疗上,显示出巨大临床转化潜力,相信随着NK细胞免疫检查点这支“潜力股”疗法的加入,未来肿瘤免疫疗法的适用范围可以得到更好的拓展。参考文献[1]Feixue Wang, Jennie Ka Ching Lau & Jun Yu. The role of natural killer cell in gastrointestinal cancer: killer or helper.Cell. 2021;40:717–730.[2]Laurent Gauthier, Ariane Morel, Nadia Anceriz. Multifunctional Natural Killer Cell Engagers Targeting NKp46 Trigger Protective Tumor Immunity. Cell. 2019;177(7):1701-1713.[3] Algarra I , A García-Lora, Cabrera T , et al. The selection of tumor variants with altered expression of classical and nonclassical MHC class I molecules: implications for tumor immune escape.[J]. Cancer Immunology Immunotherapy, 2004, 53(10):904-910.[4]Montfoort N V , Borst L , Korrer M J , et al. NKG2A Blockade Potentiates CD8T Cell Immunity Induced by Cancer Vaccines - ScienceDirect[J]. Cell, 2018.[5]Mercedes, B . F., Carolina, I . D., Norberto, W . Z. Leveraging NKG2D Ligands in Immuno-Oncology.Immunol., 29 July 2021[6] Bryceson, Y . T.,March, M . E.,Ljunggren, H . G. & Long, E. O. Synergy among receptors on resting NK cells for the activation of natural cytotoxicity and cytokine secretion. Blood 107, 159-166, doi:10.1182/blood-2005-0401351(2006).
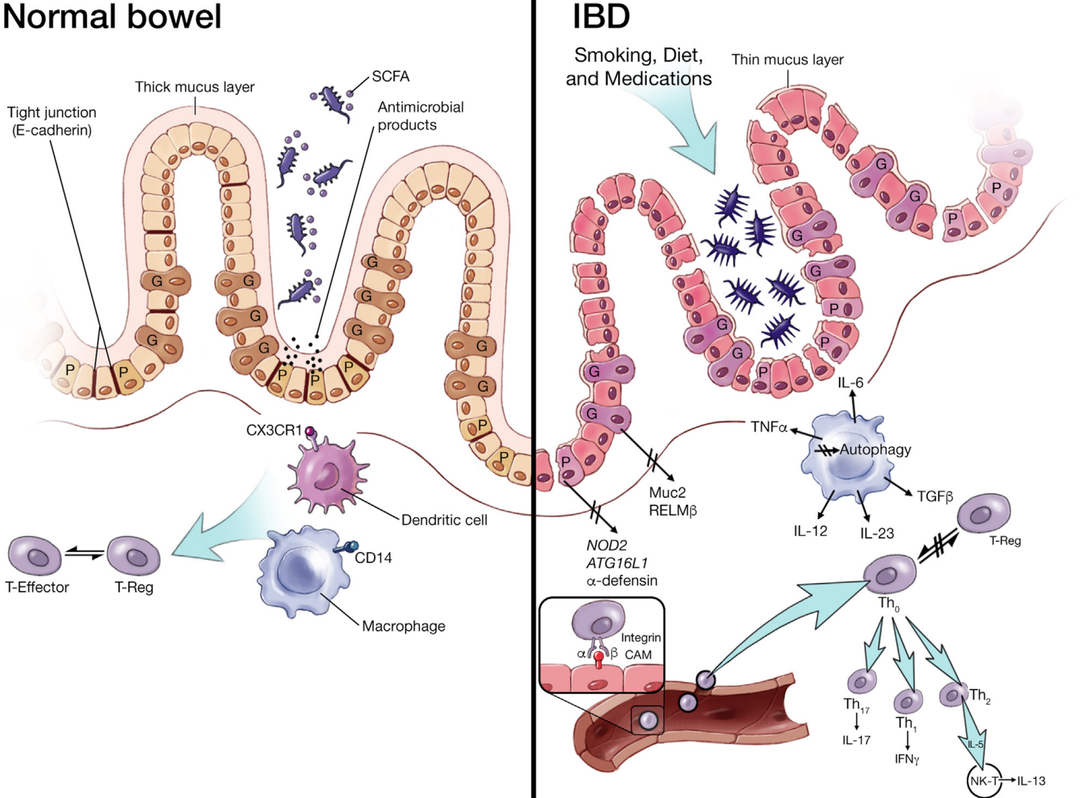
炎症性肠炎( Inflammatory Bowel Disease, IBD)是一种病因不明的结肠或胃肠道的非特异性慢性炎症性疾病。因为其易复发,不可根治,曾被称为“绿色癌症”,和普通肠炎有较大区别。普通肠炎一般是急性的,进行抗感染治疗后可以治愈。IBD临床表现IBD 可产生多种临床表现,包括但不限于以下几种:➤ 消化道症状如腹泻、腹痛、便血、肛周脓肿等;➤ 全身症状如体重减轻、发热、乏力、贫血等;➤ 肠外表现如关节、皮肤、粘膜、眼部病变等;严重者可出现肠穿孔、肠梗阻、大出血等,甚至癌变。IBD发病机制IBD发病原因目前尚未明确,研究表明:易感基因、免疫系统、外界环境和肠道微生物等多种因素均与疾病发生相关。IBD发病因素其中环境触发因素可通过其对微生物组的影响来介导IBD发病机制。然而,为了使微生物改变导致不适当的和持续的炎症,肠屏障的分离腔和粘膜完整性也受到损害。在IBD粘膜中效应T细胞和调节性T细胞(T-reg)之间的平衡受到了干扰,造成异常的免疫应答和T细胞驱动的过度炎症反应。正常肠和炎症性肠病(IBD)的肠黏膜IBD包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD),两者最大的区别是:UC 的炎症只局限于大肠,而 CD 的炎症可以发生于全消化道从口腔到肛门部。IBD以前在我国属于少见病,但近年来,其发病率逐渐攀升。IBD疾病模型目前有多种临床前小鼠模型用于研究 IBD,基于不同诱导方法得到的疾病模型具有特定的用途。葡聚糖硫酸钠(Dextran Sulfate Sodium Salt,DSS)诱导的小鼠肠炎模型是使用最广泛的化学诱导小鼠 IBD 模型。通过将 DSS 溶于饮用水中诱发急性溃疡性肠炎或者慢性结肠炎,破坏小鼠肠上皮细胞,非特异性免疫细胞释放细胞因子,最终导致黏膜屏障的完整性遭到破坏,动物表现出明显的体重减轻、稀便、便血以及粒细胞浸润现象,在临床症状和病理特征上与人类的溃疡性结肠炎极其相似。百奥赛图在 C57BL/6 小鼠上建立了稳定的 DSS 诱导 IBD 疾病模型,可用于炎症性肠炎的临床前研究和药效评价。IBD 小鼠疾病模型用于评价炎症性肠炎药物环孢菌素 A(Cyclosporin A, CsA)的药效模型制备示意图临床评分C57BL/6 小鼠连续 7 天饮用含 DSS 的饮用水,全程记录体重变化,并进行临床评分。(A-C)各组动物体重变化趋势。(D)各组动物临床评分。实验数据显示,造模组(G2-DSS)相对于未造模组(G1-Vehicle),动物体重有所下降,且临床评分明显升高;给药组(G3-DSS-CSA low dose 和 G4-DSS-CSA high dose)的动物体重变化不明显,临床评分略有升高。这表明 DSS 诱发 C57BL/6 小鼠炎性肠病疾病模型造模成功,CsA 对小鼠炎性肠病疾病模型的临床症状有缓解,并且呈现剂量依赖效应大体取材与结肠评价DSS 诱发 C57BL/6 小鼠炎性肠病疾病模型 7 天后,取结肠进行称重和测量长度。(A)结肠长度比较。(B)各组动物结肠重量与体重比值。(C)各组动物结肠重量与结肠长度比值。实验数据显示,造模组(G2-DSS)相对于未造模组(G1-Vehicle),结肠重量和长度明显异常;与造模组相比,给药组的结肠重量下降,结肠长度上升,二者比值显著降低。这表明 CsA 对 DSS 诱发小鼠炎性肠病疾病模型的结肠症状有所缓解。病理分析取 DSS 诱发 C57BL/6 小鼠炎性肠病疾病模型的结肠,将组织切片进行病理检测。(A)各组动物结肠 H&E染色图示。(B)各组动物结肠病理评分。实验数据显示,造模组(G2-DSS)相对于未造模组(G1-Vehicle),肠上皮细胞受到破坏,肠道黏膜层完整性遭到破坏,炎性细胞大量浸润;而给药组(G3-DSS-CSA low dose 和 G4-DSS-CSA high dose)的结肠症状明显缓解,且表现出剂量效应。综合临床评分、大体取材和结肠评价、病理分析结果,表明 DSS 诱发 C57BL/6 小鼠炎性肠病疾病模型造模成功,环孢菌素 A(CsA)能够显著缓解 DSS 诱发炎性肠病结肠病损,且表现出剂量效应。可提供服务内容IBD药物评估相关模型列表百奥动物自主研发多种自身免疫性疾病模型,可点联系我们,获取更多疾病模型资料。参考资料:1. Elson, C.O., Sartor, R.B., Tennyson, G.S. & Riddell, R.H. Experimental models ofinflammatory bowel disease. Gastroenterology 109, 1344-1367 (1995). 2. Kiesler, P., Fuss, I.J. & Strober, W. Experimental Models of Inflammatory Bowel Diseases. Cell Mol Gastroenterol Hepatol 1, 154-170 (2015). 3. Mourad, F.H., Yau, Y., Wasinger, V.C. & Leong, R.W. Proteomics in Inflammatory Bowel Disease: Approach Using Animal Models. Dig Dis Sci 62, 2266-2276 (2017).4. Guilherme Piovezani Ramos, MD, and Konstantinos A. Papadakis, MD.Mechanisms of Disease: Inflammatory Bowel Diseases.Mayo Clin Proc. 2019;94(1):155-165.
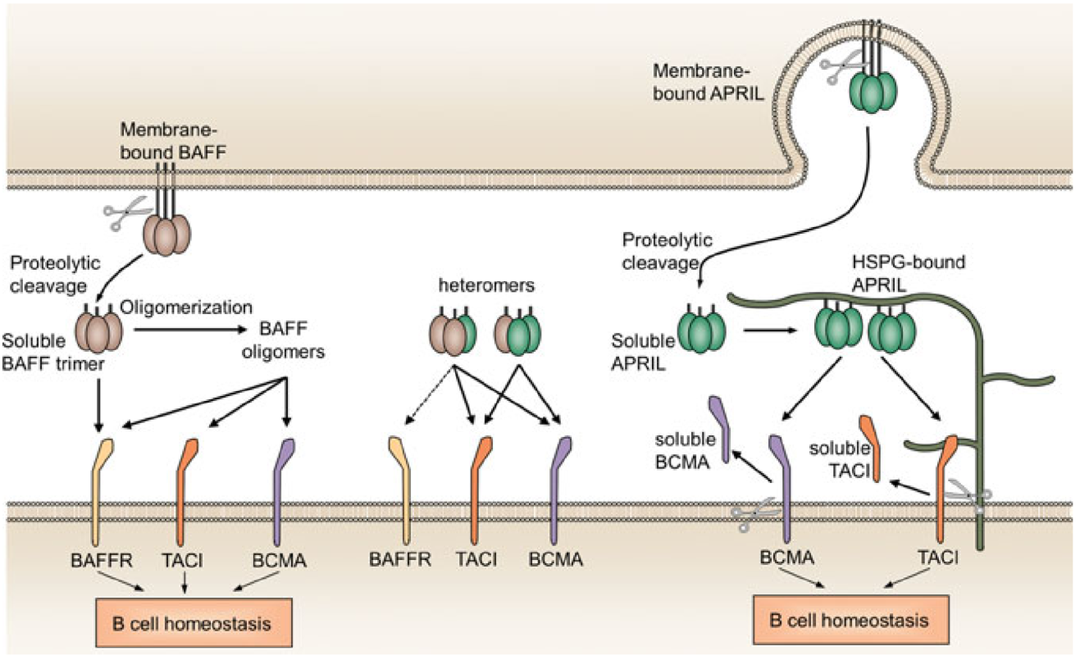
自身免疫性疾病,是机体免疫系统出现异常,自身抗体或自身效应淋巴细胞攻击正常细胞导致的自身组织器官损伤性疾病。自身免疫性疾病有100多种,位于心血管疾病和肿瘤之后的第三类主要疾病。B细胞作为自身免疫性疾病最重要的效应细胞之一,靶向B细胞相关靶点药物的开发是各大药企热衷的治疗领域之一。BAFF靶点介绍B细胞激活因子BAFF(也称为TNFSF13B、CD257)作为一种关键的B细胞生存因子,属于肿瘤坏死因子(TNF)配体家族成员,有可溶型和膜结合型两种形式。BAFF在包括单核细胞、树突细胞和骨髓基质细胞在内的各种细胞类型上均有表达,其受体有3种:TNFRSF13B/TACI(跨膜激活因子和钙调节因子、亲环蛋白配体作用因子), TNFRSF17/BCMA(B细胞成熟抗原),TNFRSF13C/BAFFR(B细胞激活因子受体)。BAFF通过与其受体的结合在支持B细胞的存活和增殖、调节类别转换重组以及自身免疫性B细胞的选择等方面发挥关键作用;此外,有研究发现BAFF也能促进T细胞的活化、增殖和分化。图1. BAFF与其受体的互作[1]BAFF参与了人类许多自身免疫性疾病的发病机制,在系统性红斑狼疮(SLE)、多发性硬化症(MS)、IgA肾病、Sjögren’s综合征和类风湿关节炎等患者的血清中检测到BAFF的浓度水平升高。其中,系统性红斑狼疮(SLE)是一种临床表现为多系统损害症状的慢性系统性自身免疫疾病,它的发病机制复杂,包括自身反应性T细胞与B细胞的增殖活化,多种自身致病性抗体的产生,细胞因子分泌及其受体表达异常等。目前,用于治疗SLE的上市药物只有两种,分别是贝利尤单抗(Belimumab)和泰它西普(Telitacicept)。图2. 系统性红斑狼疮的免疫发病机制(注:BAFF又称为BLyS)[2]贝利尤单抗贝利尤单抗(Belimumab,商品名:倍力腾)是一种特异性识别和抑制BAFF生物活性的人源性单克隆抗体,能显著降低循环B细胞水平。B细胞耐受性的丧失在SLE的发生和维持中起着关键的病理作用,靶向B细胞的产生、相互作用和功能性治疗被认为是一种有前途的新策略。贝利尤单抗是当前唯一同时获得FDA和CDE批准的新药。12000年10月,HGS和Cambridge Antibody Technology(CAT)达成合作,共同开发针对BLyS的单克隆抗体。最终在2003年得到了以高亲和力结合BLyS的人源单抗“LymphoStat B”,即后来的Belimumab。22006年8月,HGS和GlaxoSmithKline(GSK)达成了一项共同开发和商业化Belimumab的协议。根据协议,GSK协助HGS进行Belimumab的临床试验,两家公司平分临床试验的成本及之后产品销售获得的利润。32019年7月,贝利尤单抗在中国获批上市,全球首个且目前唯一治疗SLE的生物制剂Belimumab在华获批,开启了SLE临床治疗的新篇章。 42020年12月,贝利尤单抗正式获得国家药品监督管理局批准,通过谈判纳入了2020版国家医保目录,用于治疗儿童SLE,意味着贝利尤单抗成为中国覆盖5岁及以上儿童及成人SLE治疗的生物制剂。图3. 贝利尤单抗产品图(来源于百度图片搜索)泰它西普泰它西普(Telitacicept,商品名:泰爱)是一种TACI-Fc融合蛋白,由人跨膜激活剂及钙调亲环素配体相互作用因子(TACI)受体的胞外域以及人免疫球蛋白G(IgG)的可结晶片段(Fc)域构成。泰它西普靶向两类对B淋巴细胞发育至关重要的细胞信号分子:B淋巴细胞刺激因子(BLyS)和增殖诱导配体(APRIL),能够有效降低B细胞介导的自身免疫应答,达到治疗自身免疫疾病的目的。泰它西普目前仅被CDE批准用于治疗8分以上的SLE患者。12010年荣昌生物向国家药监局申报临床试验,并于2011年获得I期临床试验批件。22012年在北京协和医院完成I期临床试验,2013年获国家食品药品监督管理总局Ⅱ、Ⅲ期临床试验批件。32019年11月,泰它西普的新药上市申请正式获得CDE承办受理,并于12月以具有明显治疗优势创新药纳入优先审评审批。42021年3月,泰它西普正式获得国家药品监督管理局(NMPA)批准上市,用于治疗SLE,标志着荣昌生物迎来了首个正式进入商业化阶段的产品。图4. 泰它西普产品及结构图(来源于荣昌生物官网)根据科睿唯安数据库检索发现,除了以上两种上市药物以外,还有多款相关药物处在临床研究阶段。表1.药物研究进展(部分)BioMice百奥动物自主开发了人源化B-hBAFF mice、B-hBAFFR mice 助力药物研发。B-hBAFF mice基本信息蛋白表达分析用ELISA方法对野生型(WT)小鼠和B-hBAFF小鼠进行BAFF种特异性表达分析。采集WT小鼠(+/+)和杂合子B-hBAFF小鼠(H/+)的血清,用种特异性BAFF ELISA试剂盒进行ELISA分析。小鼠BAFF在WT小鼠和杂合B-hBAFF小鼠中均可检测到,人BAFF在杂合B-hBAFF小鼠中可检测到。B-hBAFFR mice基本信息蛋白表达分析流式细胞术分析B-hBAFFR纯合小鼠中种特异性BAFFR的表达情况。分别取WT小鼠(+/+)和纯合B-hBAFFR小鼠 (H/H)的脾细胞,用种特异性抗BAFFR抗体进行流式细胞术分析。小鼠BAFFR在WT小鼠中检测到,人BAFFR只在纯合B-hBAFFR中能检测到,WT小鼠中无法检测到。更多验证数据信息,正在开展中,敬请关注。参考资料[1]. Samy E , Wax S , Huard B , et al. Targeting BAFF and APRIL in systemic lupus erythematosus and other antibody-associated diseases[J]. International Reviews of Immunology, 2017.[2]. Espinosa G , Cervera R . Belimumab: a BLyS-specific inhibitor for the treatment of systemic lupus erythematosus.[J]. Clinical Pharmacology & Therapeutics, 2012, 91(12):143.[3]. https://www.gsk.com/en-gb/search/?q=belimumab&p=5.[4]. http://www.remegen.cn/index.php?v=show&cid=68&id=113.

1973年,Kobylka和Carraway在乳腺上皮细胞中发现了一种在乳脂球中无法水解的膜蛋白,1978年,该分子被鉴定为血小板GPIV,一种介导血小板中血小板反应蛋白-1(TSP-1)结合的蛋白。随后,Tandon发现GPIV与白细胞分化抗原CD36具有重叠结构。随后,其他研究人员确定了CD36在血小板活化和细胞粘附中的作用。1993年,Abumrad及其同事证明了CD36的脂肪活性,之后将该蛋白在小鼠体内克隆并鉴定为人CD36的小鼠直系同源物,表明其在脂肪酸摄取中的作用。CD36现在被广泛认为是一种清道夫受体,可以吸收长链脂肪酸(LCFAs)和氧化低密度脂蛋白(ox-LDL)。CD36是一种清道夫受体,在多种细胞类型中表达。在脂质代谢中发挥重要作用,介导脂质摄取、免疫识别、炎症、分子粘附和凋亡。与血管生成、炎症反应、动脉粥样硬化性血栓性疾病以及代谢紊乱性糖尿病和肥胖症等有关。在免疫系统中,CD36介导树突状细胞抗原的获取和呈递,并支持调节性T细胞功能。研究表明靶向CD36可能是提高CD8+T细胞免疫疗法的抗肿瘤药效的有效策略,为临床治疗提供了新的思路和可能。[1]CD36与PPAR-β激活[2]CD36靶向作用破坏肿瘤内Treg细胞,并启动PD-1阻断肿瘤。具有抗CD36抗体的MOA: ①耗尽CD36+ Treg细胞。②阻断PPAR-和PPAR-依赖的代谢途径,降低线粒体活性和CD36表达水平,促进Treg细胞凋亡。③阻断TSP-1/CD36通路,促进TME血管生成。CD36调节肿瘤免疫[3]CD36在肿瘤微环境中发挥作用。CD36调节下游Src家族激酶促进抗血管生成、FAO以及化疗耐药和放疗耐药,从而导致肿瘤转移。CD36还通过EMT激活Wnt/TGF-β信号传导促进肿瘤转移。CD36摄取多种脂质,如ox-LDL、LCFAs和胆固醇。免疫细胞中的脂质沉积导致树突状细胞的无菌性炎症和抗原呈递功能障碍,从而诱导肿瘤免疫抑制。此外,CD36可以与凋亡细胞结合并激活交叉引物,这可能导致免疫抑制和肿瘤发展。BioMice百奥动物自主研发了人源化小鼠B-hCD36 mice和人源化细胞系B-hCD36 MC38助力科研。B-hCD36 miceB-hCD36小鼠血常规检测全血细胞计数(CBC)。采集雌性C57BL/6和B-hCD36小鼠(n=8,6-8周龄)的血液并进行全血细胞计数分析。B-hCD36小鼠的测量结果与C57BL/6小鼠相似,表明人源化不会改变血细胞组成和形态。数值表示为平均值±SEM。B-hCD36小鼠血生化检测B-hCD36小鼠的血生化试验。收集C57BL/6和B-hCD36小鼠(n=8,6-8周龄)的血清,并分析其指标水平。B-hCD36小鼠的测量结果与C57BL/6小鼠相似,表明人源化不会改变肝脏等相关组织的健康。数值表示为平均值±SEM。使用抗CD36抗体测试B-hCD36模型的抗体结合试验通过流式细胞术对纯合B-hCD36小鼠进行种属特异性CD36表达分析。收集野生型小鼠 (+/+)和纯合B-hCD36小鼠(H/H)的腹腔渗出巨噬细胞,并通过抗CD36抗体的流式细胞术进行分析。人CD36仅在纯合B-hCD36小鼠中可检测到,但在野生型小鼠中未检测到。CD36-1G04-hIgG1-LALA抗体在小鼠和人中交叉识别。B-hCD36 MC38蛋白表达分析通过流式细胞术对B-hCD36 MC38细胞中的CD36表达进行分析。用种属特异性抗 CD36抗体对B-hCD36 MC38培养物的单细胞混悬液进行染色。在B-hCD36 MC38细胞表面检测到人CD36,但在野生型MC38细胞表面未检测到。使用B-hCD36 MC38细胞的10-G12克隆进行体内实验。肿瘤生长曲线和体重变化B-hCD36 MC38细胞的皮下同种移植肿瘤生长。将B-hCD36 MC38细胞(5x105)和野生型MC38细胞(5x105)皮下植入B-hCD36小鼠(雌性,7周龄,n=5)。每周测量两次肿瘤体积和体重。(A)平均肿瘤体积±SEM。(B)体重(平均值±SEM)。体积以mm3表示,使用公式:V=0.5X长径X短径2。如图A所示,B-hCD36 MC38细胞能够在体内建立肿瘤,可用于有效性研究。肿瘤细胞蛋白表达分析将B-hCD36 MC38细胞皮下移植到B-hCD36小鼠(n=5)中,接种后35天,收获肿瘤细胞并通过流式细胞术评估人CD36表达。如图所示,人CD36在肿瘤细胞表面高度表达。因此,B-hCD36 MC38细胞可用于新型CD36疗法的体内药效研究。更多验证数据信息,正在研究进行中,敬请关注。想要获取更多百奥动物自主研发的人源化小鼠信息,请访问百奥动物官网或扫描下方二维码。参考文献1.CD36-mediated ferroptosis dampens intratumoral CD8+T cell effector function and impairs their antitumor ability2.Wang, H., Franco, F., Tsui, Y. et al. CD36-mediated metabolic adaptation supports regulatory T cell survival and function in tumors. Nat Immunol 21, 298–308 (2020). doi:10.1038/s41590-019-0589-53.Wang, Jingchun; Li, Yongsheng (2019). CD36 tango in cancer: signaling pathways and functions. Theranostics, 9(17), 4893–4908. doi:10.7150/thno.36037
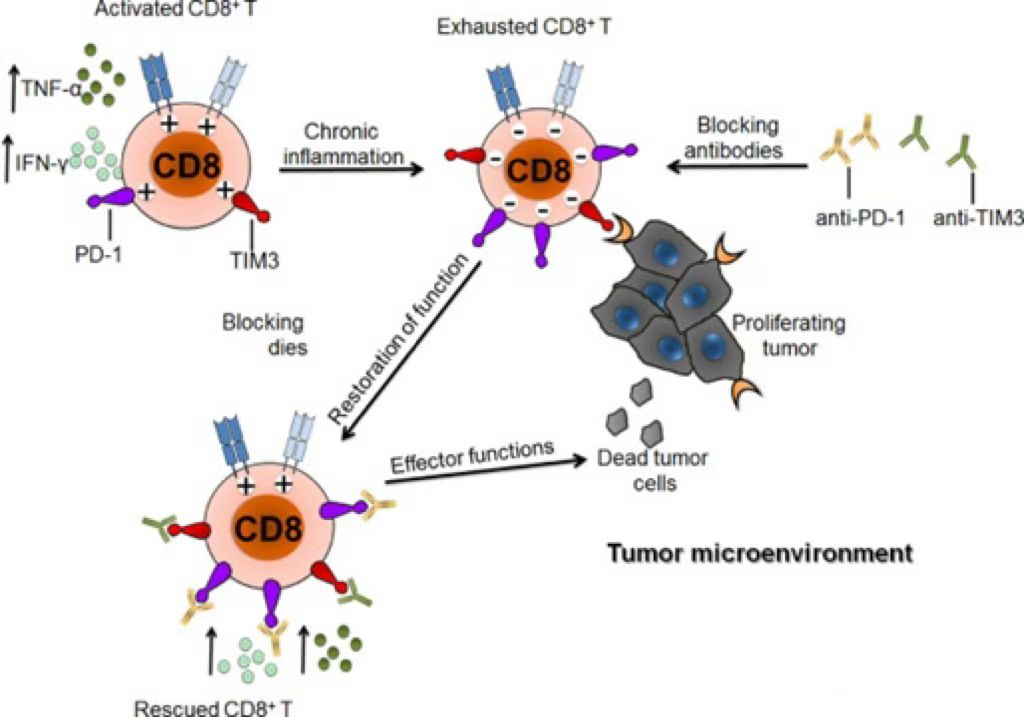
TIM3(T细胞免疫球蛋白及粘蛋白结构域分子3)又称HAVCR2,属于免疫调节蛋白TIM家族的一员,在人类,TIM家族包括TIM1、TIM3和TIM4,位于染色体5q33.2上。在小鼠中,TIM家族包括TIM1到TIM8,位于染色体11B1.1上。大量证据表明,TIM家族在自身免疫性疾病、感染性疾病、肿瘤免疫监视和免疫逃逸等免疫反应的调节中发挥着不同的作用。TIM3是一类T细胞表面抑制性分子,能够引起癌症与慢性病毒感染过程中T细胞的耗竭。与CTLA4,PD1类似,它也是目前研究最多的免疫治疗的靶点之一。TIM3作为一种负调控的免疫检查点,于2002年首次被发现,由281个氨基酸组成,并且由一个胞外区、一个单跨膜结构域和一个C-末端细胞质尾部组成。TIM3选择性地表达在分泌IFN-γ的辅助性T细胞(Th1和Th17) 、调节性T细胞(Treg) 、树突状细胞(DCs) 、单核细胞、肥大细胞、NK细胞、肿瘤浸润淋巴细胞(TILs) 上,在肿瘤细胞上亦有表达,如黑色素瘤、胃癌、B细胞淋巴瘤。TIM3作为重要的免疫检查点的机制主要在于TIM3标志着肿瘤浸润CD8+ PD1+ T细胞功能最失调的亚群。同时阻断TIM3和PD1通路的抗体对抑制肿瘤生长、改善肿瘤抗原特异性CD8+T细胞的响应具有协同作用。[1]。 图1:TIM3可以诱导T细胞耗竭[1]TIM3有多种不同的配体,包括半乳糖凝集素9(Galectin 9)、磷脂酰丝氨酸(PtdSer)、癌胚抗原相关细胞粘附分子1(CEACAM1)以及HMGB1,它们分别与TIM3胞外区IgV结构域的不同位点结合。当TIM3未与其配体结合时,它被招募到T细胞激活的免疫突触中,与 HLA-B相关转录产物3(BAT3)相互作用,并通过酪氨酸激酶LCK募集维持T细胞活化。可溶性凝集素半乳糖凝集素9(Galectin 9)和粘附分子癌生物抗原相关细胞粘附分子1(CEACAM1),通过酪氨酸激酶ITK触发Tyr256和Tyr263的磷酸化。磷酸化后,BAT3从TIM3中释放出来,从而使TIM3发挥其抑制功能。BAT3敲除的T细胞其共抑制受体的表达升高,并且在自身免疫的背景下表现出降低的致病性,说明BAT3通过负反馈来调节T细胞的功能。FYN与BAT3结合TIM3的同一区域。多数促进抗肿瘤免疫的TIM3靶向抗体干扰CEACAM1或PtdSer与TIM3的结合,从而维持TIM3-BAT3的相互作用[2]。 图2:TIM3的作用机制[2]TIM3靶点药物研发进展 随着技术进步和研究创新,TIM3是目前研究最多的免疫治疗的靶点之一,靶向TIM3的治疗正处于临床试验/研发阶段,国内外尚无已上市药物,但很多制药企业都有布局,临床III期两个(诺华、GSK各有一个)、临床II期5个(罗氏、百济神州、阿斯利康等)、临床I期8个(礼来、恒瑞等),主要适应症急性髓系白血病(AML)和骨髓增生异常综合症(MDS)、非小细胞肺癌等实体瘤;全球研发TIM3/PD1双特异性抗体的公司不多,研究进入临床试验的只有阿斯利康、罗氏和礼来,其余皆处于临床前。 表1. 部分在研药物临床进展数据来源于科睿唯安针对TIM3靶点机制研究和新药开发的需求,BioMice百奥动物自主研发了B-hTIM3 mice,同时也扩繁了B-hPD-1/hTIM3 mice,B-hPD-L1/hTIM3 mice,B-hCTLA4/hTIM3 mice双人源化小鼠及B-hPD-1/hPD-L1/hTIM3 mice等三人源化小鼠,相关模型列表见文末,助力靶向TIM3药物开发,为临床前药效评估提供了优质模型。B-hTIM3 mice基本信息蛋白表达分析通过流式细胞术对纯合B-hTIM3 小鼠进行种属特异性B-hTIM3 小鼠表达分析。收集野生型C57BL/6和纯合 B-hTIM3 小鼠的腹腔冲洗液细胞,结果显示:小鼠 TIM3 仅在野生型小鼠的非 T 和非 B 细胞中检测到,人 TIM3 仅在纯合 B-hTIM3 小鼠的非 T 和非 B 细胞可检测到。通过流式细胞术对纯合B-hTIM3 小鼠进行种属特异性 TIM3 表达分析。收集野生型C57BL/6和纯合 B-hTIM3 小鼠的脾细胞,结果显示:小鼠 TIM3 仅在野生型小鼠中检测到。人 TIM3 仅在纯合 B-hTIM3 小鼠中检测到。药效验证抗人 TIM3 抗体在B-hTIM3 小鼠中的抗肿瘤活性。(A)抗人 TIM3 抗体可抑制B-hTIM3 小鼠中的MC38肿瘤生长。将小鼠结肠癌MC38细胞皮下植入纯合B-hTIM3 小鼠(雄性,7周龄,n=5)。当肿瘤体积达到约100 mm3时,将小鼠分组,此时用抗人 TIM3 抗体处理。(B)给药期间体重变化。如图A所示,抗人 TIM3 抗体可有效抑制B-hTIM3 小鼠的肿瘤生长,表明B-hTIM3 小鼠为抗人 TIM3 抗体的体内评价提供了有力的临床前模型。数值表示为平均值±SEM。抗人 TIM3 抗体在B-hTIM3 小鼠中的抗肿瘤活性。(A)抗人 TIM3 抗体可抑制B-hTIM3 小鼠中的MC38肿瘤生长。将小鼠结肠癌MC38细胞皮下植入纯合B-hTIM3 小鼠(雌性,4周龄,n=5)。当肿瘤体积达到约100 mm3时,将小鼠分组,此时用抗人 TIM3 抗体处理。(B)给药期间体重变化。如图A所示,抗人 TIM3 抗体可有效抑制B-hTIM3 小鼠的肿瘤生长,表明B-hTIM3 小鼠为抗人 TIM3 抗体的体内评价提供了有力的临床前模型。B-hCTLA-4/hTIM3 mice蛋白表达分析通过流式细胞术对纯合B-hCTLA4/hTIM3 小鼠进行种属特异性 TIM3 表达分析。收集野生型C57BL/6和纯合 B-hCTLA4/hTIM3(H/H) 小鼠的脾细胞,结果显示:小鼠 TIM3 在野生型小鼠中可检测到。人 TIM3 仅在纯合 B-hCTLA4/hTIM3 小鼠中可检测到,但在 WT 小鼠中未检测到。通过流式细胞术对纯合B-hCTLA4/hTIM3 小鼠进行种属特异性CTLA4 表达分析。收集野生型C57BL/6和纯合 B-hCTLA4/hTIM3(H/H) 小鼠的脾细胞,结果显示:小鼠 CTLA4 在野生型小鼠中可检测到。人CTLA4仅在纯合 B-hCTLA4/hTIM3 小鼠中可检测到,但在 WT 小鼠中未检测到。B-hPD-1/hTIM3 mice药效验证抗人TIM3抗体联合抗人PD-1抗体在B-hPD-1/hTIM3 小鼠中的抗肿瘤药效。(A)抗人TIM3 抗体联合抗人PD-1抗体抑制B-hPD-1/hTIM3 小鼠MC38肿瘤生长。小鼠结肠癌MC38细胞(5×105)皮下植入纯合B-hPD-1/hTIM3小鼠中(雌性,6-8周龄,n=6)。当肿瘤体积达到大约150±50 mm3时,小鼠被分组,然后用抗人 TIM3 抗体联合抗人PD -1抗体Keytruda给药。(B)治疗期间体重变化。如图A所示,抗人TIM3抗体与抗人PD-1抗体联合使用比单独使用组对肿瘤生长具有更强的抑制作用,说明B-hPD-1/hTIM3小鼠为评价人TIM3抗体与人PD-1抗体联合治疗的体内评估提供了一个强有力的临床前模型。B-hPD-1/hPD-L1/hTIM3 mice药效验证抗人PD-L1抗体(内部合成)联合抗人TIM3抗体在B-hPD-1/hPD-L1/hTIM3 小鼠中的抗肿瘤药效。(A) 纯合B-hPD-1/hPD-L1/hTIM3 小鼠(雌性,7-8周龄,n=6)皮下接种小鼠结肠癌MC38细胞。当肿瘤体积达到约100 mm3时对小鼠进行分组,分组后给抗人PD-L1抗体和抗人 TIM3 抗体进行治疗,剂量和时间表如图 A 所示。(B) 给药期间的体重变化。如图 A 所示,抗人 PD-L1 抗体和抗人 TIM3 抗体联合给药组的抑制作用强于单药组,抗人 PD-L1 抗体联合抗人 TIM3 抗体可抑制 B-hPD-1/hPD-L1/hTIM3 小鼠中的肿瘤细胞生长。结果证明 B-hPD-1/hPD-L1/hTIM3 小鼠可为体内评价抗人PD-L1 和抗人TIM3抗体药效提供有力的临床前研究模型。抗人PD-1抗体(内部合成)联合抗人TIM3抗体在B-hPD-1/hPD-L1/hTIM3 小鼠中的抗肿瘤药效。(A) 纯合B-hPD-1/hPD-L1/hTIM3 小鼠(雌性,7-8周龄,n=6)皮下接种小鼠结肠癌MC38细胞。当肿瘤体积达到约100 mm3时对小鼠进行分组,分组后给抗人PD-1抗体和抗人 TIM3 抗体进行治疗,剂量和时间表如图 A 所示。(B) 给药期间的体重变化。如图 A 所示,抗人 PD-1 抗体和抗人 TIM3 抗体联合给药组的抑制作用强于单药组,抗人 PD-1 抗体联合抗人 TIM3 抗体可抑制 B-hPD-1/hPD-L1/hTIM3 小鼠中的肿瘤细胞生长。结果证明 B-hPD-1/hPD-L1/hTIM3 小鼠可为体内评价抗人PD-1 和抗人TIM3抗体药效提供有力的临床前研究模型。参考资料[1] Solinas, C., et al., Significance of TIM3 expression in cancer: From biology to the clinic. Semin Oncol, 2019. 46(4-5): p. 372-379.[2] Wolf, Y., A.C. Anderson, and V.K. Kuchroo, TIM3 comes of age as an inhibitory receptor. Nat Rev Immunol, 2020. 20(3): p. 173-185.TIM3靶点相关模型列表
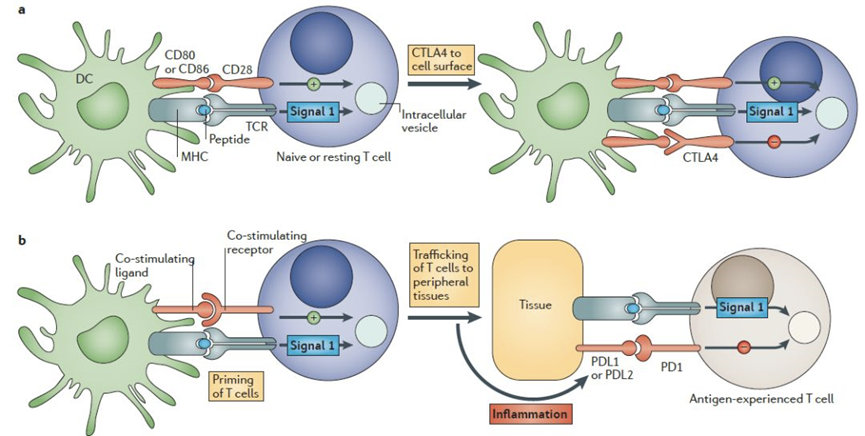
2006年3月,TeGenero公司的CD28超级激动剂单抗TGN1412治疗风湿性关节炎/白血病的1期临床试验中,6名志愿者遭受细胞因子释放综合征并伴有多器官功能衰竭,全身极度肿胀成为“大象人”,万幸的是最终脱离生命危险,该事件直接导致TeGenero破产。16年前的黑天鹅事件也给CD28药物开发蒙上了一层阴影。后续TGN1412并未被就此放弃,莫斯科抗体公司TheraMab顺利接盘并更名为TAB08,有报道称1期临床NCT03006029、NCT01990157不良事件保持在一个可接受的水平(短暂的发热与IL-6有关),然而试验如今已经因“行政原因”终止,这款CD28单抗最终也没能迎来涅槃重生[1]。如此看来,再次沉沦的CD28的未来当真就是砂砾宿命了吗?2017年,Science上发表了一篇题为Rescue of exhausted CD8 Tcells by PD-1 targeted therapies is CD28-dependent的文章,证明了CD28/B7共刺激途径对有效的PD-1疗法至关重要。至此,CD28再次回到研究者的视线中。2019年11月,赛诺菲在Nature Cancer发表了一款CD28/CD3/CD38三抗的研究进展。该三抗在CD3分子亲和力的选择上,采用了中等亲和力的抗体(KD~20nM)平衡了杀伤有效性以及细胞因子大量释放的安全性问题[2]。2020年1月,再生元在Science Translational Medicine发表论文,指出CD28双抗可以增强CD3的抗肿瘤疗效。在动物实验中,共刺激型CD28双抗明显增强了CD3双抗的疗效,且没有细胞因子风暴的风险。2020年6月24日,再生元再次在ScienceTranslational Medicine杂志上发表论文,证实了肿瘤特异性抗原(TSA) x CD28双特异性抗体可以与更广泛的抗PD-1抗体协同作用,增强癌症治疗效果,诱导长效抗肿瘤免疫力,且不会诱发细胞因子风暴,具有很好的耐受性。今年2月,赛诺菲的研发团队在Nature发表了一篇HER2×CD3×CD28三抗的研究进展。研究表明,在原代人CD3+T细胞重组的免疫缺陷NSG小鼠体内,该三抗使CD8 T细胞中颗粒酶的表达增加了6.8倍。相关肿瘤药效实验结果表明,剂量低至10μg/kg时,HER2×CD3×CD28三抗依然能够诱导肿瘤消退。近期,惠和生物靶向CD3×CD28×CD19三特异性抗体CC312的IND申请获得美国FDA默示许可,进入临床研发阶段,CC312是国内首个,也是全球第三个基于CD28共刺激信号的三特异性抗体。随着赛诺菲、再生元等牵头的研究推进,CD28被强势拉回公众视野,更多的潜力有待开发!CD28相关信号通路CD28是T细胞激活最重要的参与者之一,是增强MHC-TCR的主激活信号的主要辅助信号。CD28和CTLA-4具有高度的同源性,具有相同的配体CD80和CD86(B7-1和B7-2),CD28负责传递激活信号,活化T细胞,而CTLA-4负责传递抑制信号给T细胞,让T细胞不会杀伤其它细胞,包括肿瘤细胞。CTLA-4与配体的亲和力要高于CD28,因此会竞争阻断CD28的T细胞激活作用。在T细胞辅助激活的过程中,CD86优先表达,在与CD28结合上,CD86表现出优于CD80的结合能力,有利于T细胞激活。在T细胞激活的过程中,CD28扮演着“加油”角色,CTLA-4扮演着“前刹车”角色,PD-1则扮演着“后刹车”角色[3]。CD28、CTLA-4、PD-1/PD-L1信号通路[4]CD28靶点部分开发进展CD28作为一个老靶点,不仅机制清晰,而且针对不同临床适应症,既可开发拮抗剂也可开发激动剂,理应前景无限,但由于其研发历程的跌宕起伏,目前只有少量抗体药物开发管线。其临床药物开发上主要集中在3个方面:CD28关联靶点融合蛋白药物;单抗药物;多特异性抗体药物。(数据来源科睿唯安及公开信息整理)CD28系列人源化动物模型对于CD28相关药物的研究,再生元和赛诺菲已经做出了很好的表率,进一步的数据也许会让CD28再次火热起来。相关动物模型对于CD28靶向调节剂开发可谓至关重要,BioMice 百奥动物自主研发的CD28系列人源化鼠是评估CD28相关抗体药物的优质临床前实验动物模型。B-hCD28 小鼠验证数据蛋白表达分析流式细胞术分析B-hCD28纯合小鼠CD28的表达取抗CD3ε抗体刺激野生型小鼠和纯合B-hCD28小鼠的脾细胞,用种属特异性抗CD28抗体进行流式分析。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD28小鼠中检测到,而在野生型小鼠中检测不到。抗人CD28抗体的体内药效抗人CD28抗体在B-hCD28小鼠体内的抗肿瘤活性实验结果表明,两种抗人CD28抗体在B-hCD28小鼠体内均能有效控制肿瘤生长,表明B-hCD28小鼠为抗人CD28抗体的体内评价提供了一个优质的临床前模型。抗人PD-L1xCD28双特异性抗体的体内药效抗PD-L1和抗CD28 (PD-L1xCD28)双特异性抗体(BsAb)在B-hCD28小鼠中的抗肿瘤活性结果表明,抗人PD-L1xCD28 BsAbs能够有效控制B-hCD28小鼠的肿瘤生长,表明B-hCD28小鼠为抗人PD-L1xCD28 BsAbs的体内评价提供了一个优质的临床前模型。B-hCD3E/hCD28小鼠验证数据蛋白表达分析流式细胞术分析B-hCD3E/hCD28纯合小鼠CD3E的表达取野生型小鼠和纯合B-hCD3E/hCD28小鼠脾细胞,用种属特异性抗CD3E抗体进行流式细胞术分析。小鼠CD3E在野生型小鼠中检测到。人CD3E仅在纯合B-hCD3E/hCD28小鼠中检测到,而在野生型小鼠中检测不到。流式细胞术分析B-hCD3E/hCD28纯合小鼠CD28的表达取野生型小鼠和纯合B-hCD3E/hCD28小鼠脾细胞,用种属特异性抗CD28抗体进行流式细胞术分析。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD3E/hCD28小鼠中检测到,而在野生型小鼠中检测不到。B-hCD3EDG/hCD28 小鼠验证数据蛋白表达分析流式细胞术分析B-hCD3EDG/hCD28纯合小鼠CD3E的表达取野生型小鼠和纯合B-hCD3EDG/hCD28小鼠脾细胞,用种属特异性抗CD3E抗体进行流式分析。小鼠CD3E在野生型小鼠中检测到。人CD3E仅在纯合B-hCD3EDG/hCD28小鼠中检测到,而在野生型小鼠中检测不到。流式细胞术分析B-hCD3EDG/hCD28纯合小鼠CD28的表达取野生型小鼠和纯合B-hCD3EDG/hCD28小鼠脾细胞,用种属特异性抗CD28抗体进行流式细胞术分析。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD3EDG/hCD28小鼠中检测到,而在野生型小鼠中检测不到。B-hCD28/hTROP2小鼠验证数据蛋白表达分析流式细胞术分析B-hCD28/hTROP2纯合小鼠CD28的表达取野生型小鼠和纯合B-hCD28/hTROP2小鼠脾细胞,用种属特异性抗CD28抗体进行流式细胞术分析。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD28/hTROP2小鼠中检测到,而在野生型小鼠中检测不到。Western blot分析TROP2在B-hCD28/hTROP2纯合小鼠中的表达取野生型小鼠和纯合B-hCD28/hTROP2小鼠的皮肤组织,用抗TROP2抗体进行western blot分析。小鼠TROP2在野生型小鼠中检测到。人TROP2仅在纯合B-hCD28/hTROP2小鼠中检测到,而在野生型小鼠中检测不到。B-hCD28/hB7-H3小鼠验证数据蛋白表达分析流式细胞术分析B-hCD28/hB7-H3纯合小鼠CD28的表达取野生型小鼠和纯合B-hCD28/hB7-H3小鼠脾细胞,用种属特异性抗CD28抗体进行流式细胞术分析。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD28/hB7-H3小鼠中检测到,而在野生型小鼠中检测不到。Western blot分析B-hCD28/hB7-H3纯合小鼠B7-H3的表达采集野生型小鼠和纯合B-hCD28/hB7-H3小鼠附睾,用抗B7-H3抗体进行western blot分析。由于抗体的交叉反应,野生型小鼠和纯合B-hCD28/hB7-H3小鼠均可检测到B7-H3。B-hCD28/hCD20小鼠验证数据蛋白表达分析流式细胞术分析B-hCD28/hCD20纯合小鼠CD28的表达取野生型小鼠和纯合B-hCD28/hCD20小鼠脾细胞,用种属特异性抗CD28抗体进行流式细胞术分析。小鼠CD28在野生型小鼠中检测到。人CD28仅在纯合B-hCD28/hCD20小鼠中检测到,而在野生型小鼠中检测不到。流式细胞术检测B-hCD28/hCD20纯合小鼠CD20的表达取野生型小鼠和纯合B-hCD28/hCD20 小鼠脾细胞,用种属特异性抗CD20抗体进行流式细胞术分析。小鼠CD20在野生型小鼠中检测到。人CD20仅在纯合B-hCD28/hCD20小鼠中检测到,而在野生型小鼠中检测不到。B-hSIRPA/hCD47/hCD3E/hCD28小鼠验证数据蛋白表达分析流式细胞术分析B-hSIRPA/hCD47/hCD3E/hCD28纯合小鼠CD3E、CD28、SIRPA、CD47的表达取野生型小鼠和纯合B-hSIRPA/hCD47/hCD3E/hCD28小鼠脾细胞,分别用种特异性抗CD3E、CD28、SIRPA、CD47抗体进行流式细胞术分析。由于抗体的交叉反应,野生型小鼠和B-hSIRPA/hCD47/hCD3E/hCD28小鼠均可检测到小鼠SIRPA,人SIRPA仅在纯合B-hSIRPA/hCD47/hCD3E/hCD28小鼠中检测到,而在野生型小鼠中未检测到;小鼠CD3E、CD28、CD47在野生型小鼠中检测到,人CD3E、CD28、CD47仅在纯合B-hSIRPA/hCD47/hCD3E/hCD28小鼠中检测到,而在野生型小鼠中检测不到。CD28靶点相关模型列表 想要了解更多人源化小鼠,欢迎扫描下方二维码查看或者来电咨询。 参考资料:[1] https://mp.weixin.qq.com/s/6tuPYtTIr_gNQrb0N7o7_w[2] Sanofi R&D Investor Event[3] Dimitris Skokos et al. A class of costimulatoryCD28-bispecific antibodies that enhance the antitumor activity ofCD3-bispecific antibodies. Sci. Transl. Med. 2020[4]https://oncologypro.esmo.org/education-library/esmo-handbooks/immuno-oncology/immune-synapse
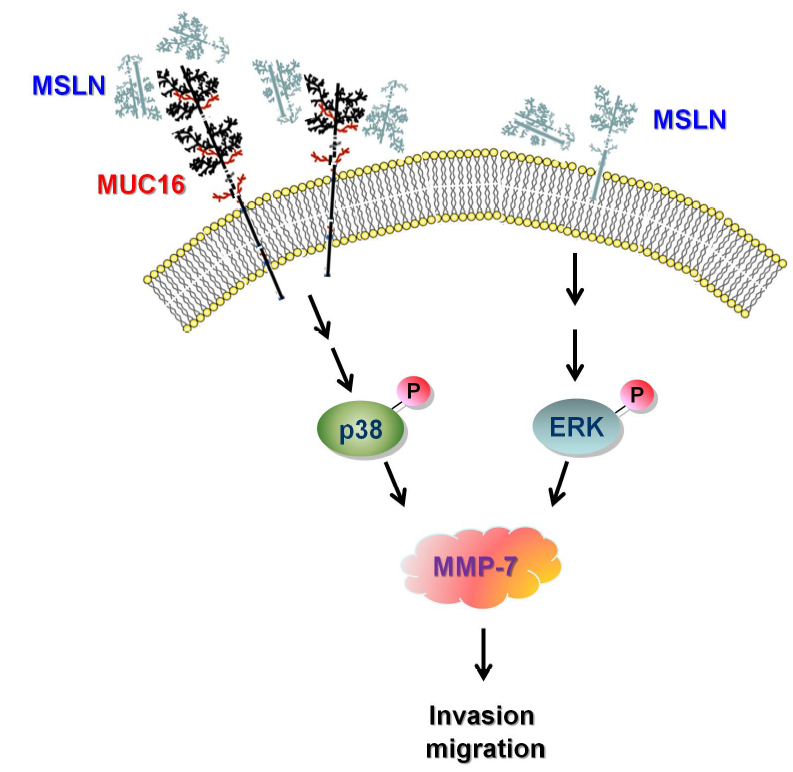
MSLN基因编码一种前体蛋白,经蛋白水解处理生成两种蛋白产物,主要位于正常间皮细胞表面,两种蛋白产物为巨核细胞增强因子(megakaryocyte potentiating,MPF)和间皮素(Mesothelin,MSLN)。巨核细胞增强因子作为细胞因子可刺激骨髓巨核细胞集落形成。间皮素在正常组织中,仅表达在间皮细胞,但在间皮瘤(mesothelioma)、卵巢癌(ovarian cancer)、胰腺癌(pancreatic cancer)、胆管癌(cholangiocarcinoma)等肿瘤中均有高表达。因此间皮素是很有前途的肿瘤特异性治疗候选药物靶点。图1.间皮素的结构和功能[1]MSLN通过ERK和PI3K/Akt通路促进肿瘤细胞存活和增殖;通过MMP-7的活性促进侵袭性和转移过程。通过与表达MUC16的细胞相互作用,也可以促进转移。然而,MSLN与EMT和血管生成相关的基本机制在PDAC中仍然有待阐明。MSLN在80%到90%的PDAC中过度表达,使该靶点成为PDAC患者治疗的一个有吸引力的候选。图2.MSLN在胰腺导管腺癌(PDAC)进展中的作用[2]MSLN与胰腺癌细胞表面的MUC16结合,激活了p38 MAPK依赖性途径,进而上调了MMP-7的合成,导致侵袭和迁移潜力增加。在胰腺癌细胞不表达MUC16的情况下,MSLN能够通过激活ERK依赖性途径上调MMP-7的表达。图3. MSLN-MUC16结合诱导胰腺癌细胞MMP-7的分子通路[3]目前靶向MSLN治疗实体瘤的药物主要有:单克隆抗体药物,携带蛋白毒素的单克隆抗体药物,携带低分子量细胞毒性药物的单克隆抗体药物,靶向MSLN的CAR-T细胞药物,以及可以诱导T细胞针对MSLN产生免疫应答的疫苗。图4. 临床试验中靶向MSLN的方法[4]最新研究进展据不完全统计,目前MSLN靶点处于在研阶段的相关药物有56个,目前进行相关药物研发的企业包括拜耳,Atara Biotherapeutics,诺华在研,亘喜生物,荣昌生物等。目前已有诸多国内外企业在该领域进行了布局。部分处于临床及以上阶段的药物情况统计见下表:数据来源于科睿唯安及公开信息整理针对MSLN靶点机制研究和新药开发的需求,BioMice百奥动物自主研发了B-hMSLN mice和B-hMSLN ID8、B-hMSLN MC38细胞系,助力靶向MSLN药物开发,为临床前药效评估提供了优质模型。B-hMSLN mice基本信息蛋白表达分析利用western blot检测野生型小鼠和B-hMSLN小鼠中种属特异性MSLN的表达。取野生型小鼠(+/+)和杂合B-hMSLN小鼠(H/+)的肺部裂解液,用抗MSLN抗体进行western blot分析。结果显示,小鼠MSLN在杂合B-hMSLN小鼠(H/+)和野生型小鼠(+/+)中均可检测到。人MSLN只在B-hMSLN小鼠(H/+)中可检测到。免疫组化(IHC)方法检测MSLN表达IHC显示在B-hMSLN小鼠肺部组织中有代表性间皮素表达。用人MSLN特异性抗体(A,B)和抗兔IgG抗体(C)特异的抗体对组织进行染色。结果显示,在纯合B-hMSLN小鼠中,细胞膜上显示人MSLN阳性(数据来源于合作方)。B-hMSLN ID8基本信息蛋白表达分析通过流式细胞术对纯合B-hMSLN ID8小鼠细胞中MSLN的表达进行分析。用物种特异性抗MSLN抗体对B-hMSLN ID8培养物的单细胞悬浮液进行染色。在B-hMSLN ID8小鼠细胞的表面检测到人MSLN。B-hMSLN ID8细胞的2-A11克隆被用于体内实验。肿瘤生长曲线&体重变化B-hMSLN ID8小鼠细胞的皮下同种移植肿瘤生长。将B-hMSLN ID8细胞(5x106)和野生型ID8细胞(1x106)皮下植入C57BL/6N小鼠(雌性,6周龄,n=8)。(A)平均肿瘤体积±SEM, (B)体重(平均值±SEM),每周测量两次肿瘤体积和体重,体积以mm3表示,使用公式,V=0.5×长径×短径2。如图A所示,B-hMSLN ID8细胞能够在小鼠体内建立肿瘤,可用于药效研究。肿瘤体积&重量测量肿瘤细胞的蛋白表达分析将B-hMSLN ID8细胞皮下移植到C57BL/6小鼠体内(n=8),在接种后21天,收集肿瘤细胞并通过流式细胞术检测人MSLN的表达。如图所示,人MSLN在肿瘤细胞表面高表达。因此,B-hMSLN ID8小鼠细胞可用于新型MSLN疗法的体内药效研究。B-hMSLN MC38基本信息蛋白表达分析通过流式细胞术对B-hMSLN MC38小鼠进行种属特异性MSLN 表达分析。对 B-hMSLN MC38 培养物的单细胞悬液用种属特异性抗 MSLN 抗体进行染色。结果显示:在B-hMSLN MC38小鼠细胞表面检测到人MSLN,小鼠MSLN不表达。因此 B-hMSLN MC38细胞的1-A03克隆可用于体内实验。肿瘤生长曲线&体重变化B-hMSLN MC38小鼠细胞的皮下同种移植肿瘤生长。B-hMSLN MC38 细胞 (1x106) 和野生型 MC38 细胞 (5x105) 被皮下植入 C57BL/6 小鼠 (雌性, 6 周龄, n=8)。每周两次测量肿瘤体积和体重。(A) 平均肿瘤体积 ± SEM, (B) 体重 (平均值±SEM)。体积以 mm3 表示,使用公式:V=0.5 × 长径 × 短径2。如图 A 所示,B-hMSLN MC38 小鼠细胞能够在体内建立肿瘤,并可用于药效研究。参考文献[1] Mesothelin:An Immunotherapeutic Targetbeyond Solid Tumors. Cancers (Basel). 2022 Mar;14(6):1550.[2] Montemagno C, et al. Int J Mol Sci. 2020 Jun 6;21(11):4067.[3] Chen SH, et al. Sci Rep. 2013;3:1870.[4] Montemagno C, et al. Int J Mol Sci. 2020 Jun 6;21(11):4067.

人类白细胞抗原:HLA,通常称之为MHC分子,是在6号染色体短臂上的一类基因。除同卵双生子以外几乎找不到HLA相同者,每个人的HLA千差万别,是识别人类白细胞的重要的分子标志,是免疫系统区分本身和异体物质的基础,具有非常重要的生物学功能。HLA有不同的基因座,编码两大类MHC蛋白。HLA在医学上的意义主要体现在器官移植,输血,疾病相关性,生理学等方面。人6号染色体HLA基因结构HLA复合体有224个基因座(locus),按其产物的结构、分布与功能分为三群。HLA-I经典I类基因: HLA-A、-B、-C参与递呈内源性抗原。非经典I类基因: HLA-E、-G、-F。HLA-II经典II类基因: HLA-DP 、-DQ、-DR参与递呈外源性抗原。非经典II类基因: LMP、TAP、HLA-DM、HLA-DO 参与抗原的加工和转运。HLA-Ⅲ包括编码补体C4、Bf、C2的基因。编码炎症相关分子TNF、HSP70等基因。HLA基因结构HLA基因功能HLA-I可以提供一般细胞内的一些状况,比如该细胞遭受病毒感染,则将病毒外膜蛋白加工成肽链,通过MHC展示到细胞膜表面,供杀手CD8+ T细胞的识别,以进行扑杀。表达于所有有核细胞表面,例外的仅有神经细胞、胰岛外分泌细胞、心肌细胞和精细胞等。HLA-II可以提供细胞外部的情况,像是组织中有细菌侵入,则巨噬细胞进行吞食后,把细菌蛋白加工成肽链,通过MHC展示给辅助性T细胞,启动体液免疫反应。只位于抗原提呈细胞(APC)表面,例如:B细胞、巨噬细胞、树突状细胞、胸腺上皮细胞和人活化的T细胞等。HLA分子对T细胞在胸腺内的分化成熟过程也起重要作用。体外研究发现:去除胸腺中MHCⅡ类抗原阳性的基质细胞,则CD4+ T细胞的发育受阻,在胸腺培养细胞中加入抗MHCⅡ类抗原的单克隆抗体,也能阻止CD4+ T细胞的发育。目前认为MHC分子在T细胞自身耐受的形成和T细胞库的产生中都起着重要作用。HLA-A2.1分子HLA-A2.1是HLA I 类A基因座,第2复等位基因第1号亚型,备受科学家们的关注。关注HLA-A2.1等位基因的原因有很多,下面将介绍其中的一些原因。T细胞的免疫反应依赖于肽与HLA分子的结合,因此研究者经常研究这些分子与各种抗原的相互作用。由于HLA的高度多态性,有成千上万的HLA分子可供选择,为了获得最大的相关性,研究最常见的表达等位基因是最有意义的。HLA-A2.1的肽结合基序早已为人熟知,HLA多聚体可用于抗原特异性T细胞的染色。甚至有小鼠表达HLA-A2.1等位基因,这使得在更接近人类的生物系统中进行临床前测试成为可能。针对HLA-A2.1分子机制研究的需求,BioMice百奥动物自主研发了B-HLA-A2.1 mice和B-NDG HLA-A2.1 mice,助力HLA-A2.1分子研究,为临床前药效评估提供了优质模型。B-HLA-A2.1 mice基本信息蛋白表达分析流式细胞术检测野生型C57BL/6小鼠(+/+)和纯合型B-HLA-A2.1小鼠(H/H)的脾细胞。野生型C57BL/6小鼠可检测到小鼠B2M和H-2Kb/H-2Db。人B2M和HLA-A2.1只在B-HLA-A2.1纯合小鼠中检测到,而小鼠B2M和H-2Kb/H-2Db在B-HLA-A2.1纯合小鼠中检测不到。 野生C57BL/6 (+/+)小鼠和纯合B-HLA-A2.1小鼠 (H/H)注射抗CD3E抗体后,取脾细胞进行流式细胞术检测。结果显示:野生C57BL/6小鼠可检测到小鼠B2M和H-2Kb/H-2Db。纯合B-HLA-A2.1小鼠中只能检测到人B2M和HLA-A2.1,检测不到小鼠B2M和H-2Kb/H-2Db。脾脏白细胞亚群分析从C57BL/6小鼠和纯合B-HLA-A2.1小鼠(n= 3,8周龄,雌性)中分离脾细胞。流式细胞术分析脾细胞以评估白细胞亚群。结果表明:纯合B-HLA-A2.1小鼠的B细胞、树突状细胞、粒细胞、单核细胞和巨噬细胞的百分率与C57BL/6小鼠相似。CD8+ T细胞百分率显著降低,CD4+ T细胞百分率和NK细胞百分率显著升高,说明hB2M-HLA-A2.1-H-2D替代小鼠B2M可能影响CD8+ T细胞的发育,进而影响脾脏T细胞亚型的比例。数值用平均值±SEM表示。在淋巴结和血液中得到同样的结果。脾脏T细胞亚群分析从C57BL/6和纯合B-HLA-A2.1小鼠(n= 3,8周龄,雌性)中分离脾细胞。流式细胞术分析脾细胞以评估T细胞亚群。结果表明:纯合B-HLA-A2.1小鼠中调节性T细胞的百分率与C57BL/6小鼠相似。CD8+ T细胞百分率显著降低,CD4+ T细胞百分率显著升高,说明hB2M-HLA-A2.1-H-2D替代小鼠B2M可能影响CD8+ T细胞的发育,进而影响脾脏T细胞亚型的比例。数值用平均值±SEM表示。在淋巴结和血液中得到同样的结果。B-NDG HLA-A2.1 mice基本信息蛋白表达分析流式细胞术检测B-NDG小鼠(+/+)和纯合B-NDG HLA-A2.1小鼠(H/H)脾细胞。结果表明:小鼠B2M和H-2Kb/H-2Db在B-NDG小鼠中检测到,但在B-NDG HLA-A2.1小鼠中检测不到。人B2M和HLA-A2.1在纯合B-NDG HLA-A2.1小鼠中检测到,而在B-NDG小鼠中未检测到。脾脏白细胞亚群分析从B-NDG小鼠和B-NDG HLA-A2.1小鼠(n= 3,6周龄,雌性)分离脾细胞。流式细胞术分析脾细胞以评估白细胞亚群。结果表明:纯合B-NDG HLA-A2.1小鼠树突状细胞、粒细胞、单核细胞和巨噬细胞的百分率与B-NDG小鼠相似,表明人源化的B2M和HLA-A2.1不改变这些细胞在脾脏的整体发育、分化和分布。数值用平均值±SEM表示。在骨髓和血液中得到同样的结果。人CD34+HSC免疫重建将人CD34+造血干细胞分别植入经0.8 Gy辐照过的B-NDG HLA-A2.1新生小鼠和B-NDG小鼠。(A) B-NDG HLA-A2.1小鼠存活率略低于B-NDG小鼠,但差异无统计学意义。(B)体重。将人CD34+造血干细胞分别植入经0.8 Gy辐照过的B-NDG HLA-A2.1新生小鼠和B-NDG小鼠。流式细胞术检测人白细胞。结果表明,虽然B-NDG HLA-A2.1小鼠的人CD8+ T细胞比例明显低于B-NDG小鼠,但重建24周内人CD8+ T细胞比例仍维持在18%左右。B-NDG HLA-A2.1小鼠人CD4+ T细胞比例明显高于B-NDG小鼠。B-NDG HLA-A2.1小鼠中其他重组细胞类型的比例与B-NDG小鼠相似。参考资料1、Van Laethem, F., Tikhonova, A.N. & Singer, A. MHC restriction is imposed on a diverse T cell receptor repertoire by CD4 and CD8 co-receptors during thymic selection. Trends in immunology 33, 437-441 (2012).2、Garcia, K.C., Adams, J.J., Feng, D. & Ely, L.K. The molecular basis of TCR germline bias for MHC is surprisingly simple. Nature immunology 10, 143-147 (2009).

CCN蛋白家族是一组细胞间基质蛋白,由CCN1-6六名成员组成。除CCN5缺乏CT模块外,CCN家族蛋白均包含4个保守的串联模块:1)胰岛素样生长因子结合蛋白模块(IGFBP);2)血管性血友病因子C型重复模块(VWC);3)血小板反应蛋白1型重复模块(TSP-1);以及4)含有半胱氨酸羧基端结构的模块(CT)。典型的CCN蛋白由5个外显子编码。CCN蛋白氨基酸同源性为60%,共有38个半胱氨酸残基,这些残基在位置和数量上都严格保守。由于信号肽的存在,CCN蛋白的特点是在细胞质中表达,并以旁分泌的形式在外界环境中积累。它们的四个离散功能域决定了它们相互作用的结合配体的类型,包括不同的整合素,HSPGs、IGFs、TGFb和VEGF等,导致全长CCN蛋白具有多种生物学功能。图1 CCN蛋白结构[1]各种刺激诱导的CCN蛋白在各种细胞中被激活,可直接与细胞表面整合素、生长因子、细胞因子等ECM蛋白相互作用,这些反应诱导肌成纤维细胞的生长和衰老,导致基质重塑。图2 CCN蛋白在纤维化中的作用[2]CCN家族在生物反应和疾病中的几个主要作用:1)伤口愈合和纤维化疾病:纤维化是组织再生过程中CCN家族网络失衡的结果。促纤维化因子TGF-β通过诱导CCN1、CCN2、CCN4的表达,抑制CCN3的表达,在心脏纤维化中发挥促纤维化作用或诱导真皮成纤维细胞衰老(CCN1);2)炎症:CCN1、CCN2、CCN4被TGF-β上调,而CCN3被相同的细胞因子以相反的方式调节;3)恶性肿瘤:肿瘤微环境(TME)增加了肿瘤的复杂性,CCN蛋白可能是一个平衡TME的潜在靶点。CCN蛋白根据肿瘤类型的不同,在肿瘤发生和发展过程中起到正向或负向作用。 表1 CCN1-6在泛癌中表达水平变化[1]大部分情况下,CCN1、CCN2、CCN4通常与促进细胞增殖和肿瘤生长有关,CCN3、CCN5、CCN6则与抑制这些过程有关。而CCN蛋白最终的生物学特性可能依赖于不同的组合,在肿瘤治疗中应作用于不同组合的CCN蛋白来重新平衡TME。下面我们将重点介绍一下促肿瘤生长的CCN1、CCN2、CCN4。CCN1/CYR61肿瘤的发生发展改变了细胞外基质的组成和物理性质。基质刚度的增加对肿瘤生长和转移有深远的影响。CCN1又称富半胱氨酸蛋白61(cysteine-rich 61, CYR61),其在内皮细胞中受刚度的高度调控。在体外,刚度诱导的CCN1激活β-连环蛋白核转位和信号转导,以上调内皮细胞表面的N-钙粘蛋白水平,促进N-钙粘蛋白依赖的癌细胞-内皮相互作用。而敲除内皮细胞中的CCN1可以抑制黑色素瘤细胞与血管的结合,抑制瘤细胞通过血管转移过程。因此,靶向硬化诱导的血管改变(如CCN1)是一种潜在的、但尚未被重视的损害转移的机制。图3 肿瘤血管系统中CCN1的作用模式[3]CCN2/CTGFCCN2又称结缔组织生长因子(Connective Tissue Growth Factor,CTGF),是一种促纤维化介质。在大多数纤维性疾病中,生化或机械刺激诱导产生的CCN2与TGF-β协同促进成纤维细胞向肌成纤维细胞的表型转化。CCN2还与恶性肿瘤的侵袭有关,CCN2由肿瘤细胞产生并作用于自身,主要抑制其侵袭性表型。但由于CCN2可以通过旁分泌的方式激活血管内皮细胞和破骨细胞祖细胞,促进血管生成和骨吸收,从而又促进了肿瘤的侵袭和转移。因此,CCN2既可以成为一个促进组织再生的潜在的治疗工具,又可以成为对抗纤维化及其相关疾病,以及肿瘤转移的重要靶点。图4 CCN2在病理纤维化中的分子作用[4]CCN4/WISP-1CCN4又称Wnt1诱导的信号通路蛋白(Wnt1-Inducible Signaling pathway Proteins, WISP-1),由肿瘤细胞和基质成纤维细胞产生和分泌(蓝色箭头)。然后,分泌的CCN4可通过旁分泌和自分泌两种机制对肿瘤细胞和血管内皮细胞发挥作用(红色箭头)。CCN4能够结合到细胞外基质蛋白(如纤维连接蛋白;绿色形状),以及细胞膜上的整合素(蓝色形状),从而调节细胞与细胞外基质的相互作用。图5 CCN4作为肿瘤微环境中的自分泌和旁分泌介质[5]最新研究进展CCN1:目前针对CCN1靶点开发的药物主要是小分子药物,进展最快的是Asahi Kasei等公司的Zoledronate/Zoledronic acid monohydrate,该药物已在2000年上市,用于治疗癌症,骨关节炎,疼痛等多种疾病。目前只有一种针对CCN1的抗体药物,是罗氏公司的Mab 420/MOR-420,目前处于生物测试阶段,且并未处于活跃状态。CCN2:目前针对CCN2靶点,开发药物进展最快的是FibroGen,该公司的Pamrevlumab用于抑制结缔组织生长因子(CTGF)的活性,目前正在推进临床III期试验,适应症包括:胰腺癌、杜氏肌营养不良(DMD)和特发性肺纤维化(IPF)。同时还在进行治疗急性 COVID-19 住院患者的 II 期临床试验。该药已在美国获得孤儿药资格,用于治疗特发性肺纤维化、胰腺癌和杜氏肌营养不良症。在欧盟还指定了治疗杜氏肌营养不良症的孤儿药资格。CCN4:目前尚未有该靶点的临床在研药物。B-hCCN1 mice基本信息mRNA表达分析小鼠CCN1的mRNA仅在野生小鼠(+/+)的卵巢中检测到。人CCN1的mRNA仅在纯合B-hCCN1小鼠(H/H)中检测到,在野生小鼠中未检测到。蛋白表达分析利用western blot分析纯合B-hCCN1小鼠中种属特异性CCN1的表达。取野生C57BL/6小鼠(+/+)和纯合B-hCCN1小鼠(H/H)的脾组织,用抗CCN1抗体进行western blot分析。因为该抗体与人CCN1和小鼠CCN1有交叉反应,CCN1在野生小鼠和纯合B-hCCN1小鼠中均可检测到。B-hCCN2 mice基本信息:mRNA表达分析:小鼠CCN2的mRNA仅在野生小鼠(+/+)的肾脏中检测到。人CCN2的mRNA仅在纯合B-hCCN2小鼠(H/H)中检测到,在野生小鼠中未检测到。蛋白表达分析:利用western blot分析纯合B-hCCN2小鼠中种属特异性CCN2的表达。取野生C57BL/6小鼠(+/+)和纯合B-hCCN2小鼠(H/H)的肾组织,用抗CCN2抗体进行western blot分析。因为该抗体与人CCN2和小鼠CCN2有交叉反应,CCN2在野生小鼠和纯合B-hCCN2小鼠中均可检测到。体内药效:抗人CCN2抗体可以抑制博来霉素诱导的B-hCCN2小鼠肺部的胶原蛋白沉积。将B-hCCN2小鼠分为3组:生理盐水对照组,博来霉素处理的纤维化组以及博来霉素处理的纤维化+Pamrevlumab治疗组。(A)Pamrevlumab治疗能够改善博来霉素诱导的B-hCCN2小鼠的体重减轻。该模型中的纤维化通过总肺羟脯氨酸(HYP)的标准测量值进行评分。(B)与生理盐水对照组相比,博来霉素的诱导增加了HYP含量,而用Pamrevlumab治疗可以降低肺HYP含量。B-hCCN4 mice基本信息:mRNA表达分析:小鼠CCN4的mRNA仅在野生小鼠(+/+)的卵巢中检测到。人CCN4的mRNA仅在纯合B-hCCN4小鼠(H/H)中检测到,在野生小鼠中未检测到。蛋白表达分析:利用western blot分析纯合B-hCCN4小鼠中种属特异性CCN4的表达。取野生C57BL/6小鼠(+/+)和纯合B-hCCN4小鼠(H/H)的肾脏和脾脏组织,用抗CCN4抗体进行western blot分析。因为该抗体与人CCN4和小鼠CCN4有交叉反应,CCN4在野生小鼠和纯合B-hCCN4小鼠中均可检测到。参考文献[1] Jia Q, et al. CCN Family Proteins in Cancer: Insight Into Their Structures and Coordination Role in Tumor Microenvironment. Front Genet. 2021 Mar 23;12:649387. [2] Sun, C., et al. Emerging role of CCN family proteins in fibrosis. Journal of cellular physiology. 2021 Jun;236(6):4195-4206. [3]Reid SE, et al. Tumor matrix stiffness promotes metastatic cancer cell interaction with the endothelium. EMBO J. 2017 Aug 15;36(16):2373-2389. [4] Kubota S, et al. Cellular and molecular actions of CCN2/CTGF and its role under physiological and pathological conditions. Clin Sci (Lond). 2015 Feb;128(3):181-96. [5] Nivison MP, et al. The role of CCN4/WISP-1 in the cancerous phenotype. Cancer Manag Res. 2018 Aug 27;10:2893-2903.
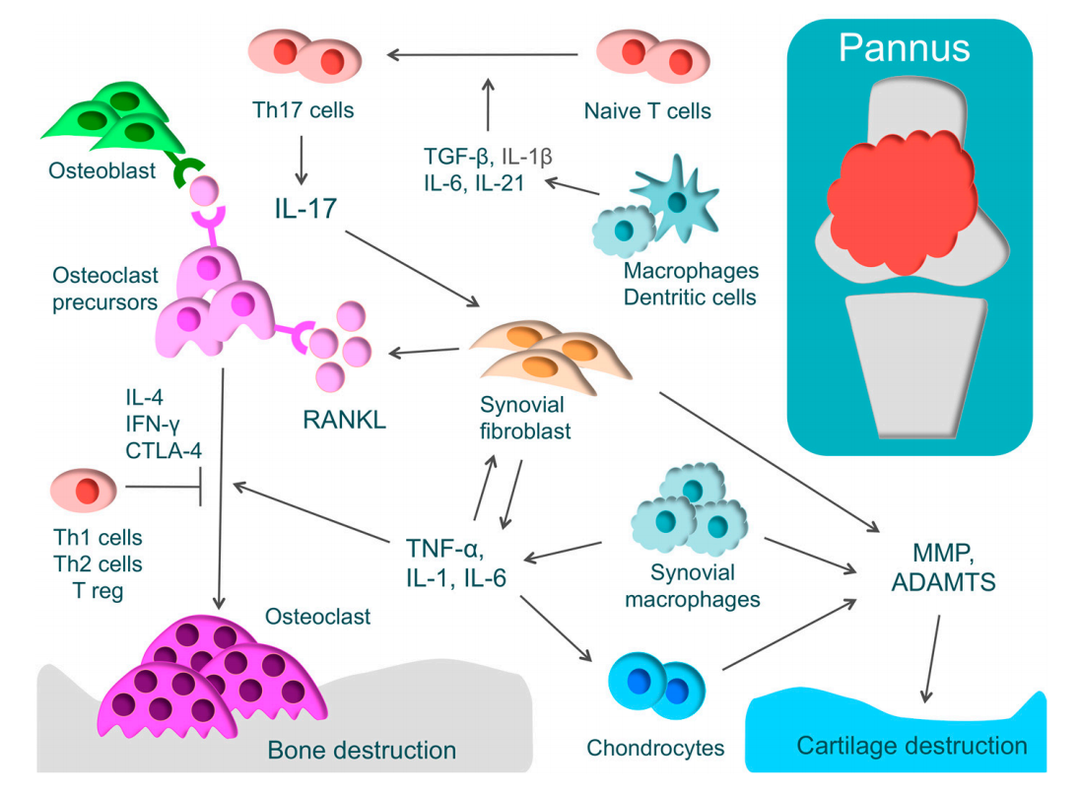
不死的癌症类风湿性关节炎(Rheumatoid Arthritis,RA)是人类最常见的自身免疫性疾病之一,其临床症状主要表现有全身关节肿胀、疼痛和运动失调等,病情极其严重的甚至可能会导致残疾。而病理主要表现出增生性滑膜炎,软骨损伤以及骨结构的破坏。为了更好的研究人类的类风湿性关节炎,研究者在小鼠上开发出多种能模拟人类类风湿性关节炎的动物模型,而这之中胶原诱导型关节炎,能最大程度反映出人类类风湿性关节炎的临床和病理特征。Rheumatoid Arthritis百奥动物在不同品系的小鼠(C57BL/6、DBA)上都建立了稳定的胶原诱导型关节炎疾病模型(Collagen-Induced Arthritis,CIA),可用于相关药物的药效评价。类风湿性关节炎 (RA) 的病理及软骨和骨破坏的机制RA 的特征是增生性滑膜(血管翳)和 T 细胞的过度免疫反应。血管翳包括 T 细胞、滑膜成纤维细胞和巨噬细胞,可产生炎性细胞因子,如肿瘤坏死因子 (TNF)-α、白细胞介素-1(IL-1)、IL-6和IL-17。相关数据展示01RA/CIA 模型介绍 临床评分利用胶原(CII)在C57BL/6小鼠中诱导关节炎模型。(A)小鼠体重变化;(B)临床评分;(C)小鼠发病率。结果显示:在造模组(G2)中,小鼠的临床评分显著增加,提示关节炎模型建立成功。 病理分析C57BL/6小鼠关节炎模型建立后的病理分析。(A)病理评分;(B)病理切片H&E染色。造模组动物全部或部分关节可见皮下混合炎细胞浸润(a),关节周围狭窄(b),踝关节和/或趾骨关节软骨和骨组织破坏(c)等关节炎病变,进一步提示关节炎模型建立成功。02C57BL/6小鼠关节炎模型用于评价甲氨蝶呤(MTX)药效 临床评分甲氨蝶呤在小鼠关节炎模型中的药效作用。(A)小鼠体重变化;(B)临床评分;(C)小鼠发病率。结果显示:在造模组(G2)中,小鼠的临床评分显著增加,表明CIA模型建立成功,同时相比于未造模组(G1),体重波动更加明显。在给于甲氨喋呤(MTX)后,治疗组(G3)的平均临床评分显著低于造模组,证明小鼠的病情得到了有效控制。另外,在发病率方面,治疗组的发病率最大值为40%,也明显低于造模组近80%的发病率,提示小分子药甲氨喋呤对该疾病具有治疗作用。 病理分析甲氨喋呤在小鼠关节炎模型中药效作用的病理分析。(A)病理评分;(B)病理切片H&E染色。病理结果显示:未造模组(G1)动物镜下未见明显异常改变,踝关节软骨表面光滑,关节腔明显(a)。造模组(G2)动物踝关节周围组织,可见皮下混合炎细胞浸润,关节滑膜炎和/或血管翳形成(c),关节软骨破坏,关节腔消失,部分骨组织融合(b)。与G2造模组相比,治疗组虽然有部分踝关节周围皮下组织水肿和炎细胞浸润(d),但其病理评分均值明显低于G2组,甲氨喋呤对动物关节炎病变具有治疗作用。03B-hIL6/hIL6R小鼠关节炎模型用于评价抗人IL6抗体sirukumab药效 临床评分抗人IL-6抗体sirukumab(内部合成)在小鼠关节炎模型中药效作用。(A)小鼠体重变化;(B)临床评分。结果显示:在模型成功建立后,治疗组(G3,G4)小鼠用sirukumab抗体进行治疗,显示出治疗作用,且表现出剂量依赖性。 病理分析抗人IL-6抗体sirukumab(内部合成)在小鼠关节炎模型中药效作用的病理分析。(A)病理切片H&E染色;(B)病理评分。结果显示:未造模组(G1)动物未见明显异常改变,踝关节软骨表面光滑,关节腔明显。造模组(G2)动物踝关节骨组织损伤(d),关节腔或关节周围腔隙消失(e),并出现血管翳(a)。与造模组相比,抗体药治疗低剂量组(G3)有部分炎细胞浸润(b)和血管翳(a)生成,并表现出滑膜增生(c)。但在抗体药治疗高剂量组(G4),仅有部分血管翳,关节炎病变基本消失,关节腔明显,提示sirukumab对小鼠关节炎具有治疗作用。04服务项目更多药效相关服务,CAIA引起的关节炎模型,骨关节炎模型,骨质疏松模型,正在研究进行中,感兴趣的欢迎联系我们获取资料。想要获取更多百奥动物自主研发的自身免疫性疾病模型信息,请访问百奥动物官网。参考文献:1. Tateiwa, D., Yoshikawa, H. & Kaito, T. Cartilage and Bone Destruction in Arthritis: Pathogenesis and Treatment Strategy: A Literature Review. Cells 8, doi:10.3390/cells8080818 (2019).2. McInnes IB, et al. Cytokines in the pathogenesis of rheumatoid arthritis. Nat Rev Immunol 7, 429-42 (2007).

银屑病(Psoriasis)是一种慢性复发性炎症性皮肤病,最常见的症状是红色发炎的皮疹或红斑,通常覆有银色鳞屑,严重影响患者的生活质量。在中国,银屑病的估计患病率为0.47%,影响超过700万患者;全球来看,至少有1.25亿人受此疾病困扰。银屑病可分为斑块型(最常见类型,占80-90%)、点滴型、脓疱型(局限性、泛发性-GPP,罕见且严重)、银屑病性关节炎等类型。自2004年起,每年的10月29日为世界银屑病日。银屑病是一种由多种致病因子(遗传、环境因素等)刺激引起的T细胞介导的针对皮肤的自身免疫病,不具有传染性。机制上,以往认为Th1通路是银屑病发病的主要原因,代表性细胞因子有TNFα、IL-12、IL-23。第一代治疗银屑病的生物制剂围绕TNFα展开,相继上市了融合蛋白、单抗等多个药物,目前仍占据着银屑病市场的主要份额。然而,TNFα抑制剂使用过程中常常会出现严重的不良反应,并且有40%的患者治疗效果不佳,再伴随着一系列生物类似药的上市,导致TNFα抑制剂面临困境和巨大的内部竞争。后来人们认识到Th17是银屑病发病的关键驱动因素。IL-17/IL-23是致病的主要因素。IL-17由Th17细胞分泌,促进其他细胞因子传递,并直接促进活化的角质细胞产生更多趋化因子。由于IL-17与银屑病发病的关联最为直接,所以抑制IL-17的药物以起效快著称。IL-23位于Th17细胞的上游,靶向IL-23的药物以其长效性闻名,但并不能完全抑制IL-17,因为除了Th17细胞外,还有其他细胞有可能产生IL-17。图1. 多种细胞因子在银屑病发病机制中的作用及其上下游关系[1] 图2. 靶向IL-23/IL-17通路的银屑病药物[2]主要银屑病上市药物 整理自科睿维安数据库这些上市药物中,不乏销售额亮眼的药物。其中,Ustekinumab单抗是第一款靶向IL-23的上市药,在获批银屑病后不断扩大适应症范围,销售额2019年已经达到66亿美元,全球排名第12,增速非常快。Secukinumab是第一款靶向IL-17的药物,全球销售额从2017年的21亿美元增长至2020年的40亿美元。同为IL-17抑制剂,礼来的ixekizumab在2020年的销售额亦增长至18亿美元。 目前,针对这些细胞因子,国内已有多款产品上市或在临床试验阶段,代表公司有恒瑞、智翔金泰、丽珠/康鑫合生、康方生物、君实生物、三生国健、荃信生物、海正药业等。 为了更好的帮助药企和生物技术公司研发银屑病药物,百奥动物研发了多种炎性细胞因子相关的人源化小鼠模型,用于候选药物的临床前体内药效检测。B-hIL17A mice品系名称:C57BL/6-Il17atm1(IL17A)/Bcgen常用名:B-hIL17A mice背景:C57BL/6货号:110053靶点别名:IL17A, CTLA-8, CTLA8, IL-17, IL-17A, IL17, ILA17, interleukin 17A 1. IL17A蛋白的种属特异性表达用ELISA方法检测野生型小鼠 (+/+)和纯合B-hIL17A小鼠(H/H)中的IL17A表达情况。结果显示小鼠IL-17A蛋白仅在野生型小鼠 (+/+)中表达,而人IL-17A蛋白仅在纯合B-hIL17A小鼠(H/H)中表达。2. B-hIL17A银屑病模型可用于抗人IL-17A抗体的体内药效评估 Ixekizumab在B-hIL17A 的IMQ银屑病模型里呈现剂量依赖的药效。10周龄B-hIL17A小鼠(H/H)去毛后,连续8天在后背皮肤上涂抹Imiquimod (IMQ)。同时,每组小鼠(雌性,10周龄,n=5)接受对照或不同剂量的ixekizumab(自制,低剂量为3mg/kg,高剂量为10mg/kg)治疗,每天记录小鼠的体重和皮肤炎症评分。并于实验终点(endpoint)收集皮肤进行分析。(A)药物治疗6天时,小鼠背部皮肤表型;(B)给药期间的小鼠体重变化;(C-E)背部皮肤的红疹评分、鳞屑评分以及综合评分。结果显示,ixekizumab可以减轻小鼠银屑病模型的临床表型。数值为平均值 ± SEM。对实验终点收集的皮肤进行苏木精-伊红染色(H&E),分析。(A)背部皮肤的H&E染色结果示意图;(B)背部皮肤病理评分;(C)小鼠表皮厚度。结果显示,ixekizumab可以减少角质细胞扩增和炎性细胞的浸润,缓解小鼠银屑病模型的皮肤炎症。数值为平均值 ± SEM。Secukinumab在B-hIL17A的IMQ银屑病模型里呈现剂量依赖的药效。B-hIL17A小鼠(H/H)去毛后,连续5天在后背皮肤上涂抹IMQ。同时,每组小鼠(雌性,8周龄,n=6)接受对照或不同剂量的secukinumab(商业化药品,低剂量为10mg/kg,高剂量为30mg/kg)治疗,每天记录小鼠的体重和皮肤炎症评分。并于实验终点收集皮肤进行分析。(A)银屑病造模(B)第0天和5天时,小鼠背部皮肤表型;(C)给药期间的小鼠体重变化;(D-F)背部皮肤的红疹评分、鳞屑评分以及综合评分。结果显示,secukinumab可以减轻小鼠银屑病模型的临床表型。数值为平均值 ± SEM。对实验终点收集的皮肤进行苏木精-伊红染色(H&E),分析。(A)背部皮肤的H&E染色结果示意图;(B)背部皮肤病理评分;(C)小鼠表皮厚度。结果显示,secukinumab可以减少角质细胞扩增和炎性细胞的浸润,缓解小鼠银屑病模型的皮肤炎症。数值为平均值 ± SEM。B-hIL17A/hIL17F mice品系名称:C57BL/6-Il17atm1(IL17A) Il17ftm1(IL17F)/Bcgen常用名:B-hIL17A/hIL17F mice背景:C57BL/6货号:120554靶点别名:IL17A, interleukin 17A, CTLA-8, CTLA8, IL-17, IL-17A, IL17, ILA17; IL17F, interleukin 17F, CANDF6, IL-17F, ML-1, ML1 1. IL17A和IL17F蛋白的种属特异性表达用ELISA方法检测野生型小鼠 (+/+)和纯合B-hIL17A/hIL17F小鼠(H/H)中IL17A和IL17F的表达情况,结果显示小鼠IL17A和IL17F蛋白仅在野生型小鼠 (+/+)中表达,而人IL-17A和IL17F蛋白仅在纯合B-hIL17A/hIL17F小鼠 (H/H)中表达。2. B-hIL17A/hIL17F银屑病模型可用于抗人IL-17A/IL-17F抗体的体内药效评估Bimekizumab在B-hIL17A/hIL17F 的IMQ银屑病模型里呈现剂量依赖的药效。B-hIL17A小鼠(H/H)去毛后,连续8天在后背皮肤上涂抹IMQ。同时,每组小鼠(雌性,10周龄,n=5)接受对照或不同剂量的bimekizumab(自制,低剂量1mg/kg,高剂量3mg/kg)治疗,每天记录小鼠的体重和皮肤炎症评分。并于实验终点收集皮肤进行分析。(A)6天治疗结束后,小鼠背部皮肤表型;(B)给药期间的小鼠体重变化;(C-E)背部皮肤的红疹评分、鳞屑评分以及综合评分。结果显示,bimekizumab可以减轻小鼠银屑病模型的临床表型。数值为平均值 ± SEM。对实验终点收集的皮肤进行苏木精-伊红染色(H&E),分析。(A)背部皮肤的H&E染色结果示意图;(B)背部皮肤病理评分;(C)小鼠表皮厚度。结果显示,bimekizumab可以减少角质细胞扩增和炎性细胞的浸润,缓解小鼠银屑病模型的皮肤炎症。数值为平均值 ± SEM。 B-hIL17RA mice品系名称:C57BL/6-Il17ratm1(IL17RA)/Bcgen常用名:B-hIL17RA mice背景:C57BL/6货号:110054靶点别名:IL17RA, CANDF5, CD217, CDw217, IL-17RA, IL17R, IMD51, hIL-17R, interleukin 17 receptor A1. IL17RA蛋白的种属特异性表达取野生型小鼠 (+/+)和杂合B-hIL17RA小鼠(H/+)的骨髓,用流式方法检测IL17RA的表达。结果显示小鼠IL17RA在野生型小鼠 (+/+)和杂合B-hIL17RA小鼠(H/+)中表达;而人IL17RA仅在杂合B-hIL17RA小鼠(H/+)中表达。 B-hTNFA mice品系名称:C57BL/6-Tnftm1(TNF)/Bcgen常用名:B-hTNFA mice背景:C57BL/6货号:110002靶点别名:TNF (tumor necrosis factor, TNFA)1. TNFα蛋白的种属特异性表达用ELISA方法检测野生型小鼠 (+/+)和纯合B-hTNFA小鼠(H/H)中的TNFα表达情况。结果显示小鼠TNFα蛋白仅在野生型小鼠 (+/+)中表达,而人TNFα蛋白仅在纯合B-hTNFA小鼠(H/H)中表达。B-hTNFA/hIL17A mice品系名称:C57BL/6-Tnftm1(TNF)Il17atm1(IL17A)/Bcgen常用名:B-hTNFA/hIL17A mice背景:C57BL/6货号:120548靶点别名:TNF (tumor necrosis factor, TNFA); IL17A (interleukin 17A) 1. TNFα和IL17A蛋白的种属特异性表达用ELISA方法检测野生型小鼠(+/+)和纯合B-hTNFA/hIL17F小鼠(H/H)中TNFA和IL17A的表达情况,结果显示小鼠的TNFA和IL17A蛋白仅在野生型小鼠(+/+)中表达,而人TNFA和IL17A仅在纯合B-hTNFA/hIL17A小鼠 (H/H)中表达。2. B-hTNFA/hIL17A银屑病模型可用于抗人TNFα x IL17A双抗的体内药效评估TNFα x IL17A双抗在B-hTNFA/hIL17A小鼠的IMQ银屑病模型里呈现剂量依赖的药效。B-hTNFA/hIL17A小鼠(H/H)去毛后,连续6天在后背皮肤上涂抹IMQ。同时,每组(雌性,10周龄,n=5)小鼠接受对照或不同剂量的TNFα x IL17A双抗(自制)治疗,每天记录小鼠的体重和皮肤炎症评分。并于实验终点收集皮肤进行分析。(A)6天治疗结束后,小鼠背部皮肤表型;(B)给药期间的小鼠体重变化;(C-E)背部皮肤的红疹评分、鳞屑评分以及综合评分。结果显示,TNFα x IL17A双抗可以减轻小鼠银屑病模型的临床表型。数值为平均值 ± SEM。对实验终点收集的皮肤进行苏木精-伊红染色(H&E),分析。(A)背部皮肤的H&E染色结果示意图;(B)背部皮肤病理评分;(C)小鼠表皮厚度。结果显示,TNFα x IL17A双抗可以减少角质细胞扩增和炎性细胞的浸润,缓解小鼠银屑病模型的皮肤炎症。数值为平均值 ± SEM。B-hIL23A/hIL12B mice品系名称:C57BL/6-Il23atm1(IL23A)Il12btm1(IL12B)/Bcgen常用名:B-hIL23A/hIL12B mice背景:C57BL/6货号:120553靶点别名:IL23A (interleukin 23 subunit alpha), IL12B (interleukin 12B)1. IL23蛋白的种属特异性表达 用ELISA方法检测野生型小鼠(+/+)和纯合B-hIL23A/hIL12B小鼠(H/H)中IL23A的表达情况,结果显示小鼠IL23A仅在野生型小鼠WT (+/+)中表达,而人IL-23仅在纯合B-hIL23A/hIL12B 小鼠(H/H)中表达。3. B-hIL23A/hIL12B银屑病模型可用于抗人IL-23A抗体的体内药效评估IL23A单抗在B-hIL23A/hIL12B小鼠的IMQ银屑病模型里呈现剂量依赖的药效。B-hIL23A/hIL12B小鼠(H/H)去毛后,连续6天在后背皮肤上涂抹IMQ。同时,每组小鼠接受对照或不同剂量的IL-23A单抗治疗,每天记录小鼠的体重和皮肤炎症评分。 (A)给药期间的小鼠体重变化;(B-D)背部皮肤的红疹评分、鳞屑评分以及综合评分。结果显示,IL-23A单抗可以减轻小鼠银屑病模型的临床表型。数值为平均值 ± SEM。 B-hIL36R mice品系名称:C57BL/6-Il1rl2tm1(IL1RL2)/Bcgen常用名:B-hIL36R mice背景:C57BL/6货号:110084靶点别名:IL1RL2, IL-1Rrp2, IL-36R, IL1R-rp2, IL1RRP2, interleukin 1 receptor like 21. IL36R蛋白表达的免疫组化分析在野生型小鼠 (+/+)和纯合B-hIL36R小鼠(H/H)建立银屑病模型后,取小鼠背部皮肤和小肠,用免疫组化方法分析IL36R的表达。由于IL36R抗体是人鼠交叉识别,所以在野生型小鼠 (+/+)和纯合B-hIL36R小鼠 (H/H)中均可以检测到IL36R的表达。箭头所指为阳性染色细胞。2. B-hIL36R小鼠银屑病模型可用于抗人IL-36R抗体的体内药效评估Spesolimab在B-hIL36R小鼠的IMQ银屑病模型里呈现剂量依赖的药效。B-hIL36R小鼠(H/H)去毛后,连续6天在后背皮肤上涂抹IMQ。同时,每组小鼠(雌性,9周龄,n=6)接受对照或不同剂量的spesolimab(商业化药品,自制,低剂量为1mg/kg,中剂量:3mg/kg,高剂量为10mg/kg)治疗,每天记录小鼠的体重和皮肤炎症评分。并于实验终点收集皮肤进行分析。(A)银屑病造模(B)第0天和6天时,小鼠背部皮肤表型;(C)给药期间的小鼠体重变化;(D-F)背部皮肤的红疹评分、鳞屑评分以及综合评分。结果显示,spesolimab可以减轻小鼠银屑病模型的临床表型。数值为平均值 ± SEM。对实验终点收集的皮肤进行苏木精-伊红染色(H&E),分析。(A)背部皮肤的H&E染色结果示意图;(B)背部皮肤病理评分;(C)小鼠表皮厚度。结果显示,spesolimab可以减少角质细胞扩增和炎性细胞的浸润,缓解小鼠银屑病模型的皮肤炎症。数值为平均值 ± SEM。百奥动物银屑病相关人源化小鼠模型总结除以上产品鼠外,还有B-hIL22/hIL22RA人源化小鼠正在开发中。 参考资料1. 银屑病靶点IL-17A,智翔金泰自免单抗再批临床,bioSeedin柏思荟2. Tsukazaki H, Kaito T. The Role of the IL-23/IL-17 Pathway in the Pathogenesis of Spondyloarthritis. International Journal of Molecular Sciences. 2020; 21(17):6401.3. Uppala, Ranjitha et al. "Autoinflammatory psoriasis"-genetics and biology of pustular psoriasis.” Cellular & molecular immunology vol. 18,2 (2021): 307-317.

医药生物行业生命科学领域产业链系列报告显示,随着科研发展与对新靶点的持续追求,基因修饰动物凭借可以精准满足用户需求的特点,正快速发展为模式动物市场主流产品。GMI 数据披露,2019 年全球基因修饰动物模型市场规模约为 100 亿美元,预计 2023 年将增至 141 亿美元,占动物模型服务市场近67%[1]。技术进步重塑市场格局,基因修饰模式动物地位日益凸显。相较于野生型的模式动物,基因修饰模式动物能够对目标基因开展功能缺失或功能获得的研究,达到人类生理或病理更精确的模拟,因此更适合探索研究人类基因功能和人类疾病致病机制,是目前行业重要的发展方向。这其中Cre工具鼠和疾病模型鼠亦扮演着举足轻重的角色。一起围观下百奥动物的蓝宝小家伙带来的好物分享吧~ 鼠界“爱德华”--Cre工具鼠系列INTRODUCTION基因敲除鼠常被用来研究基因的功能,但据研究报道,小鼠有超过30%的基因敲除后导致了胚胎致死或者出生后不久死亡[2],从而无法对该基因在体内发挥的生理功能进行更好的研究。为了解决这个问题,科学家发现了Cre/loxP系统。 1 什么是Cre/loxP系统?Cre-loxp 系统来自于P1 噬菌体,是噬菌体感染病毒实现寄生的“杀手锏”。 Cre重组酶(cyclization recombination enzyme),它是一种由343个氨基酸组成的单体蛋白,可以引发loxP位点的DNA 重组。loxP是一段长34bp的DNA序列,是Cre重组酶识别的位点,被称为loxP位点。Cre重组酶的调控方式有多种多样,有如特异性基因启动子调控的Cre(Promoter-regulated Cre)、配体或药物诱导的Cre(Inducible Cre)、荧光报告的Cre(Fluorescent Cre)以及同时被不同启动子调控的Cre(Split Cre,NCre 和CCre)等。不同调控方式的选择造就了不同的Cre工具鼠。 2 Cre/loxP系统在基因编辑大小鼠中的应用根据Cre-loxp 系统工作的原理,在基因编辑大小鼠中,分别制作Cre重组酶工具大小鼠和带有loxp位点的flox鼠,通过杂交可以实现组织特异性基因敲除,这样可以避免全身性敲除引起的纯合致死情况。你是不是也正在经历实验设计选不到合适Cre鼠的窘境?百奥动物自主开发了一系列Cre工具鼠,助力不同应用场景的科学研究。B-Pgr-iCre小鼠基本信息应用领域生殖系统功能研究表型分析ROSA26-CAG-LSL-tdTomato mice是公司自主研发并验证成功的tdTomato报告小鼠品系。在与Cre小鼠交配后,剔除stop元件,可表达tdTomato红色荧光蛋白。本实验方案利用B-Pgr-iCre mice与CAG-LSL-tdTomato报告小鼠交配,iCre重组酶可介导子代小鼠中表达Pgr的细胞删除LSL元件,表达tdTomato红色荧光蛋白,荧光显微镜下可观察到红色荧光信号,可证明表达Pgr的细胞成功表达iCre重组酶并介导基因重组功能。上图为小鼠不同器官中实验结果的显示,(a)代表小鼠的生殖系统,包括子宫、输卵管和卵巢。(b)代表小鼠的乳腺。IF 检测 tdTomato 红色荧光蛋白和绿色荧光标记 Pgr(progesterone) 的表达。纵轴代表不同基因型的小鼠,横轴代表不同的荧光标记。B-Pgr-iCre(Mut/+);CAG-tdTomato(Mut/+) 小鼠表现出明显的 tdTomato 红色荧光蛋白表达。B-Cdh5-iCreERT2 mice小鼠基本信息应用领域心血管系统,肿瘤和细胞分化机制研究表型分析ROSA26-CAG-LSL-tdTomato mice是公司自主研发并验证成功的tdTomato报告小鼠品系。在与Cre小鼠交配后,剔除stop元件,可表达tdTomato红色荧光蛋白。本次实验中B-Cdh5-iCreERT2 mice与ROSA26-CAG-LSL-tdTomato mice交配,可实现Cdh5-iCreERT2(Mut/+);CAG-LSL-tdTomato(Mut/+)双阳性小鼠在tamoxifen诱导下,在血管淋巴管内皮细胞特异性表达tdTomato红色荧光蛋白。上图为双阳性小鼠主要器官中 tdTomato 和 CD31 的免疫荧光图像。CD31是内皮标记物。(比例尺:25 μm)百奥动物Cre工具鼠产品列表向上滑动查看列表 高能“cosplay”--疾病模型鼠系列INTRODUCTION疾病动物模型是研究人类疾病机制、诊断预后标志物发现、药物筛选和评价等的重要支撑条件。利用基因工程技术对基因进行修饰,可建立敏感动物品系和与人类疾病相同的疾病模型进行药物筛选和药效研究,这类动物可培育为稳定遗传的品系,且具有特定的病理特征,已经成为药物快速筛选的重要手段。百奥动物建立了丰富的疾病模型资源,为疾病治疗药物评价提供稳定有效的模型资源,并能够基于此为广大合作伙伴提供符合国际水平的药理药效服务。血友病模型--B-F8 KO 小鼠F8又称AHF,FVIII(coagulation factor VIII),是位于X染色体上编码凝血因子VIII的基因,在外源性和内源性凝血途径中都不可或缺。它作为凝血因子IXa的辅助因子参与凝血过程,同时借助于Ca2 +和膜磷脂,形成复合物以激活X因子,并进行一系列后续的凝血反应。F8基因的缺失导致严重的凝血障碍,形成伴X染色体隐性遗传的A型血友病。F8基因敲除模型为血友病患者的药物筛选提供了重要的临床前借鉴意义。模型数据验证将实验动物随机分组,分别尾静脉注射给予生理盐水或1mg/kg诺其,给药30min后腹主动脉采血检测血凝指标:活化部分凝血活酶时间 APTT。结果显示:F8 KO小鼠APTT值远高于WT小鼠,给予重组人凝血因子VIIa后,APTT恢复至正常值。结果证明:B-F8 KO小鼠可以作为抗凝血药药效验证的有力工具。高血糖和肥胖症模型--B-ob/ob 小鼠瘦素(Leptin)是由肽链构成的肽类激素。主要由脂肪细胞分泌,其表达主要在白色脂肪组织。此外,在心肌、骨骼肌、胎盘、肺、乳腺上皮和胃黏膜等均有表达。在功能上能够有抑制食欲,增加能量消耗,抑制脂肪合成促进其分解。胰岛素可促进瘦素的分泌,反过来瘦素对胰岛素的合成、分泌发挥负反馈调节。ob是瘦素的编码基因,百奥动物利用基因编辑技术将ob基因2、3号外显子敲除制备的B-ob/ob小鼠,具有肥胖症和高血糖症状,是研究高血糖和肥胖症的有力模型。模型数据验证纯合B-ob/ob小鼠4周龄后体重和血糖(-/-)均持续高于对照组。抗人GCGR抗体药物crotedumab在B-ob/ob小鼠体内的药效。(A)B-ob/ob小鼠的体重变化。(B-C)非空腹血糖和空腹血糖测量。将8-10周龄的雄性B-ob/ob小鼠随机分为2组,每组6-7只。给药组第0天进行给药,第0、3、7天测定非空腹血糖,禁食6小时后测定空腹血糖。(D)Crotedumab可改善葡萄糖耐量。(E)血糖含量曲线下面积。小鼠在自由取水的条件下禁食6h,尾尖取血测定空腹血糖(0 min),腹腔注射葡萄糖2 g/kg,在指定时间测定血糖。(F-G)胰高血糖素和胰岛素测量。结果显示,crotedumab在禁食和非禁食状态下均具有降糖作用,同时能够改善B-ob/ob小鼠的葡萄糖耐量。百奥动物疾病模型鼠产品列表百奥动物可提供多种稳定优质的基因编辑自发疾病动物模型,如肿瘤模型鼠(B-p53 KO 小鼠,B-p53 KO大鼠),高血糖模型鼠(B-ob/ob小鼠),凝血模型鼠(B-F8 KO小鼠,B-F9 KO小鼠)等,提供客户用于相关研究。向上滑动查看产品列表意犹未尽?想要共享蓝宝的更多好物清单,欢迎扫描下方二维码查看或者来电咨询。参考资料:[1]https://mp.weixin.qq.com/s/rhhEFL5A9KhVKAULO29COw[2]Huimin Zhang, Qi Zheng, Ruby Yanru Chen-Tsai;Establishment of a Cre-rat resource for creating conditional and physiological relevant models of human diseases. Transgenic Res. 2021 Feb;30(1):91-104
近年来,免疫治疗在抗肿瘤治疗中的作用备受关注,基于免疫治疗的新药开发和标志物探索,成为了当前肿瘤研究的热点,这也对临床前研究动物模型的建立提出了更高的要求。即可以模拟人肿瘤特征又同时存在“人源化”免疫系统的免疫重建小鼠模型,成为了免疫肿瘤研发中的优质模型。百奥动物B-NDG小鼠缺乏成熟的T、B、NK细胞,是目前国际公认的免疫缺陷程度高、适合人源细胞或组织移植的工具小鼠。将人的免疫细胞、造血干细胞移植到B-NDG及B-NDG衍生小鼠中构建的免疫系统重建小鼠,能够更好的模拟人的免疫系统,进行免疫学研究和免疫药物评价。但在使用重度免疫缺陷小鼠进行PBMC和CD34+ HSC免疫重建时会面临一些常见问题,如PBMC重建后的T细胞会对小鼠自身细胞进行攻击导致严重的xeno-GvHD反应;CD34+ HSC重建后的NK细胞和髓系细胞重建比例不足。我们以B-NDG小鼠为基础分别开发了可延缓xeno-GvHD反应和可促进髓系细胞发育的二代系列小鼠,以满足特定细胞功能研究和相应靶点药物评价的需求。减轻GvHD反应,延长实验窗口期B-NDG MHC I/II DKO mice plus 不表达MHC I/II 类分子B-NDG小鼠、B-NDG B2m KO plus小鼠和B-NDG MHC I/II DKO plus小鼠进行人PBMC重建后GvHD严重程度的比较 第0天将3个健康供体的人PBMCs (5E6)静脉注射B-NDG小鼠、B-NDG B2m KO plus小鼠和B-NDG MHC I/II DKO plus小鼠(雌性,5周龄,n=5)中。A.用Kaplan Meier生存曲线分析小鼠存活率。B.体重变化。GvHD临床体征每周评分两次。结果表明:B-NDG MHC I/II DKO plus小鼠可显著延缓GvHD发生,并降低GvHD严重程度。因此B-NDG MHC I/II DKO plus小鼠更适合将人PBMC移植到免疫缺陷小鼠模型。B-NDG B2m KO mice plus B-NDG小鼠、B-NDG B2m KO plus进行人PBMC重建后GvHD严重程度的比较将3个健康供体的2E6人PBMC静脉注射B-NDG B2m KO plus小鼠(雌性,11周龄,n=5)和B-NDG小鼠(雌性,10周龄,n=6)中。GvHD临床体征每周评分两次。结果表明:在人PBMC诱导的GvHD模型中,B-NDG B2m KO plus小鼠比B-NDG小鼠生存期明显延长,B-NDG B2m KO plus小鼠可延缓GvHD的发病并减轻其严重程度。促进髓系细胞重建B-NDG MGMT3 mice 人源化IL3, CSF2, CSF1, THPO 基因未经辐照的B-NDG MGMT3小鼠进行人CD34+HSC重建将人CD34+HSC造血干细胞(3E4)静脉注射B-NDG小鼠和B-NDG MGMT3小鼠(出生后24-72h,n=15)。B-NDG小鼠给予1.0 gy辐照,B-NDG MGMT3小鼠不辐照。流式细胞分析两种小鼠进行人CD34+HSC免疫重建后的外周血淋巴细胞。结果表明:未经辐照的B-NDG MGMT3小鼠的CD45+细胞比例从移植后12周开始达到25%,并持续上升,明显高于B-NDG小鼠。B-NDG MGMT3小鼠单核细胞、MDSCs、DCs和Treg的比例高于B-NDG小鼠。(注:A面板第18周数据因流式细胞检测问题无意义。)B-NDG hCSF1/hTHPO mice 未经辐照的B-NDG hCSF1/hTHPO小鼠进行人CD34+HSC重建将人CD34+HSC细胞(0.15 M)静脉注射到纯合B-NDG hCSF1/hTHPO小鼠(雌性,6周龄,n=15)。流式细胞术分析人CD34+HSC免疫重建后小鼠外周血淋巴细胞。结果显示:未经辐照的B-NDG hCSF1/hTHPO小鼠成功重建了T、包括B、NK、髓系细胞、单核细胞和中性粒细胞在内的人多系细胞。免疫缺陷动物产品列表
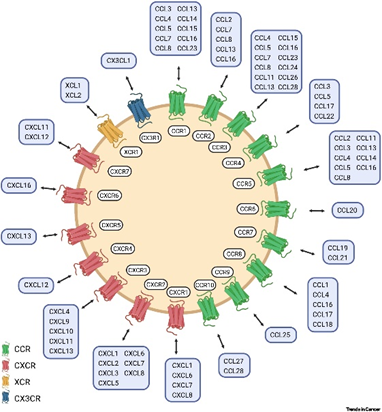
导读趋化因子是一类分子量小的细胞因子,其主要作用是在稳态和病理条件下募集白细胞亚群,又被称为趋化性细胞因子。根据其主要蛋白质结构的前两个半胱氨酸(C)残基的位置,将趋化因子分为 C 、CC 、CXC 和 CX3C 趋化因子四大亚家族,其主要负责参与调控机体的器官发育、免疫监视、宿主防御和组织更新等生理过程。趋化因子也可以根据其表达和功能分为炎性趋化因子和稳态趋化因子。炎症性细胞因子在炎症部位迅速分泌,从而将效应细胞募集到发炎组织中;而稳态趋化因子在生理条件下组成性表达并在细胞迁移和归巢中发挥作用,因此趋化因子在协调炎症及正常状态下的体内细胞群定位中发挥核心作用。 图1.趋化因子配体与受体[1]趋化因子受体表达于细胞表面,是与G蛋白偶联的7次跨膜蛋白,趋化因子就是与受体结合后传递细胞信号的,故受体根据其结合的趋化因子亚家族来命名,如 XCR、CCR、CXCR、CX3CR 等。这些受体负责调控多条细胞信号通路,如调动肌动蛋白聚合、细胞骨架重排、粘着斑组装和解聚,此外也在细胞存活等生命活动中发挥着重要作用。图2.趋化因子信号通路图[2]此外,趋化因子还参与多种癌症发展过程,如血管生成、转移、癌细胞增殖、干性和侵袭性,是疾病进展的关键决定因素,对治疗反应和患者预后有很大影响。由于它们在癌细胞和免疫浸润细胞中重要的调节功能,使得趋化因子配体及其受体成为非常强大的治疗靶点。趋化因子的靶向治疗目前,国内外已有多家药企开启了针对趋化因子及其受体的药物开发,其中临床已批准的靶向趋化因子的药物包括:2012年上市的抗CCR4抗体(Mogamulizumab)和2007年上市的CXCR4拮抗剂(Maraviroc)等,用于治疗恶性血液瘤。此外,还有更多的针对不同趋化因子受体-配体轴作为癌症治疗策略的多种努力,这些治疗策略目前已表现出巨大的潜力,正处于临床开发中。数据来源于科睿唯安趋化因子及其受体对于维持机体稳态具有重要意义。然而一旦趋化因子活性失控,则会导致慢性炎症和自身免疫性疾病。针对一系列疾病靶点的研究机理,BioMice百奥动物自主开发了CCR家族靶点人源化小鼠,包括CCR1-CCR9,可以为该靶点药物的开发提供有效的临床前药效评价工具,助力靶向药物研究。B-hCCR1 mice基本信息 蛋白表达分析 通过流式细胞术检测野生型C57BL/6和纯合B-hCCR1小鼠中CCR1的蛋白表达。收集野生型C57BL/6和纯合B-hCCR1小鼠的腹腔巨噬细胞,并用种属特异性抗CCR1抗体进行流式细胞术分析。结果显示:鼠CCR1仅在野生小鼠中检测到,人CCR1仅在纯合B-hCCR1小鼠中检测到。 B-hCCR2 mice基本信息 蛋白表达分析 通过流式细胞术检测野生型C57BL/6和纯合B-hCCR2小鼠中CCR2的蛋白表达。收集野生型C57BL/6和纯合B-hCCR2小鼠的骨髓,并用种属特异性抗CCR2抗体进行流式细胞术分析。结果显示:鼠CCR2仅在野生小鼠中检测到,人CCR2仅在纯合B-hCCR2小鼠中检测到。 B-hCCR3 mice基本信息 蛋白表达分析 通过流式细胞术检测野生型C57BL/6和纯合B-hCCR3小鼠中CCR3的蛋白表达。收集野生型C57BL/6和纯合B-hCCR3小鼠的骨髓,并用种属特异性抗CCR3抗体进行流式细胞术分析。结果显示:鼠CCR3仅在野生小鼠中检测到,人CCR3仅在纯合B-hCCR3小鼠中检测到。 B-hCCR4 mice基本信息 蛋白表达分析 通过流式细胞术检测野生型C57BL/6和纯合B-hCCR4小鼠中CCR4的蛋白表达。收集野生型C57BL/6和纯合B-hCCR4小鼠的脾细胞,并用种属特异性抗CCR4抗体进行流式细胞术分析。结果显示:鼠CCR4仅在野生小鼠中检测到,人CCR4仅在纯合B-hCCR4小鼠中检测到。 B-hCCR4小鼠的T细胞能与抗人CCR4抗体结合通过流式细胞术(FACS)分析B-hCCR4小鼠的T细胞结合抗人CCR4抗体的能力。收集B-hCCR4 小鼠的脾细胞(雌性,6周龄),使用FACS检测T细胞与抗人CCR4抗体(内部合成)的结合。结果显示:与同型对照相比,B-hCCR4小鼠的T细胞可以很好地结合抗人CCR4抗体。 B-hCCR5 mice基本信息 蛋白表达分析 通过流式细胞术检测野生型C57BL/6和纯合B-hCCR5小鼠中CCR5的蛋白表达。收集野生型C57BL/6和纯合B-hCCR5小鼠的腹腔冲洗液,并用种属特异性抗CCR5抗体进行流式细胞术分析。结果显示:鼠CCR5仅在野生小鼠中检测到,人CCR5仅在纯合B-hCCR5小鼠中检测到。 B-hCCR6 mice基本信息 蛋白表达分析 通过流式细胞术检测野生型C57BL/6和纯合B-hCCR6小鼠中CCR6的蛋白表达。收集野生型C57BL/6和纯合B-hCCR6小鼠的脾细胞,并用种属特异性抗CCR6抗体进行流式细胞术分析。结果显示:鼠CCR6仅在野生小鼠中检测到,人CCR6仅在纯合B-hCCR6小鼠中检测到。B-hCCR7 mice基本信息蛋白表达分析 通过流式细胞术检测野生型C57BL/6和纯合B-hCCR7小鼠中CCR7的蛋白表达。收集野生型C57BL/6和纯合B-hCCR7小鼠的脾细胞,并用种属特异性抗CCR7抗体进行流式细胞术分析。结果显示:鼠CCR7仅在野生小鼠中检测到,人CCR7仅在纯合B-hCCR7小鼠中检测到。 B-hCCR8 mice基本信息 蛋白表达分析 人CCR8在纯合B-hCCR8小鼠肿瘤中CD4+ T细胞和Treg细胞均可检测到,但在脾细胞和血细胞中不能检测到。鼠CCR8在野生型小鼠的肿瘤中可检测到,脾细胞中弱表达,而在血细胞中不表达。血常规检测 收集野生型C57BL/6和B-hCCR8小鼠的外周血进行血常规检测(n=8,雌性,9周龄),结果显示:B-hCCR8小鼠的各指标与野生C57BL/6小鼠无明显差异,表明CCR8的人源化未改变血细胞的组成及形态。血生化检测收集野生型C57BL/6和B-hCCR8小鼠的血清进行血生化检测(n=8,雌性,9周龄),结果显示:B-hCCR8小鼠的各指标与野生C57BL/6小鼠无明显差异,表明CCR8的人源化未影响小鼠的肝、肾功能及脂肪代谢能力。 抗人CCR8抗体药效验证 抗人CCR8抗体在B-hCCR8小鼠接种MC38模型和B-Tg(hCCL1) MC38模型中均有较好的抑瘤效果。TILs分析显示:抗人CCR8抗体给药组(G2、G4)与未给药组(G1、G3)相比,总的Tregs和hCCR8+ Tregs的比例显著性降低。 B-hCCR9 mice基本信息 蛋白表达分析 通过流式细胞术检测野生型C57BL/6和纯合B-hCCR9小鼠中CCR9的蛋白表达。收集野生型C57BL/6和纯合B-hCCR9小鼠的胸腺细胞,并用种属特异性抗CCR9抗体进行流式细胞术分析。结果显示:鼠CCR9仅在野生小鼠中检测到,人CCR9仅在纯合B-hCCR9小鼠中检测到。趋化因子受体及其配体的相互作用非常复杂,尽管面临挑战,但目前还是有大量针对不同趋化因子受体的抑制剂正在临床前研究或临床试验阶段,可以相信未来趋化因子受体抑制剂将在调节TME的组成并优化患者的免疫反应方面发挥重大作用,为肿瘤患者带来更多希望。参考文献[1] Märkl, F., Huynh, D., Endres, S. & Kobold, S. Utilizing chemokines in cancer immunotherapy. Trends in Cancer 8, 670–682 (2022)[2] R&D Systems.lnc.The Chemokine Superfamily: Critical Regulators of Homeostasis & Inflammation,2019
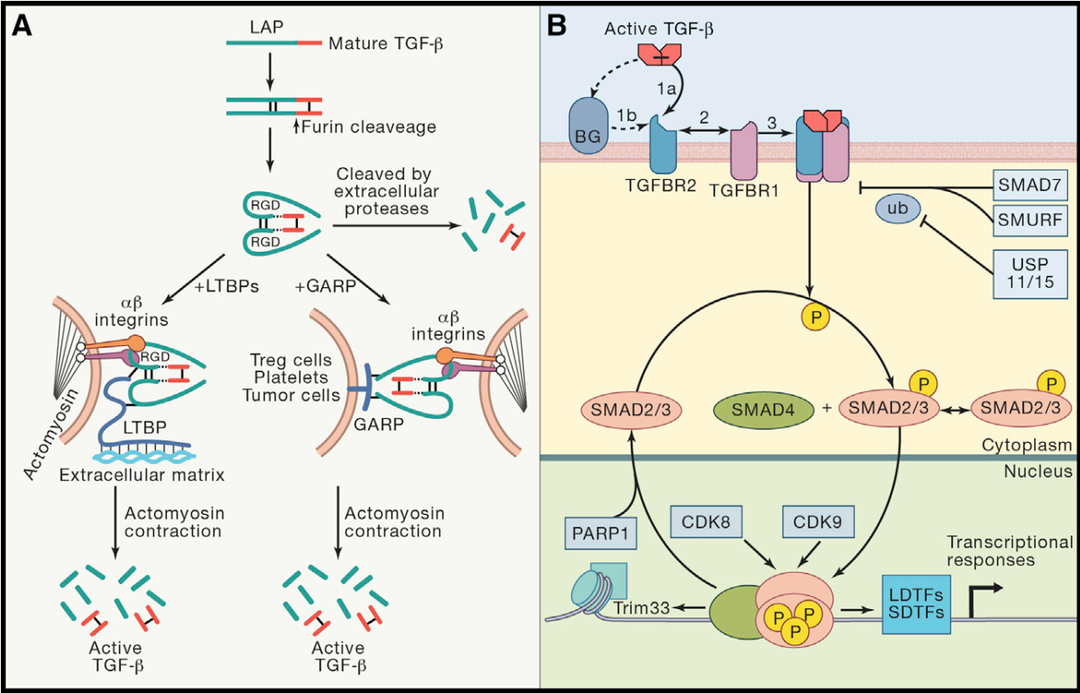
转化生长因子β(TGFβ)是一种多功能的细胞因子,对细胞增殖、分化、粘附、迁移和凋亡具有多重功能。多种类型细胞均可分泌,最早从人血小板中鉴定。哺乳动物中表达三种类型TGFβ:TGFβ1、TGFβ2和TGFβ3,每种由不同的基因编码,并通过结合相同的TGFβ受体发挥相应功能。其中TGFβ2和TGFβ3在胚胎发育中发挥重要作用,而TGFβ1则主要参与控制出生后的免疫反应[1]。三种TGFβ起初均表达为非活性蛋白复合物(SLC或LLC)。TGFβ1同型二聚体与潜伏相关肽(Latent Associated Peptide, LAP)(TGFβ1 N 端具有的长 20~30 个氨基酸的序列)形成的复合被称为小潜复合物 (Small Latent Complex, SLC)。在细胞外,SLC 与 潜伏TGFβ1结合蛋白(Latent TGFβ Binding Protein, LTBP)结合形成的复杂复合物被称为大潜复合物(Large Latent Complex, LLC)。TGFβ的活化有以下3种途径:1)SLC在胞外被蛋白酶水解;2)LLC被细胞外基质铆钉,进而由αβ整合素介导释放有活性的TGFβ;3)SLC被细胞表面的GARP铆钉,并由αβ整合素介导释放有活性的TGFβ。接下来,具有活性的TGFβ与TGFβRII二聚体结合,随后进一步与TGFβRI二聚体结合,形成四聚体,激活下游信号通路,调节基因表达。图1. TGFβ信号通路[2,3]稳态条件下,TGFβ1信号不仅调节多种组织细胞的生长、增殖和分化;也指导免疫系统的耐受和炎症抑制,尤其在胃肠道起重要作用。TGFβ1调节功能的多样性赋予了它在肿瘤发生和发展中亦正亦邪的双面性。在癌症发生早期,TGFβ是一个抑癌因子,可发挥细胞周期阻滞作用,阻断细胞从G1期进入S期,达到抑制肿瘤细胞增殖的作用。然而,随着炎症加剧,一些癌细胞可能会发生突变,使其对TGFβ信号通路不响应,或响应与凋亡脱钩、反变为促进癌细胞转移和定植。同时,肿瘤细胞亦可大量分泌TGFβ1发挥免疫抑制功能,抑制T、B淋巴细胞与NK细胞活化和分化,造成机体免疫功能障碍,使得肿瘤细胞免疫逃逸(图2)。图2. TGFβ的抑癌和促癌信号[2]针对TGFβ信号通路的在研药物主要包括配体抗体、配体陷阱(如bintrafusp alfa)、受配体抗体、小分子激酶抑制剂等,主要聚焦于肿瘤免疫疗法[4]。目前,处于临床阶段的TGFβ1配体抗体药物如下表所示:数据整理自Cortellis数据库为了更好的助力靶向TGFβ1的新药研发,百奥动物自主研发了TGFβ1人源化小鼠B-hTGFB1 mice,用于靶向TGFβ1药物的临床前药效评估。B-hTGFB1 mice 图3. RT-qPCR分析B-hTGFB1小鼠和野生型小鼠的TGFB1 mRNA的表达。B-hTGFB1小鼠中人TGFB1 mRNA表达量与野生型小鼠中的鼠TGFB1 mRNA表达量类似。这表明人TGFB1基因原位替换不影响TGFB1 mRNA的表达。图4. 利用流式细胞仪分析纯合B-hTGFB1小鼠和野生型小鼠的血小板中TGFB1蛋白的种属特异性表达。小鼠的TGFB1仅在野生型小鼠中被检测到,人TGFB1仅在纯合B-hTGFB1小鼠中检测到。脾脏中TGFB1蛋白的表达同样也具有种属特异性(数据未展示)。TGFB1人源化不影响脾脏、淋巴结、血液中白细胞各亚群比例(数据未展示)。图5. 抗体结合实验。从B-hTGFB1小鼠和野生型小鼠取血,用流式细胞术分析血小板人LAP的表达。SRK-181可特异性结合SLC并抑制TGFβ1活化[5]。于是,在SRK-181处理过的纯合B-hTGFB1小鼠和野生型小鼠中均能检测到人LAP的表达;而未处理的鼠中不能检测到人LAP的表达。(hLAP抗体可人鼠交叉识别。)图6. 抗鼠PD-1抗体和抗人TGFβ1抗体联用在B-hTGFB1小鼠中的抗肿瘤作用。(A)mPD-1和hTGFβ1抗体(自制)联用可抑制B-hTGFB1小鼠中MC38肿瘤的生长;(B)治疗期间的体重改变。数值为平均值±SEM。由图可见,抗鼠PD-1抗体和抗人TGFβ1抗体联用可有效控制B-hTGFB1小鼠中的肿瘤生长,说明B-hTGFB1小鼠是TGFβ1抗体药物临床前评估的有力模型。相关产品列表 品系货号B-hTGFB1 mice112245B-hTGFBR2 mice110874B-hGARP mice110102B-hGARP/hTGFB1 mice112241B-hLRRC33 mice110757B-Tgfβ1 cKO mice110164参考资料1. Stockis, J., Dedobbeleer, O. & Lucas, S. Role of GARP in the activation of latent TGF-β1. Molecular bioSystems 13, 1925-1935 (2017).2. Batlle, Eduard, and Joan Massagué. “Transforming Growth Factor-β Signaling in Immunity and Cancer.” Immunity vol. 50,4 (2019): 924-940. doi:10.1016/j.immuni.2019.03.0243. Kelly, Aoife et al. “Regulation of Innate and Adaptive Immunity by TGFβ.” Advances in immunology vol. 134 (2017): 137-233. doi:10.1016/bs.ai.2017.01.0014. Kim, Byung-Gyu et al. “Novel therapies emerging in oncology to target the TGF-β pathway.” Journal of hematology & oncology vol. 14,1 55. 6 Apr. 2021, doi:10.1186/s13045-021-01053-x5. Martin, Constance J et al. “Selective inhibition of TGFβ1 activation overcomes primary resistance to checkpoint blockade therapy by altering tumor immune landscape.” Science translational medicine vol. 12,536 (2020): eaay8456. doi:10.1126/scitranslmed.aay8456

经历新冠近四年,疫情仍然以星星之火的态势影响着国内外。近两年来,全球研发企业与投资机构的目标几乎都投向了承担着“事前预防”角色的疫苗企业,但此刻亦有许多医药巨头正在悄然行动,在“事后补救”的抗纤维化赛道上积极布局。其中不乏 Boehringer Ingelheim、Genentech、BMS、Roche(Promedior)这些国际大厂,也有 FibroGen、Pliant Therapeutics、Galecto、Blade Therapeutics 等生物技术公司[1]。医药巨头的关注无疑是对领域未来机会的认可。目前,全球仅上市吡非尼酮(抑制TGF-β1的生成和减少血管因子的合成)和尼达尼布(血管生成因子抑制剂)两款药物,但两款药物因其安全性不佳,并且药效有限,仅仅可以延缓病人的纤维化进展,靶点和机理等药理学内容模糊。因此,以 Pfizer 和 Gilead 为代表的跨国制药巨头,已逐渐将新药开发战略重心转移至抗纤维化药物领域中,以满足巨大的市场需求。不是癌症的癌症--纤维化纤维化(Fibrosis)其实是多种类型组织损伤尤其是在慢性炎症性疾病过程中,组织修复反应失调的结局。纤维化几乎发生在所有器官和组织中,例如心、肝、肺、肾、皮肤等,长期以来,人们一直认为纤维化不可逆,但临床前模型和临床试验均表明,它是一个高度动态变化的过程。当组织受到损伤时,多种来源的肌成纤维细胞可通过重塑细胞外环境来启动伤口愈合反应,以恢复组织完整性并促进实质细胞的替换。通常,当组织愈合时,这个促纤维化程序被关闭。然而,持续的损伤和损害会导致这一过程的失调,导致细胞外基质(ECM )蛋白在病理上的过度沉积,并伴随着肌成纤维细胞活性的上调,造成巨噬细胞和免疫细胞浸润的慢性炎症环境。在这种细胞环境中,细胞因子和生长因子被大量释放,包括转化生长因子-β(TGF-β)家族成员和 Wingless/Int-1(Wnt1),它们是纤维化过程的主要效应子。TGF-β 和 Wnt1 结合其干细胞表面受体,并发起下游信号转导,最终分别导致 Smad2/3 和 CBP/β-Catenin 转录调节物的核易位。这导致靶基因表达上调,其功能进一步增强肌成纤维细胞分化和 ECM 蛋白(包括胶原、层粘连蛋白和纤维连接蛋白)的产生和分泌。随着过多 ECM 沉积的进行,基体的结构发生变化并变硬。细胞通过细胞表面整合素受体(激活 Hippo 信号转导通路及其主要下游效应子 YAP 和 TAZ)的机械传导感受 ECM 张力。在另一个前向循环中,激活的 YAP 和 TAZ 转位到胞核,促进包括 CTGF 和 PDGF 在内的促生长基因的上调,这些基因通过 PI3K/AKT/mTOR 通路促进肌成纤维细胞的增殖和活化。纤维化损伤过程[2]常见的与纤维化有关的疾病有:特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)、肝硬化、慢性肾病、心肌梗死、心力衰竭以及非酒精性脂肪肝炎(NASH)等。纤维化还影响肿瘤侵袭和转移、慢性移植物排斥和许多进行性肌病的发病机制。除器官损伤外,纤维化还与癌症进展有关,因为纤维化 ECM 可刺激细胞增殖并改变细胞极性,从而促进肿瘤发育和生长。抗纤维化的应用领域广泛且机制具有一定的共性,因此专注于抗纤维化药企的平台技术具有通用性,目前各家企业的重心一般集中于抗肺纤维化、肝纤维化、肾纤维化、心血管纤维化以及皮肤、视网膜纤维化等领域,其中,领先企业往往先从IPF以及肝纤维化开始,然后进行延展。由于体外药效无法模拟真实体内纤维化环境,抗纤维化药物筛选只能使用漫长的体内试验来进行,几乎所有的新药筛选捷径,包括人工智能,都无法加快抗纤维化药物的研发进程。因此,临床前动物模型在药物研发过程中显得尤为重要,百奥动物自主研发了相应的肝纤维化和肺纤维化模型,为该领域临床前药效评价提供了稳定有效的工具,助力抗纤维化药物研究。肝纤维化模型四氯化碳(CCl4)诱导的肝纤维化四氯化碳(CCl4)诱导的小鼠肝纤维化是被广泛接受的研究肝纤维化实验模型。它在许多方面反映了与毒性损伤相关的人类疾病模式,如α-SMA表达、星状细胞活化和关键基质成分(包括胶原蛋白-1、基质金属蛋白酶及其抑制剂TIMPs)已在该模型的发病机制中得到证实。CCl4诱导肝纤维化模型的建立及组织学评价四氯化碳 (CCl4) 诱导的肝纤维化模型。8周龄雄性 C57BL/6 小鼠腹腔注射浓度为0.25、0.5和0.75 mL/kg的CCl4,每周2次。4、6和8周后小鼠的体重、肝重/体重和血液生化数据如上图。使用CCl4 诱导6周的肝纤维化模型。(A) H&E染色的代表性图片显示 CCl4 诱导后肝脏炎症增加。比例尺:50 μm。(B) 免疫组化的代表性图片,显示肝巨噬细胞(kupffer cells)标记物F480。(C-D) 天狼星红染色的代表性图片,显示肝纤维化增加。比例尺:200 μm。(E-F) 免疫组织化学的代表性图片显示肝脏中的成纤维细胞标志物α-SMA水平。比例尺:300 μm。 奥贝胆酸(OCA)在小鼠肝纤维化模型中的药效验证奥贝胆酸(OCA)治疗后肝纤维化减轻。(A) 图为经CCl4 诱导和 OCA 处理3周后,天狼星红染色显示肝纤维化的代表性图片。(B) 图表示天狼星红染色统计数据。数值为平均值±SEM。*p < 0.05。胆管结扎诱导的肝纤维化胆管结扎引起肝外胆道梗阻,从而导致胆管扩张和胆汁淤积。当胆管内压力进一步升高时,肝内胆管扩张破裂,肝内血管被扩张的胆管和外渗的胆汁同时压迫,肝细胞缺血坏死,纤维组织增生,围绕肝小叶向肝细胞周围扩散,最终可导致肝纤维化。胆管结扎诱导肝纤维化模型的建立胆管结扎肝纤维化模型。(A) 图表示血清中ALT、AST、ALP、GGT和TBIL水平。 (B) 图表示BDL后4周肝脏代表性外观。数值为平均值±SEM。*p<0.05, ***p<0.001, ****p<0.0001。胆管结扎所致肝纤维化模型的组织学评价胆管结扎4周后H&E和天狼星红染色。(A) 图表示H&E染色代表性病理改变。(B) 图天狼星红染色代表性图片显示肝纤维化增加。(C) 图表示胶原纤维阳性信号区比例。数值为平均值±SEM。* p < 0.05。胆管结扎4周后免疫组化染色。 (A-B) 免疫组化染色的代表性图像显示 F4/80 和阳性信号区比例。(C-D) 免疫组化染色代表性图像显示α-SMA水平和阳性信号区比例。硫代乙酰胺(TAA)诱导的肝纤维化模型硫代乙酰胺 (TAA) 是一种广泛用于模拟肝纤维化发病机制中产生损伤的化合物。TAA 通过其代谢产物硫代乙酰胺二氧化硫 (TASO2) 增加活性氧 (ROS) 的形成,引起严重的氧化应激以及脂质过氧化和蛋白质羰基和 DNA 加合物的生成。产生的ROS,引起肝星状细胞 (HSC) 活化,同时诱导造血干细胞转分化为肌纤维母细胞样细胞,导致 EMC 合成和降解失衡及持续纤维化过程。TAA诱导肝纤维化模型的建立及组织学评价TAA 诱导肝纤维化模型4周。(A-B) 血清中 ALT 和 AST 水平。(C) H&E染色的代表性图片。(D-E) 免疫组化染色的代表性图像显示α-SMA水平和阳性信号区比例。(G-F) 天狼星红染色的代表性图像显示肝纤维化增加。TAA 诱导肝纤维化模型6周。(A-B) 血清中 ALT 和 AST 水平。(C) H&E染色的代表性图片。(D-E) 免疫组化染色代表性图像显示α-SMA水平和阳性信号区比例。(F-G) 天狼星红染色的代表性图片,显示肝纤维化增加。肺纤维化模型博来霉素(BLM)诱导的肺纤维化小鼠模型博来霉素 (BLM) 能够引起与接受化疗患者相似的组织学肺模式,是目前诱导动物肺纤维化应用最广泛的药物之一。BLM 通过裂解DNA、诱导炎症反应和增加上皮凋亡剂量发挥其细胞毒性作用,从而刺激肺损伤并导致纤维化。 肺纤维化小鼠模型的建立及组织学评价博来霉素诱导的肺纤维化。C57BL/6J 小鼠在第0天给予博来霉素,每天记录体重,实验结束时收集肺组织,测定肺内羟脯氨酸 (HYP)。 (A) 博来霉素导致体重减轻。 (B)存活率缩短。 (C) HYP 含量增加。 (D) 病理学检查显示显著肺纤维化。 Pamrevlumab 在肺纤维化模型(B-hCCN2小鼠)中的药效验证Pamrevlumab 对博来霉素诱导的体重减轻的影响。B-hCCN2 小鼠在第0天给予博来霉素,然后每两天注射一次 Pamrevlumab 或溶剂,共7次,每天记录体重。实验结果表明,Pamrevlumab治疗能够改善博来霉素诱导的 B-hCCN2 小鼠体重减轻,并可有效降低博来霉素诱导的死亡率。Pamrevlumab 对博来霉素诱导的肺纤维化的影响。 (A) 博来霉素诱导 HYP 含量增加,Pamrevlumab 治疗降低了肺中 HYP 含量。(B) Masson 染色和H&E染色的代表性图像。(C) 条形图显示了纤维化严重程度的定量平均评分。数值为平均值±SEM,n = 4-8,单因素 ANOVA 和 Dunnett 检验,***P < 0.001,**P < 0.01。Micro-CT在肺部疾病模型的研究应用博来霉素诱导肺纤维化模型—直方图、体积根据不同HU区间进行正常、低通气、不通气区域体积的分割。在第4周,结果显示低通气和不通气区域的比例都很高,然后在第10周和第16周之间明显减少,而在正常通气的区域,则呈现相反的趋势[3]。通过使用Micro-CT对小鼠肺部区域进行扫描重建成像,利用肺部分析算法(Hounsfield单位阈值范围分别为-434至-121HU和-120至121HU)实现对通气不良和非通气不良区域的影像区分,从而实现对肺部区域动态检测,并进行功能和结构的评价。量化的影像数据也能提供纵向研究的信息以减少动物之间的变异性,可以更进一步验证体外数据。百奥动物可以提供的模型及检测指标令人期待的未来突破勃林格殷格翰作为肺纤维化治疗领域的全球市场领导者,在这个存在高度未满足医疗需求的领域成功而大胆迈出的第一步是前文所说的尼达尼布(BI BF1120),而今年2月BI 1015550也已经被美国食品药品监督管理局(FDA)授予突破性治疗认定。勃林格殷格翰未来将启动一项III期临床试验,以进一步研究BI 1015550治疗IPF和进行性肺纤维化(PPF)患者的疗效,并希望能尽快让该药物惠及全球患者[4]。Pliant Therapeutics,Inc.是一家临床阶段的生物制药公司,致力于发现和开发用于治疗纤维化的新型疗法。今年7月,Pliant Therapeutics 也公布了其INTEGRIS-IPF IIa期试验积极结果,其药品PLN-74809在患有特发性肺纤维化(IPF)患者身上达到主要与次要终点,呈现剂量相关疗效,并具有良好的耐受性。2021年2月,北京泰德制药与美国Graviton Bioscience Corporation 签订治疗纤维化创新药TDI01海外授权合作协议,首付款及研发、销售里程碑付款最高可达 5.175亿美元。近年来,随着企业临床及各方面的不断推进、纤维化的细胞和分子机制不断被阐明,且新冠疫情后人们对于抗纤维化重视加深,叠加肿瘤赛道的逐渐拥挤,抗纤维化治疗领域被开发的价值不断体现。我们也期待早日拥有更多创新药物用于改善病患生活质量。参考来源:[1] https://mp.weixin.qq.com/s/L8QVMXsh_8-Kk1-iKbeQVA[2] Nie X , Qian L , Sun R , et al. Multi-organ proteomic landscape of COVID-19 autopsies - ScienceDirect[J]. Cell, 2021.[3] Song Shengren,Fu Zhenli,Guan Ruijuan et al. Intracellular hydroxyproline imprinting following resolution of bleomycin-induced pulmonary fibrosis.[J] .Eur Respir J, 2022.[4] https://mp.weixin.qq.com/s/EwbXZN77rPwapjFYdRexVQ
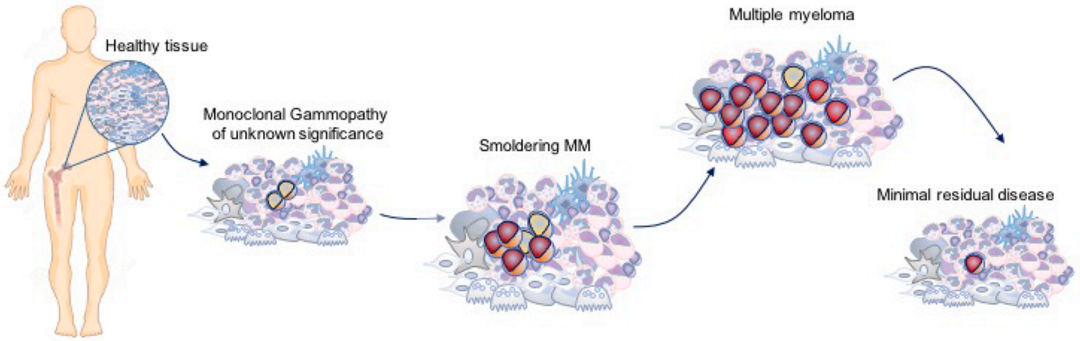
多发性骨髓瘤(Multiple Myeloma, MM)是全球第二大常见的恶性血液肿瘤,始于骨髓中健康的浆细胞恶性增殖。在当前是一种较难治愈的疾病,大多数患者终将复发。据统计,2020年全球有超过17万人被诊断出患有多发性骨髓瘤,60岁以上老人属于该病的高发群体,发病年龄亦有呈年轻化的趋势。随着我国人口老龄化趋势上升,多发性骨髓瘤的防治负担将逐年加剧,成为危害人们身体健康的一大挑战。多发性骨髓瘤从癌前到有明显疾病症状的演变过程,在SMM阶段的早期发现和早期干预以及预防或治疗策略可能是提高这种复杂疾病治愈率的途径。[1] 左图:正常的骨髓 ,右图:多发性骨髓瘤;多发性骨髓瘤中可见大量恶性浆细胞,其特征是在细胞核附近的细胞质内有一个苍白的区域。[2]目前,针对MM的治疗药物有糖皮质激素、细胞毒性药物、免疫抑制剂、蛋白酶抑制剂、单抗和细胞疗法等。其中,免疫治疗已经在许多癌症领域被证明是革命性疗法,但由于MM存在免疫抑制微环境现象,影响了免疫治疗的疗效,导致其对MM的治疗进展较为缓慢。MM细胞与骨髓(BM)微环境之间的相互作用,对MM的发病起着关键作用,可通过诱导或分泌细胞因子促进肿瘤细胞生长、免疫逃逸及耐药,增加Treg细胞的数量,抑制效应T细胞的杀伤等。靶向特定肿瘤抗原或逆转具有免疫抑制作用的骨髓微环境的免疫疗法可以帮助改善MM的标准治疗方案。骨髓MM微环境中的抗骨髓瘤作用[3]细胞重定向BiAb和BiTE同时结合MM细胞上的骨髓瘤特异性抗原和T细胞上的CD3。MM抗原包括BCMA, CD38, CS1/SLAMF7, GPRC5D和FcRH5,如图示。BiAbs或自然杀伤细胞衔接器(NKCEs)也靶向自然杀伤(NK)细胞相关受体抗原(如CD16A, NKG2D, NKp30),激活NK细胞并增强其抗MM活性。双特异性分子,包括双特异性抗体(BsAbs)和双特异性T细胞衔接器(BiTEs),通过同时结合MM细胞和免疫效应细胞上的抗原,使这些细胞靠近从而促进免疫细胞裂解MM细胞。靶向BCMA和GPRC5D的BsAbs已展示出很好的临床疗效,针对FcRH5的早期临床试验结果也非常有前景。这些药物的免疫调节作用不依赖主要组织相容性复合体(MHC) I类的抗原提呈,可在没有共刺激的情况下发生,适用于免疫系统功能失调的MM患者。BCMA01全称B细胞成熟抗原,又名CD269或TNFRSF17,属于肿瘤坏死因子受体超家族成员,仅高表达于浆细胞表面,部分表达于浆细胞样树突状细胞,是MM免疫治疗的理想靶点。针对BCMA靶点开发的肿瘤免疫疗法主要分为3类:嵌合抗原受体T细胞疗法(CAR-T)、双特异性抗体(BsAb)、抗体药物偶联物(ADC)。GPRC5D02全称G蛋白偶联受体C57家族亚型D,为7次跨膜蛋白,高表达于浆细胞表面,低表达于毛囊区域,其他健康细胞则不表达,为治疗MM的潜在候选靶点。GPRC5D的表达与BCMA不相关,联合靶向这两个靶点的疗法可以发挥互补效应或开发双靶点CAR-T、双抗。FcRH503又称FcRL5、CD307或免疫球蛋白超家族受体易位相关蛋白2 (Immunoglobulin Superfamily Receptor Translocation Associated 2, IRTA2),是一种功能未知的膜蛋白,只表达于B细胞系,包括骨髓瘤细胞。临床前研究的数据表明,FcRH5/CD3双抗可成功激活T细胞,诱导细胞因子产生,并清除恶性浆细胞。根据科睿唯安数据库检索,靶向MM相关靶点药物研究数量众多,部分靶点研究进展情况见下表。强生的Darzalex是在2015年第一批被批准用于MM治疗的免疫疗法,这一时期MM的抗体药研发主要集中在靶向CD38靶点;到2020年GSK研发的首个靶向BCMA药物Blenrep在美获批,2021年BMS的Abecma上市,今年传奇生物的Carvykti上市以及强生的Teclistamab作为全球首个CD3/BCMA双抗获批即将上市,另外还有众多管线处在临床前或临床试验阶段,靶向BCMA赛道的药物研发可谓相当火热。布局靶向MM治疗药物的新靶点,避免同质化竞争,或许也不失为后来者开发该适应症药物以占得先机的上策,当然面临的风险也随之提高。部分药物研究进展整理自科睿唯安数据库及网络百奥动物利用基因编辑技术自主开发了MM相关靶点人源化小鼠及细胞系,助力抗体药物临床前研究。部分数据展示如下:B-hCD38 mice蛋白表达分析采集野生型C57BL/6小鼠和纯合B-hCD38小鼠的脾细胞和血液,用种特异性抗CD38抗体进行流式细胞术分析。小鼠CD38在WT小鼠中检测到。纯合B-hCD38中只检测到人CD38,而WT小鼠检测不到人CD38。药效验证将小鼠T淋巴细胞瘤B-hCD38-luc E.G7-OVA细胞经尾静脉注射到B-hCD38纯合小鼠(雌性,6周龄,n=6)体内。当总通量达到约106 Ig时,将小鼠分组,并用抗人CD38抗体对其进行治疗。(A) 抗人CD38抗体(内部合成)抑制B-hCD38-luc E.G7-OVA小鼠肿瘤生长。(B) 治疗期间体重变化。(C) B-hCD38-luc E.G7-OVA细胞的体内荧光素酶成像图。每周2次测量信号强度和体重,第0、3、7、10天行影像学检查。值表示为平均值±SEM。B-hBCMA micemRNA表达分析RT-PCR分析野生型C57BL/6小鼠和B-hBCMA小鼠BCMA基因特异性表达情况,鼠Bcma mRNA仅在野生型C57BL/6小鼠脾细胞中检测到,人BCMA mRNA仅在纯合B-hBCMA小鼠中检测到。B-hGPRC5D micemRNA和蛋白表达分析(A) RT-PCR分析野生型C57BL/6小鼠和B-hGPRC5D小鼠GPRC5D基因的特异性表达情况,鼠Gprc5d mRNA仅在野生型C57BL/6小鼠睾丸中检测到。人GPRC5D mRNA仅在纯合B-hGPRC5D小鼠中检测到。(B) 取野生型C57BL/6小鼠和纯合B-hGPRC5D小鼠的脾脏,用抗GPRC5D抗体进行western blot分析。由于抗体的交叉反应性,GPRC5D在WT小鼠和纯合B-hGPRC5D小鼠中均可检测到。 相关产品列表 更多数据信息,欢迎联系我们。参考资料[1] https://doi.org/10.1016/j.ctrv.2021.102284[2] https://www.cancer.net/cancer-types/multiple-myeloma/introduction[3] doi: 10.3389/fonc.2022.1032775[4] doi:10.3390/jcm9072166