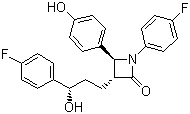
依替米贝(依折麦布)原料及片(3+6) 药品名称:依替米贝,依折麦布 英文名称:Ezetimibe 化学名称:1-(4-氟苯基)-3(R)-[3-(4-氟苯基)-3(S)-羟丙基]-4(S)-(4-羟苯基)-2-吖丁啶(氮杂环丁烷)酮 性状: 本品为白色或类白色片。 剂型及规格:依折麦布片:10mg 适应症:原发性高胆固醇血症。 申报类别:根据《药品注册管理办法》的有关规定,申报属化药注册分类3+6。 申报信息:目前无仿制申报信息 产品特点: 依折麦布是默克与先灵葆雅公司合作研发的新型调血脂药,是他汀类药物问世15年以来首个完全创新作用机制的调脂药物,该药于2002年11月在德国和美国首次上市。现已通过我国国家食品药品监督管理局批准上市。 胆固醇吸收抑制剂——依折麦布(Ezetimibe),是一类全新的降胆固醇药物。众所周知,人体内的胆固醇主要有两种来源,一种来源是肠道内吸收膳食和胆汁中的胆固醇,另一种来源是肝脏和外周组织中产生的胆固醇。肠道内吸收的胆固醇大约2/3,来源于胆汁,1/3来自膳食。他汀类药物的主要作用途径是抑制肝脏中的胆固醇合成,而第一个胆固醇吸收抑制剂——依折麦布,则是通过选择性地抑制胆固醇在肠道中的吸收而发挥作用。 依折麦布的半衰期为22小时,每天服用10mg,可以抑制胆固醇吸收平均达54%,可使LDL-C降低18%左右。 依折麦布与辛伐他汀组成的复方制剂----VYTORIN,已于2004年7月23日经美国食品和药物管理局(FDA)正式批准上市,用于单纯他汀治疗不能控制达标和/或已开始接受他汀和依折麦布治疗的高脂血症患者。目前,该药已在超过40个国家广泛应用,有四种剂型,即每片含有10mg依折麦布和不同剂量的辛伐他汀(分别为10 mg、20 mg、40 mg和80 mg)。 市场情况: 依折麦布(ezetimibe)是一类新型降胆固醇药物,是一种选择性胆固醇吸收抑制剂,主要阻断胆固醇的外源性吸收途径。它通过作用于胆固醇转运蛋白抑制肠道内胆固醇的吸收。并且,依折麦布几乎不通过细胞色素P450酶代谢,不影响他汀类药物浓度,二者合用不会发生有临床意义的药物间的相互作用,安全性和耐受性良好。他汀类药物与依折麦布联合应用可以分别从胆固醇的内、外源性途径对血脂水平进行调节以达到最佳疗效。已有临床研究显示:依折麦布单独使用对胆固醇水平降低的幅度不大,但与他汀类药物合用时,显示出显著的协同作用,可减少他汀类药物的使用量,减少不良反应的发生率。 随着社会经济的的持续发展,人们的生活水平不断提高,饮食水平也在不断改善,然而人们的血脂水平也在随之升高。国内开展的许多有关血脂的流行病学研究证实,中国高脂血症的发病率保守估计为7%到8%,而实际平均发病率可能达到10%以上,全国有超过一亿的人口需要接受调脂治疗。资料显示,目前全球患有高胆固醇的患者中,其中35%的人知道自己的病情,但只有12%的人接受治疗,大多数的高胆固醇患者并未接受到适当的治疗。 随着人们对健康的日益关注,降胆固醇药品将越来越有发展潜力,预估全球仅他汀类药物的市场已超过180亿美元,并以每年20%的速率增加。2007年全球销售额前200名的处方药中,有八项降胆固醇药品,总销售额为214.5亿美元,排名各类用药之首。 知识产权状况:依折麦布有化合物专利,专利到期:2014年。 国内生产及研制情况: 国内有进口药品:MSP SINGAPORE COMPANY LLC公司 依折麦布片:10mg 依折麦布辛伐他汀片:依折麦布10mg+辛伐他汀10/20/40mg 研发进度:已开发完毕,待申报。 并提供下列杂质 SCH60969/SCH61348 SCH209549 SCH483429 SCH59566 SCH57871 SCH483421

替加环素原料及粉针(3+6) 药品名称:替加环素 英文名:Tigecycline 化学名:(4S,4aS,5aR,12aS)-4,7-双(二甲氨基)-9-[(叔丁基氨基)乙酰胺基]-3,10,12,12a-四羟基-1,11-二氧代-1,4,4a,5,5a,6,11,12a-八氢并四苯-2-甲酰胺 剂型及规格:冻干粉针,50mg/瓶 适应症: 替加环素被批准用于18 岁及18 岁以上复杂皮肤和皮肤结构感染或者复杂腹内感染患者的治疗。包括复杂阑尾炎、烧伤感染、腹内脓肿、深部软组织感染及溃疡感染。另外本品的新适应症——社区和医院获得性肺炎正在审批过程中。 用法用量: 推荐初始剂量为100mg,维持剂量为50mg,每次静脉滴注时间应大于30 到60 分钟。治疗复杂皮肤和皮肤结构感染或者复杂腹内感染的推荐疗程均为5~14 天。具体要看感染的严重程度和感染的部位。 原研厂: 惠氏(Wyeth)公司。惠氏公司于2004 年12 月份分别向美国、欧盟、加拿大和澳大利亚的药品管理局递交了替加环素的新药上市申请。美国FDA于2005 年1 月28 日给予替加环素新药申请优先审评地位,于2005 年6 月17 日批准惠氏的替加环素(Tigecycline,商品名Tygacil 注射用替加环素)上市,欧盟于2006年5 月批准上市。 申报类别: 根据《药品注册管理办法》的有关规定,申报3+6类。 产品特点 1. 抗菌谱广 临床研究表明,替加环素可用于大肠埃希氏杆菌,粪肠球菌 (仅万古霉素敏感株),金黄色葡萄球菌 (甲氧西林敏感和耐药株),无乳链球菌,咽峡链球菌属(包括咽峡链球菌,咽峡链球菌中间型和星群链球菌),脓性链球菌和脆弱拟杆菌,费氏柠檬酸杆菌, 阴沟肠杆菌, 大肠埃希氏杆菌, 产酸克雷伯菌, 肺炎克雷白菌, 粪肠球菌 (仅万古霉素敏感株), 金黄色葡萄球菌 (仅甲氧西林敏感株), 咽峡链球菌属 (包括咽峡链球菌,链球菌中间型和星群链球菌), 脆弱拟杆菌, 多形拟杆菌,单形拟杆菌, 普通拟杆菌, 产气荚膜梭菌, 微小消化链球菌等引起的成人腹内感染(cIAI)和复杂皮肤及其软组织感染(cSSSI)。 2. 不易产生耐药性 研究表明,替加环素能克服限制很多抗生素使用的两种主要耐药机制:外排泵和核糖体保护。因此,替加环素适用范围会更广。 3. 半衰期长 单次用药半衰期约27 小时,多次用药半衰期约42 小时。因此,每12 小时用药一次,使用比较方便。 4. 用量较小 参考惠氏临床试验数据,给予替加环素(初始剂量100mg,维持剂量50mg,每12h),对照组静脉注射万古霉素联合氨曲南(1g/2g,每12h)或亚胺培南/西司他汀(“泰能”200~500 mg/200~500mg[按照体重和肌酐清除率],每6h给予维持量),疗程相近,两组比较,疗效相当,替加环素甚至较好,但无统计学差异。替加环素用量极低。 国内生产及研制情况: 国内多家按照3.1申报,但在原研惠氏产品上市前,均未获得临床批件,原已申报现全部退回,需重新按照3+6类申报。 市场情况: 临床研究数据表明,替加环素具有广谱抗菌的作用,且能有效地对抗耐药性细菌尤其是耐甲氧西林的金黄色葡萄球菌(Methicillin-Resistant Staphylococcus aureus 简称 MRSA)感染。另据ECCMID所提供的一项对重症监护病房感染的研究数据显示,替加环素对大多数常见的包括耐药菌株在内的分离病原菌(除铜绿假单胞菌外)的感染具有很好的疗效。基于此,替加环素毫无疑问地将成为超级抗生素。 目前,尽管市场中已有几种抗菌药物可用来治疗耐药性细菌感染,如辉瑞公司的利奈唑烷、King公司的奎奴普丁+达福普汀的复方制剂和Cubist公司新近被批准上市的达托霉素。但这几种药物与细菌耐药发展的汹汹势头相比还显得远远不够,而且,长期使用利奈唑烷可能会导致骨髓抑制,于是耐受性问题限制了其使用。奎奴普丁+达福普汀的复方制剂仅有注射一种给药途径,这为其医院外治疗带来了不便;此外,这些药物并非对所有的耐药菌株有效。根据ECCMID的数据显示,单一使用替加环素对全球重症监护病房的住院患者常见的感染具有广谱抗菌疗效。 由于我国抗生素滥用的情况非常严重,细菌耐药性的不断增强,治疗严重感染的市场逐步扩大,同类的进口药物价格昂贵,而传统的万古霉素毒副作用大,市场上急需一种新的高效低副作用抗菌药,替加环素有望填补这个空白,成为抗严重感染的一支生力军。替加环素集抗菌谱广,不易产生耐药性,使用方便,不良反应少而且轻等诸多优势于一身,具有极好的市场推广基础,市场潜力极大。 知识产权情况:该药在国内有制备专利、晶型专利,无化合物及适应症专利。 研发进度:已开发完毕,待申报。 提供各种替加环素报批所需杂质。 合作方式:面议。

罗氟司特 技术转让 罗氟司特原料及片(3+3) 药品名称:罗氟司特 英文名:roflumilast 化学名称:3-(环丙基甲氧基)-N-(3,5-二氯吡啶-4-基)-4-(二氟甲氧基)苯甲酰胺 性状: 本品为白色或类白色片。 剂型及规格:罗氟司特片0.5mg 适应症:适用于治疗在严重COPD伴慢性支气管炎和加重史患者中减低COPD加重的风险。 申报类别:根据《药品注册管理办法》的有关规定,申报,属化药注册分类3+3类。 申报信息:目前无仿制申报信息 产品特点: 罗氟司特是一种口服选择性磷酸二酯酶4(PDE4)抑制剂,已被证明能够以一种新型作用模式抑制COPD相关性炎症。罗氟司特为每日一次片剂,是针对重症COPD新型治疗的第一个药物。也是为COPD患者专门开发研制的首个口服抗炎治疗药物。 GOLD指南指出:Ⅲ期患者、严重COPD 或IV期、极重度COPD和慢性支气管炎和病情恶化病史,罗氟司特能够减少糖皮质激素口服治疗引起的病情加重。这些效应也见于罗氟司特加入长效支气管扩张剂。4项大型随机安慰剂对照试验表明,当在一线维持治疗方案中添加罗氟司特时,能显著缓解COPD病情恶化并改善肺功能。 罗氟司特通常耐受性良好。在纳入12000名患者的临床COPD试验中,最常见的不良反应为腹泻(5.9%)、体重下降(3.4%)、恶心(2.9%)、腹痛(1.9%)、头痛(1.7%)。这些不良反应大多轻微或中度,且主要发生在治疗的第一周,但大部分在后续的治疗过程中均能被解决。 2009年,瑞士奈科明制药公司完成了罗氟司特的Ⅲ期临床试验后,取得了良好的结果。并在欧洲递交了上市申请,公司也计划尽快在美国申请这种药物。奈科明已与ForestLab签订合作协议,ForestLab付出6亿美元的代价,获得了在美国销售Daxas的权益,并负责罗氟司特在美国FDA审报的申请与推广销售。而奈科明将保留药物在欧洲和全球其他地区的销售权。罗氟司特作为首只磷酸二酯酶IV抑制剂,其上市将成为该类药物创新上的一大突破。Nycomed公司2010年7月6日宣布,欧盟已批准其罗氟司特(roflumilast,Daxas)上市用于慢性阻塞性肺疾病(COPD)的治疗。本品为选择性磷酸二酯酶4(PDE4)抑制剂,是十多年来首次获得欧盟批准的新一类COPD治疗药物。 市场及经济效益预测: 慢性阻塞性肺病(COPD)是一种进行性和威胁生命的肺病,为人类健康“杀手”之一,它使患者呼吸困难,丧失活动能力。这种疾病通常包括慢性支气管炎和肺气肿。据估计,全世界约有2.1亿人患有这种疾病,预计到2020年,COPD将成为全球第三大死亡因素。根据美国国家心脏、肺和血液研究院的结论,吸烟是COPD的主要致病因素。在美国有1200万名患者,另外可能有1200万人患有这种疾病而未被诊断。在美国,众多“健康杀手”中,COPD位列第四。 该药物属选择性4型磷酸二酯酶(PDE-4)长效抑制剂,有抗炎作用,用于减少COPD发作频率和症状加重。去年6月欧盟批准其用于严重的COPD和慢性支气管炎,在欧盟国家,其商品名为Daxas。3月1日,美国FDA批准其用于严重的COPD治疗,在美国的商品名为Daliresp。 目前,在COPD患者中进行了多项大型国际化多中心随机的安慰剂对照试验,为期6个月或12个月。证明罗氟司特每日500微克能改善肺功能,并减少较严重的COPD发作或频繁发作。以沙美特罗或噻托溴铵治疗重度COPD,能够改善患者肺功能,减少病情发作。相对于吸入制剂,罗氟司特的优点是,它是一种口服片剂,只需要每天服用1次。 罗氟司特由Forest公司开发并生产。罗氟司特的核准获批将使其在COPD治疗市场叱咤风云。 知识产权状况:本品在国内化合物专利为CN1046939C,2014年到期。 研发进度:已开发完毕,待申报。 提供各种报批所需杂质。
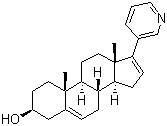
阿比特龙 技术转让 阿比特龙原料及片(3+3) 药品名称:阿比特龙 英文名:Abiraterone 化学名称:17-(3-吡啶基)雄甾-5,16-二烯-3beta-醇 剂型及规格:片剂,250mg/片 适应症:适用于治疗前列腺癌。 申报类别:根据《药品注册管理办法》的有关规定,申报,属化药注册分类3+3类。 申报信息:目前无仿制申报信息 产品特点: 阿比特龙是一种雄激素生物合成抑制剂,抑制17α-羟化酶/C17,20-裂解酶(CYP17)。在睾丸,肾上腺,和前列腺肿瘤组织中表达此酶和为雄激素生物合成所需。通过抑制甾(类)17α-羟化酶/C17-20裂解酶(P450c17)来阻止睾酮生成。可以降低肿瘤标志物——PSA水平,这为那些已采用药物治疗或经手术切除而肿瘤仍继续增长的前列腺癌患者带来了曙光。 在其I、II期临床药物试验中,醋酸阿比特龙对于进展型去势抵抗前列腺癌患者有着非常显著的抗癌效果。II期临床研究的多中心结果显示,本品具有用作一线激素治疗失败的晚期前列腺癌患者的二线激素疗法以及基于多西他赛的化学疗法治疗失败的晚期前列腺癌患者的二线疗法的潜力。 在III期药物临床试验中,近1200名在先前治疗过程中已经接受过多烯紫杉醇化疗的晚期前列腺癌患者参加,每天两次服用强的松以及试验药物(醋酸阿比特龙)或安慰剂。在平均一年的随访之后,试验组的总体存活率要显著高于安慰剂组,平均存活时间比安慰剂组长4个月。在PSA再次升高时间、无疾病进展存活率和PSA反应率等次要观测终点指标中,试验组仍然有着显著的优势。证明了利用醋酸阿比特龙抑制雄激素生成可以提高接受过化疗的去势抵抗型晚期前列腺癌患者的总体存活率,延长患者的寿命。 市场情况: 前列腺癌是老年男性较多见的恶性肿瘤,在欧美国家发病率很高,北欧各国前列腺癌的发病率占男性癌肿的第一位,美国占第二位。在我国前列腺癌的发病率要低得多,不过,近年来有逐渐增加的趋势。 开发上市情况: 醋酸阿比特龙由英国癌症研究院和BTG合作开发用于前列腺癌和其他睾酮相关疾病的治疗。本品的全球开发和商业化权已转让给Cougar Biotechnology公司。 2011年4月28日,美国食品药品监督管理局(FDA),通过本申请为优先审评程序批准其用于前列腺癌的治疗。 2011年9月5日,获得欧盟批准上市,用于前列腺癌的治疗。 知识产权状况: 活性药物成分在我国无专利。 研发进度:已开发完毕,待申报。 提供各种报批所需杂质。 合作方式:面议。

阿格列汀 技术转让 阿格列汀原料及片(3+3) 药品名称:阿格列汀 英文名:Alogliptin benzoate 化学名称:2-[[6-[(3R)-3-氨基-1-哌啶基]-3,4-二氢-3-甲基-2,4-二氧代-1(2H)-嘧啶基]甲基]苯甲腈苯甲酸盐 剂型及规格:片剂,25mg/片 适应症:适用于治疗2型糖尿病。 申报类别:根据《药品注册管理办法》的有关规定,申报,属化药注册分类3+3类。 申报信息:目前无仿制申报信息 产品特点: 苯甲酸阿格列汀(Alogliptin benzoate)是日本Takeda公司研发的丝氨酸蛋白酶二肽基肽酶IV(DPP-IV)抑制剂,能维持体内胰高血糖素样肽1(GLP-1)和葡萄糖依赖性促胰岛素多肽(GIP)的水平,促进胰岛素的分泌,从而发挥降糖疗效。2010年4月获得日本厚生劳动省的上市批准。 DPP-Ⅳ是由766个氨基酸组成的锚在细胞膜上的跨膜蛋白质分子,在血浆和很多组织的细胞上广泛存在,淋巴细胞表面存在的DPP-Ⅳ被称为CD26,在免疫系统中起着重要作用。DPP-Ⅳ是体内外促使GLP-1降解失活的主要关键酶之一,该酶能通过水解GLP-1的N端第2位丙氨酸致使其失活,所以抑制该酶后可以提高GLP-1浓度,促使胰岛细胞产生胰岛素,同时降低胰高血糖素浓度。 Alogliptin高度选择性地显著抑制DPP-4,延缓胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)的灭活。GLP-1有助于改善胰岛β细胞功能,增加胰岛素分泌,到目前为止,Alogliptin可用于下列血糖控制不好的2型糖尿病患者:单纯饮食和运动疗法治疗者,可单独使用Alogliptin;饮食和运动疗法及α-葡萄糖苷酶抑制剂(α-glucosidase inhibitor)或噻唑烷二酮类治疗者,可加用Alogliptin。Alogliptin具有很强的靶向特异性,在病人血糖正常时该药没有活性,不会导致低血糖。 Alogliptin对于2型糖尿病病人耐受性良好,无剂量限制性毒性,在多剂量给药时未出现药物蓄积现象,肝、肾功能不全病人亦无需调整剂量且药动学结果也不受食物影响在研究中亦未发现严重不良反应事件和死亡的病例也没有病人因不良反应而中途退出在已发现的不良反应中,最常见的为头痛,此外还有便秘和低血糖。 市场情况: 糖尿病是一种困扰全球的慢性病,目前全世界约有2.3亿病人,估计到2025年糖尿病病人数目将增加到3亿,2型糖尿病多在35~40岁之后发病,占糖尿病病人90%以上,随着生活水平的提高儿童中的发病率近年也有升高的趋势。 DPP-Ⅳ抑制剂口服生物利用度高,与注射剂相比大大提高了病人的依从性,另外DPP-Ⅳ抑制剂可使内源性GLP-1和其他促胰岛素激素保持在生理水平,促进胰岛素分泌,降低血糖并且能避免低血糖、肥胖等并发症,因此这类药物非常适合2型糖尿病的早期治疗。Alogliptin是继西他列汀sitagliptin,维格列汀vildagliptin问市后又一种口服有效的特异性DPP-Ⅳ抑制剂研究表明,该药适宜口服,qd,无论单用还是与其他抗糖尿病药物合用均能明显降低糖尿病病人HbA1c水平,具有临床意义并具有良好的耐受性,而且不会引起病人体重的增加,也不会带来低血糖的风险,可以预见今后将会有更多的DPP-Ⅳ抑制剂问世。 开发上市情况: 苯甲酸阿格列汀(Alogliptin benzoate)是日本Takeda公司研发的丝氨酸蛋白酶二肽基肽酶IV(DPP-IV)抑制剂,能维持体内胰高血糖素样肽1(GLP-1)和葡萄糖依赖性促胰岛素多肽(GIP)的水平,促进胰岛素的分泌,从而发挥降糖疗效。2010年4月获得日本厚生劳动省的上市批准。 知识产权状况: 原始化合物中国专利未被授权。 研发进度:已开发完毕,待申报。 提供各种报批所需杂质。
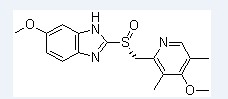
埃索美拉唑钠 技术转让 埃索美拉唑钠原料及粉针(6+6) 药品名称:埃索美拉唑钠 英文名:Esomeprazole sodium 化学名称: 5-甲氧基-2-((S)-((4-甲氧基-3,5-二甲基-2-吡啶基)甲基)亚磺酰基-1H-苯并咪唑钠 剂型及规格:冻干粉针剂,40mg 适应症:作为当口服疗法不适用时,胃食管反流病的替代疗法。本品通常应短期用药(不 超过7天),一旦可能就应转为口服治疗。 申报类别:根据《药品注册管理办法》的有关规定,申报,属化药注册分类6+6类。 申报信息:目前无仿制申报信息 产品特点: 埃索美拉唑是奥美拉唑的S-旋光异构体, 是全球首个异构体质子泵抑制剂(PPI), 通过特异性抑制胃壁细胞质子泵减少胃酸分泌。 经大量临床实验和药物研究证实: 其维持胃内pH>4的时间更长, 抑酸效率更高, 疗效优于前两代PPI,个体差异小。 作为新一代PPI, 现已广泛应用于临床治疗诸多酸相关疾病。 质子泵抑制剂(PPI)是治疗消化性溃疡、胃食管反流病等酸相关疾病的首选药物。目前临床上常用的PPI有奥美拉唑、兰索拉唑、雷贝拉唑、泮托拉唑和埃索美拉唑5种。奥美拉唑作为第一种PPI药物,其治疗酸相关疾病的疗效得到了一致认可。埃索美拉唑,商品名耐信(Nexium),是奥美拉唑的单一异构体,即(S)-异构体。由于具有代谢优势,埃索美拉唑较奥美拉唑具有更高的生物利用度和更一致的药代动力学,使到达质子泵的药物增加,抑酸效果优于其他PPI。 虽然口服埃索美拉唑能获得良好临床效果,但是在某些患者,如吞咽困难、呕吐、急性上消化道出血及外科大手术恢复期患者,口服成为一种不可行的给药途径时,静脉给药途径就成为必然的选择。因此,注射用埃索美拉唑钠适用于需要使用PPI却无法口服给药的患者。 临床应用: (1)胃食管反流病 用于治疗反流性食管炎和(或)具有严重反流症状的患者。静脉应用埃索美拉唑可使糜烂性食管炎的治愈率达到80%,当胃食管反流病患者有吞咽困难、呕吐、出血等并发症时,静脉给予埃索美拉唑能迅速有效地抑制胃酸分泌,长时间维持胃内pH>4,从而达到良好的治疗效果。 (2)上消化道出血 对于非食管静脉曲张性上消化道出血的处理,通常首先在胃镜下止血, 止血成功后迅速应用药物提高胃内pH至6以上,以促进血小板凝集和防止血栓溶解,预防再出血。目前公认能迅速提高胃内pH>6以上,以奥美拉唑80 mg即刻静注,继以8 mg/h维持静脉滴注的抑酸效果较为理想。埃索美拉唑的抑酸作用优于奥美拉唑且持续时间更长, 勿庸置疑,其用于治疗急性上消化道出血将更为有效且方便。 (3)应激性溃疡 胃内pH改变与胃黏膜病变密切相关,如能有效控制胃酸分泌和胃腔内酸度,某种程度上就能控制并治愈胃黏膜在应激状态时的病理改变。现有研究表明,静脉注射奥美拉唑能快速提高胃内pH,有效治疗应激性溃疡。由于埃索美拉唑维持胃内pH>4的时间更长,相信其用于治疗应激性溃疡效果更为显著。 总之,新一代注射用PPI埃索美拉唑钠因具有独特的药代动力学特点,其抑酸能力较口服埃索美拉唑及其他注射用PPI更快、更有效。对于临床需要使用PPI却无法口服给药的患者,如急性上消化道出血和应激性溃疡等,注射用埃索美拉唑可提供强效抑酸和全面的保护。 市场情况: 现在市场上可供选择的PPI类药物种类繁多,经研究提示,埃索美拉唑(耐信?)在抑酸疗效持续时间方面最具优势。该研究将埃索美拉唑与奥美拉唑、兰索拉唑、泮托拉唑和雷贝拉唑治疗有症状GERD患者的疗效进行比较,结果埃索美拉唑使患者胃中pH值>4的时间长达15.3小时,而使用雷贝拉唑的患者该时长为13.3小时(P=0.0004),使用奥美拉唑、兰索拉唑、泮托拉唑的患者该时长则分别为12.9小时、12.7小时和11.2小时(P值均≤0.0001)。在对健康志愿者进行的类似研究中,埃索美拉唑使参试者胃中pH值>4的时间也是最长的,可达14小时。埃索美拉唑的疗效已被大量临床研究证实,相信日后会有更多GERD患者从其治疗中获益。 开发上市情况: 国外,注射用埃索美拉唑钠于2007年 4月3日FDA批准AstraZeneca AB上市。 国内,该品种于2009年3月批准阿斯利康制药上市。 知识产权状况: 埃索美拉唑在中国有一系列专利,根据其特性分为四部分:(1)化合物专利;(2)晶型专利;(3)制备方法专利;(4)组合物专利。 重点专利分析如下: 化合物专利,专利号:ZL 94190335.4,其将于2014年5月27日到期,该专利保护了埃索美拉唑的钠盐、镁盐、锂盐、钾盐、钙盐和铵盐。 中国专利ZL99118539.0保护了埃索美拉唑的钠盐、镁盐、锂盐、钾盐、钙盐和铵盐在治疗胃肠疾病中的应用,该专利为埃索美拉唑化合物专利ZL 94190335.4的分案申请,该专利存在与其化合物专利相同的缺陷。 研发进度:已开发完毕,待申报。 提供各种报批所需杂质。

莫西沙星 技术转让 盐酸莫西沙星原料,片或注射剂或滴眼液(3+6) 药品名称:盐酸莫西沙星 英文名称:Moxifloxacin hydrochloride 化学名称:1-环丙基-7-(S,S-2,8-重氮-二环[4.3.0]壬烷-8-基)-6-氟-8-甲氧-1,4-二氢-4-氧-3-喹啉羧酸盐酸盐 剂型及规格:0.4g/片,小水针0.4g:10ml,葡萄糖注射液:0.4g∶250ml 适应症:治疗患有上呼吸道和下呼吸道感染的成人。如急性窦炎、慢性支气管炎急性发作、社区获得性肺炎、以及皮肤和软组织感染。 申报类别:根据《药品注册管理办法》的有关规定,申报属化药注册分类3+6。 产品特点: 莫西沙星由德国Bayer公司研制,1999年首次在德国上市,先后在英国,美国,墨西哥应用。中国于2002年由拜耳上市莫西沙星片剂(400mg),2004年上市莫西沙星氯化钠注射液,商品名拜复乐(Avelox)。莫西沙星作为新一代喹诺酮,有如下优势:1.CAPPIE研究证实,莫西沙星治疗老年CAP((community acquired pneumonia社区获得性肺炎)疗效和安全性优于氧氟沙星;2.疗效卓越——全面覆盖革兰氏阴性菌、革兰氏阳性菌、厌氧菌和非典型病原体,对CAP有卓越的临床治愈率和细菌清除率;3.降低死亡率——在TARGET研究中,死亡率可降低43%;4.节约费用——缩短住院时间,更快口服序贯治疗;5.权威推荐——AST等国际指南一致推荐作为CAP及早发HAP一线用药;6.一天一次——400mg单药治疗,安全性好,不需皮试,方便安全;7.持久强效——有效预防耐药产生. 市场情况: 莫西沙星是由德国拜耳公司推出的产品,属于第四代喹诺酮类药物,1999年9月在德国上市,1999年12月10日通过FDA审批,商品名Avelox,目前已在世界许多国家地区用于临床。2003年4月爱尔康公司开发的莫西沙星滴眼剂也获FDA批准上市。许多文献介绍,莫西沙星与克拉霉素、头孢呋辛、左氧氟沙星临床对照,在抗感染方面具有更大的优势。莫西沙星抗革兰阳性菌的活性约比环丙沙星强4倍,具有抗厌氧菌、支原体、衣原体等作用和光敏反应低的特点,且对一些耐药性细菌也有较好的抗首效果,在有效的学术推广下,正在以较快的速度分食抗菌素市场。 莫西沙星虽然上市时间不长,但是优良的作用机制,带动了市场销售,尤以呼吸道细菌性感染、慢性支气管炎急性细菌性发作、阻塞性肺病、社区获得性肺炎治疗中表现出显著效果,其强大的细胞组织穿透力得到了医生、患者的认可,2000年获得了1.22亿美元的良好收益,2002年销售额达到3.38亿美元,进入了2002年世界十大畅销抗生素药物,列第8位,已成为全球十分抢眼的药物。2006年的世界市场销售额高达8.22亿美元,在全球畅销处方药排名第129位;2007年世界市场销售额高达10.34亿美元,比上年增长25.8%;2008年为5.75亿美元。 国外厂商对中国市场寄予莫大的期望,拜耳公司在国外临床试验的同时,已申请在我国进行临床,2002年下半年,莫西沙星片在我国上市,2004年拜耳公司的盐酸莫西沙星氯化钠注射液上市,商品名拜复乐,由拜耳及北京拜耳医药保健有限公司进行销售,重点市场是我国大中城市的主要医院。。从2003年16城市样本医院用药看,莫西沙星以其良好的效果在许多地区较为畅销,在重庆和济南两个地区进入前200位用药中。该药2004年进入国家医保目录后,连续3年出现惊人的增长率:2003年到2007年的复合增长率为116%,2007年城市样本医院购药金额为2.16亿元,比上年增长了75.1%;2008年上半年为1.62亿元。拜复乐2008全年销售额6.30亿元,2009年全年销售额达到8.20亿元,2010年预计拜复乐的国内销售额为10亿元。 知识产权状况: 化合物专利2012年底到期,申请报原料没问题,氯化钠注射液有专利,现在不宜申报,现在可以申报的剂型有:片剂,葡萄糖注射液,小水针。 研发进度: 已开发完毕,待申报。 提供各种报批所需杂质。 莫西沙星对映异构体, 莫西沙星侧链对映异构体,莫西沙星杂质A,B, C, D, E 合作方式:面议。

恩替卡韦 技术转让 恩替卡韦原料,胶囊或分散片(6+6) 药品名称:恩替卡韦 英文名:Entecavir 化学名称:9-(4-羟基-3-羟甲基-2-亚甲基环戊-1-基)鸟嘌呤 剂型及规格:胶囊+分散片,0.5mg 适应症:慢性乙型肝病的治疗 申报类别:根据《药品注册管理办法》的有关规定,申报,属化药注册分类6+6类。 产品特点: 自从拉米夫定作为唯一被批准上市的口服核苷类药物投入市场以来,在抑制乙肝病毒(HBV)复制,降低病毒载量,使血清丙氨酸转氨酶(ALT)降至正常,e抗原转阴及肝组织炎症坏死的改善等方面取得了确切的疗效。但长期应用拉米夫定可使HB V发生变异,降低病毒对拉米夫定的敏感程度,以及停药后出现病毒复制的反跳。因此国际上研究开发了多种核苷类的抗病毒药物,以克服耐药性。恩替卡韦是一种2’ -戊环脱氧尿嘌呤核苷类似物,具有极强的抗肝炎病毒能力。其临床疗效优于拉米夫定。 临床应用: 临床疗效:在301名健康志愿者中,已进行口服恩替卡韦单剂量(范围:0.5-4.0 mg?d-1)和多剂量(范围:0.1-2 0 mg?d-1)试验,以研究恩替卡韦的安全性和药代动力学。结果显示低剂量常见不良反应为排尿困难和腹泻;高剂量组为头痛、眩晕、腹痛、恶心、光过敏等。所有反应均轻微而温和,大多数病人继续服药可自行缓解。 试验表明恩替卡韦不仅有较强的抗病毒能力,而且由于不同的作用机制,长期应用耐药的发生率较低。其他相关的研究显示,它是新的很有希望的核苷类抗病毒药物,对肝细胞内ccc DNA有直接抑制作用,可有效地治疗慢性乙型肝炎,目前正在评估其长期应用的有效性和安全性。慢乙肝病人抗病毒治疗的发展趋势是联合用药。 市场情况: 4亿慢性乙肝患者,75%生活在亚太地区。市场潜力巨大。由于目前的专利和上市等原因,本品在美国市场零售30.美元一片,国内约35元一片。利润巨大。 2005年11月15日,由中美上海施贵宝制药有限公司引入中国的Baraclude获得了SFDA批准在国内上市.虽然恩替卡韦在医院的销售还没有具体的数据反映,但业内人士的调查显示,恩替卡韦在今年一季度就已完成了全国几百家医院的进药工作,而且市场反应热烈. 4月底在维也纳召开的第41届欧洲肝病年会上公布的96周临床试验数据显示,恩替卡韦治疗核苷初治的e抗原(HBeAg)阴性慢性乙型肝炎患者在降低病毒载量方面疗效优于拉米夫定.94%接受恩替卡韦治疗的患者在96周治疗期间出现了病毒载量转阴(低于300拷贝/m1),拉米夫定组为77%,两组具有统计学差异(P

利伐沙班 技术转让 利伐沙班原料及片(3+6) 药品名称:利伐沙班,拜瑞妥 英文名:Rivaroxaban 化学名称:5-氯-N-(((5S)-2-氧代-3-(4-(3-氧代吗啉-4-基)苯基)-1,3-恶唑啉-5-基)甲基)噻吩-2-甲酰胺 剂型及规格:利伐沙班片,10mg/片 适应症: 用于择期髋关节或膝关节置换手术成年患者,以预防静脉血栓形成(VTE)。 也可用于预防非瓣膜性心房纤颤患者脑卒中和非中枢神经系统性栓塞,降低冠状动脉综合症复发的风险等。 申报类别:根据《药品注册管理办法》的有关规定,申报,属化药注册分类3+6类。 产品特点: 利伐沙班是拜耳公司历经10年研发的新型抗凝药物,是全球第一个直接Xa因子抑制剂,Xa因子是外源性和内源性凝血途径的交汇点,是凝血过程中的关键点。拜瑞妥即高选择性、直接抑制Xa因子活性,从而抑制凝血酶的生成和血栓的形成。 Xa因子是内源性凝血途径和外源性凝血途径的结合点,在凝血过程中起关键作用,因此被认为是新型抗凝药研发中非常重要的靶点。众多研究表明,单一抑制Xa因子,可以更有效抗凝,疗效可预测,其治疗窗宽,且对正常止血过程无影响,此外,从理论上讲,直接抑制Xa因子,停药后不引起反弹。因此,选择Xa因子作为作用靶点,将可能产生更优的临床疗效,而且对凝血过程的影响可控。 拜瑞妥的药代动力学研究显示,其起效迅速,给药后2-4小时可以快速达到血浆浓度峰值。绝对生物利用度高达80-100%。而且服用后1-4小时即可获得最大抑制Xa 因子的作用,抗Xa活性维持时间长,长达24小时。 研究表明,拜瑞妥不同剂量多次给药后均无蓄积。其在健康年轻受试者体内半衰期为5-9小时,老年受试者体为半衰期为11-13小时。拜瑞妥通过粪便和肾脏双重清除,约有2/3通过代谢降解,然后其中一半通过肾脏清除,另外一半通过粪便途径清除。剩下的1/3以原型直接通过肾脏清除。拜瑞妥原型是人体血浆内最重要的化合物,尚未发现主要的或具有活性的循环代谢产物。 临床应用: 推荐剂量为口服拜瑞妥10mg,每日一次。如伤口已止血,首次用药时间应于手术后6-10小时之间进行。治疗疗程由患者所接受的骨科手术类型而定:对于接受髋关节大手术的患者,推荐一个治疗疗程为服药5周;对于接受膝关节大手术的患者,推荐一个治疗疗程为服药2周。 拜瑞妥的临床特点:口服,无需注射,10mg,一日一次;起效快;生物利用度高;无需根据年龄、性别、体重和种族等调整剂量;无需常规凝血功能监测;用药不受食物影响;大型临床研究表明,与依诺肝素相比,拜瑞妥可更进一步降低髋关节或膝关节置换术后静脉血栓栓塞事件的发生率;安全性与依诺肝素相当。拜瑞妥用于术后VTE预防有效、安全,临床应用简便,将有可能成为VTE预防的理想选择。 开发上市情况: 拜瑞妥是拜耳公司历经10年研发的新型抗凝药物,是全球第一个直接Xa因子抑制剂,为化学合成的小分子化合物,分子量435.89,通用名利伐沙班片。自2008年9月起,拜瑞妥已在全球50多个国家上市,并于2009年6月在中国正式上市。 知识产权状况: 研发进度:已开发完毕,待申报。 提供各种报批所需杂质。 合作方式:面议。